中 国 创 新 药 市 场 研 究 简 析
出品机构:甲子光年智库
研究指导:宋涛
研究团队:周航
发布时间:2022.11
�
目 录
Part 01
概念界定
Part 02
发展历程
Part 03
市场环境
Part 04
行业周期
Part 05
产业链分析
Part 06
市场规模
Part 07
主要应用场景/治疗疾病方向
Part 08
细分市场分析
Part 09
未来发展趋势
�
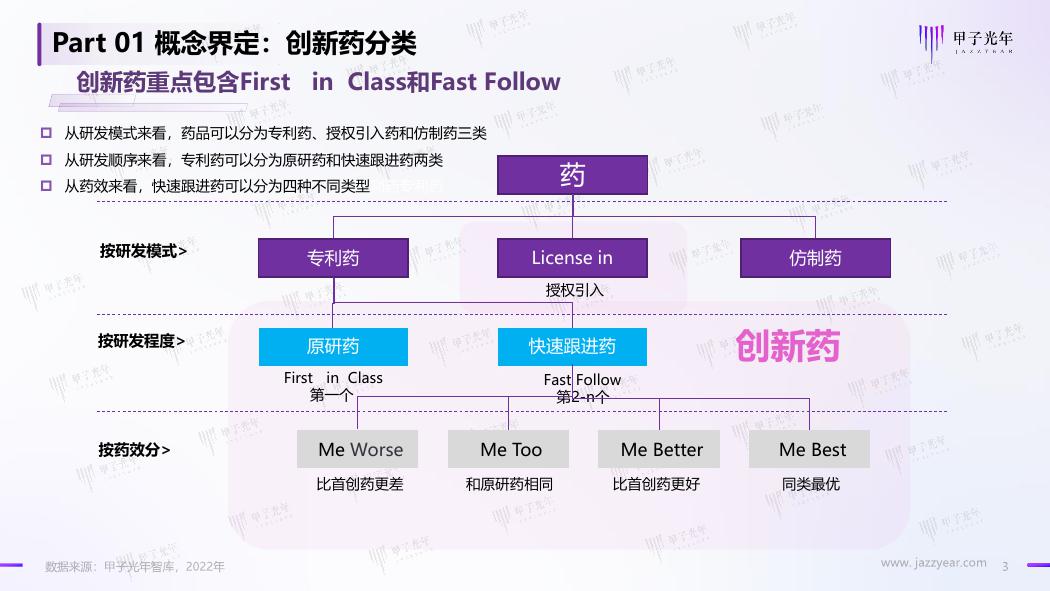
Part 01 概念界定:创新药分类
创新药重点包含First in Class和Fast Follow
从研发模式来看,药品可以分为专利药、授权引入药和仿制药三类
从研发顺序来看,专利药可以分为原研药和快速跟进药两类
从药效来看,快速跟进药可以分为四种不同类型利药专利药
药
按研发模式>
专利药
按研发程度>
原研药
First in Class
第一个
License in
授权引入
快速跟进药
Fast Follow
第2-n个
按药效分>
Me Worse
Me Too
Me Better
比首创药更差
和原研药相同
比首创药更好
仿制药
创新药
Me Best
同类最优
�
Part 01 概念界定:概念与主要特点
概念
主要特点
仿制药
仿制国家已批准正式生产、并收载于国家
药品标准(包括《中国生物制品规程》)的
品种。与原研药品生物等效,临床上可相
互替代
Me too drug
一类具有新的化学结构,但其结构与已知
药物相似,具有自主知识产权,且其治疗
作用与已知药物相同的新药
原研药
通过了药品管理机构的质量、安全性与有
效性评价,第一个获得上市许可的药品
维度
仿制药 Me too drug
原研药
集中地区 发展中国家首选
发展水平较高的发
展中国家
发达国家产业更加
成熟
解决问题
降低医疗费用,
增大医疗范围
降低对进口的依赖
程度;是仿制向创
制转轨的捷径
对原研药的保护,
可以激发药企开发
新药的热情
使用范围 ★★★★★
价格
★★☆☆☆
★★★☆☆
★★★☆☆
★☆☆☆☆
★★★★★
研发难度 ★☆☆☆☆
★★★☆☆
★★★★★
研发投入 ★☆☆☆☆
★★★★☆
★★★★★
研发收益 ★★☆☆☆
★★★☆☆
★★★★★★
�
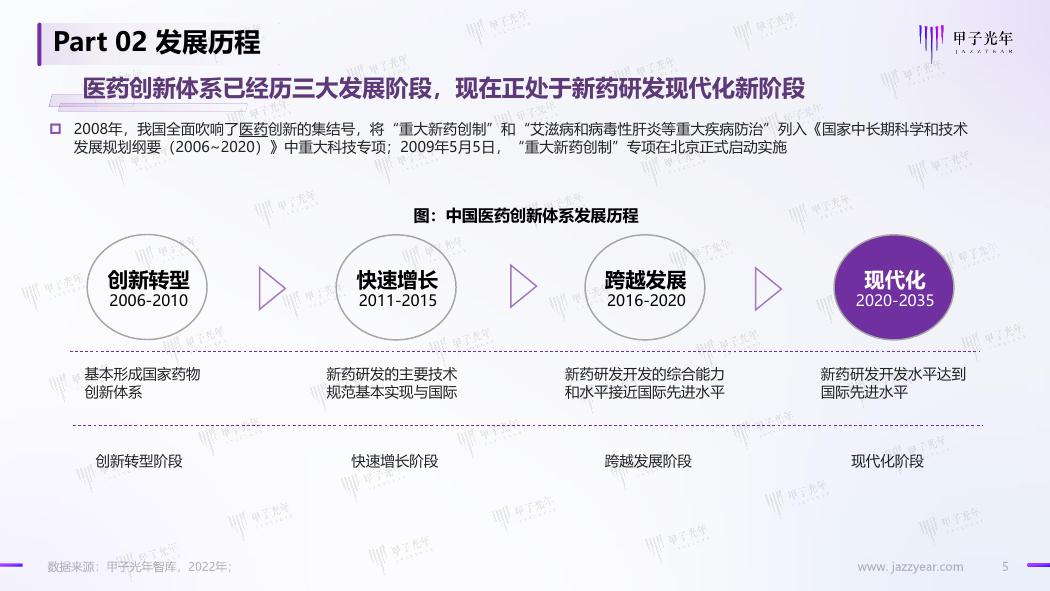
Part 02 发展历程
医药创新体系已经历三大发展阶段,现在正处于新药研发现代化新阶段
2008年,我国全面吹响了医药创新的集结号,将“重大新药创制”和“艾滋病和病毒性肝炎等重大疾病防治”列入《国家中长期科学和技术
发展规划纲要(2006~2020)》中重大科技专项;2009年5月5日,“重大新药创制”专项在北京正式启动实施
图:中国医药创新体系发展历程
创新转型
2006-2010
快速增长
2011-2015
跨越发展
2016-2020
现代化
2020-2035
基本形成国家药物
创新体系
新药研发的主要技术
规范基本实现与国际
新药研发开发的综合能力
和水平接近国际先进水平
新药研发开发水平达到
国际先进水平
创新转型阶段
快速增长阶段
跨越发展阶段
现代化阶段
�
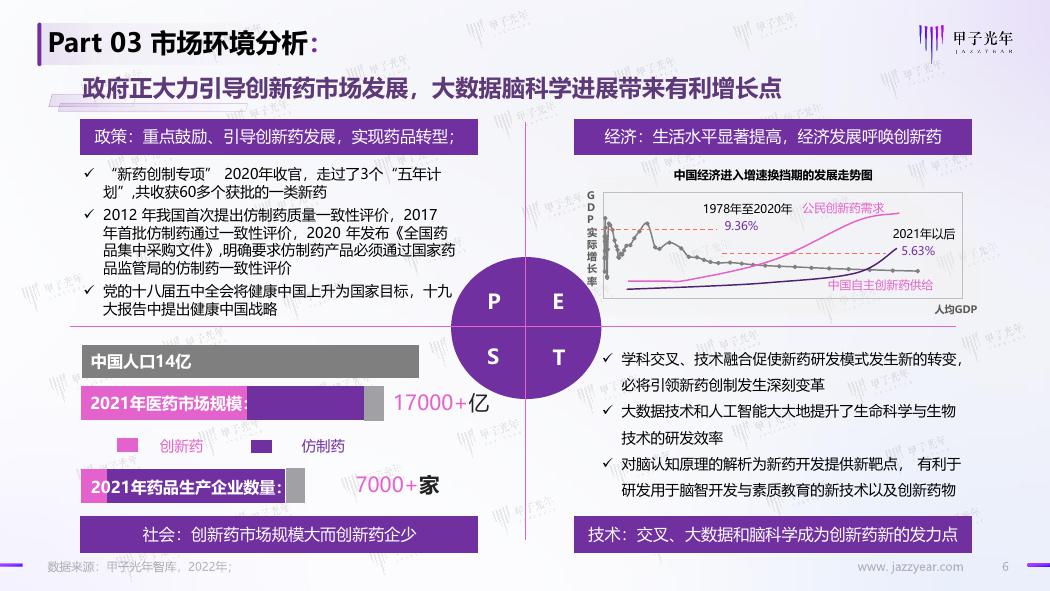
Part 03 市场环境分析:
政府正大力引导创新药市场发展,大数据脑科学进展带来有利增长点
政策:重点鼓励、引导创新药发展,实现药品转型;
经济:生活水平显著提高,经济发展呼唤创新药
✓ “新药创制专项” 2020年收官,走过了3个“五年计
划”,共收获60多个获批的一类新药
✓ 2012 年我国首次提出仿制药质量一致性评价,2017
年首批仿制药通过一致性评价,2020 年发布《全国药
品集中采购文件》,明确要求仿制药产品必须通过国家药
品监管局的仿制药一致性评价
✓ 党的十八届五中全会将健康中国上升为国家目标,十九
大报告中提出健康中国战略
中国人口14亿
G
D
P
实
际
增
长
率
P
S
E
T
2021年医药市场规模:
17000+亿
创新药
仿制药
2021年药品生产企业数量:
7000+家
中国经济进入增速换挡期的发展走势图
1978年至2020年
公民创新药需求
9.36%
2021年以后
5.63%
中国自主创新药供给
人均GDP
✓ 学科交叉、技术融合促使新药研发模式发生新的转变,
必将引领新药创制发生深刻变革
✓ 大数据技术和人工智能大大地提升了生命科学与生物
技术的研发效率
✓ 对脑认知原理的解析为新药开发提供新靶点, 有利于
研发用于脑智开发与素质教育的新技术以及创新药物
社会:创新药市场规模大而创新药企少
技术:交叉、大数据和脑科学成为创新药新的发力点
�
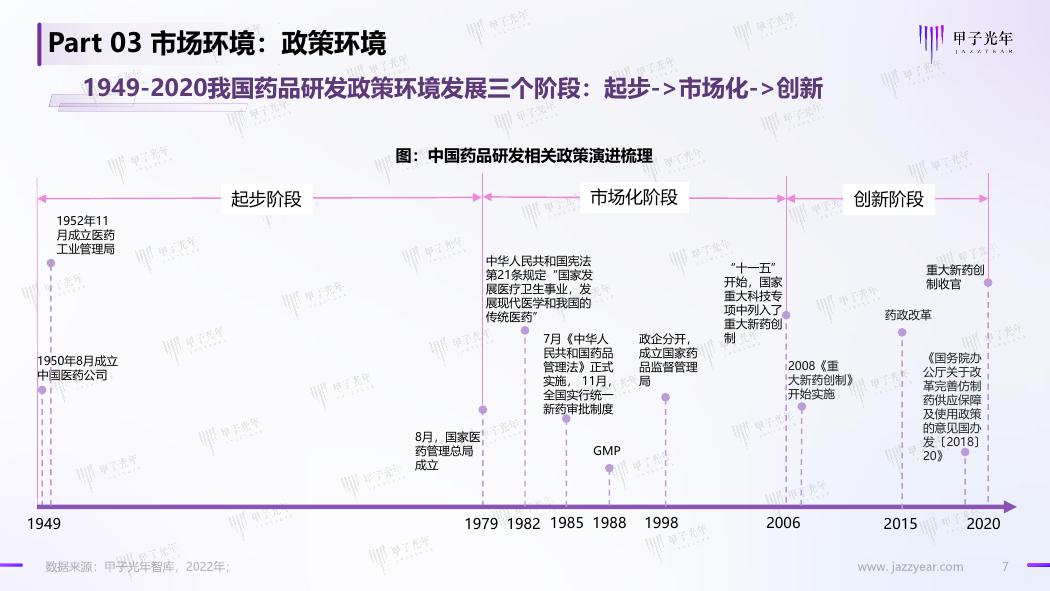
Part 03 市场环境:政策环境
1949-2020我国药品研发政策环境发展三个阶段:起步->市场化->创新
图:中国药品研发相关政策演进梳理
起步阶段
市场化阶段
创新阶段
1952年11
月成立医药
工业管理局
1950年8月成立
中国医药公司
中华人民共和国宪法
第21条规定“国家发
展医疗卫生事业,发
展现代医学和我国的
传统医药”
政企分开,
成立国家药
品监督管理
局
7月《中华人
民共和国药品
管理法》正式
实施, 11月,
全国实行统一
新药审批制度
GMP
“十一五”
开始,国家
重大科技专
项中列入了
重大新药创
制
2008《重
大新药创制》
开始实施
重大新药创
制收官
药政改革
《国务院办
公厅关于改
革完善仿制
药供应保障
及使用政策
的意见国办
发〔2018〕
20》
8月,国家医
药管理总局
成立
1949
1979
1982
1985
1988
1998
2006
2015
2020
�
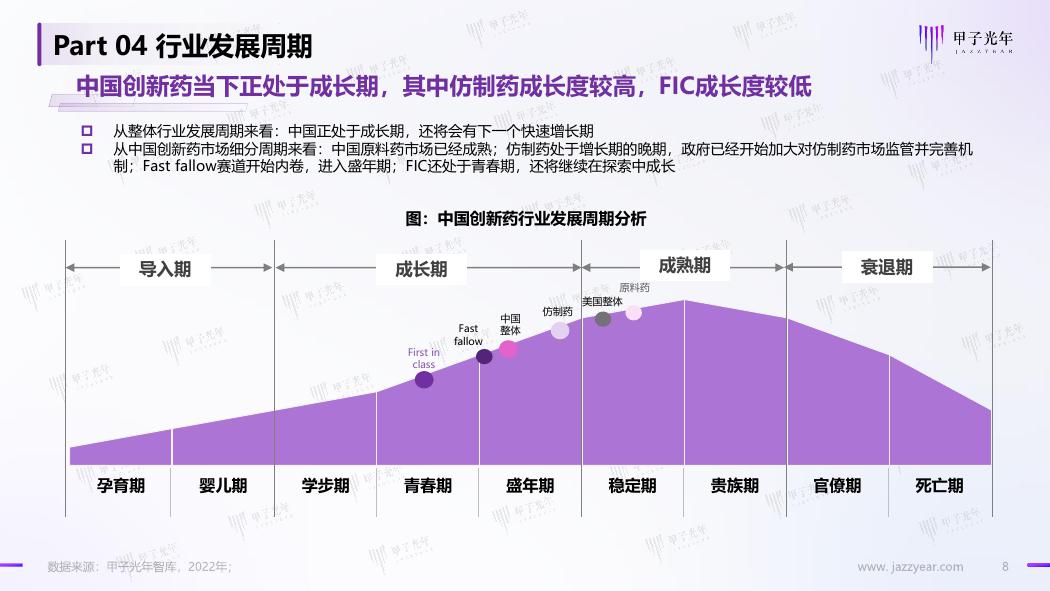
Part 04 行业发展周期
中国创新药当下正处于成长期,其中仿制药成长度较高,FIC成长度较低
从整体行业发展周期来看:中国正处于成长期,还将会有下一个快速增长期
从中国创新药市场细分周期来看:中国原料药市场已经成熟;仿制药处于增长期的晚期,政府已经开始加大对仿制药市场监管并完善机
制;Fast fallow赛道开始内卷,进入盛年期;FIC还处于青春期,还将继续在探索中成长
图:中国创新药行业发展周期分析
导入期
成长期
成熟期
衰退期
原料药
美国整体
仿制药
中国
整体
Fast
fallow
First in
class
孕育期
婴儿期
学步期
青春期
盛年期
稳定期
贵族期
官僚期
死亡期
�











 V2版本原理图(Capacitive-Fingerprint-Reader-Schematic_V2).pdf
V2版本原理图(Capacitive-Fingerprint-Reader-Schematic_V2).pdf 摄像头工作原理.doc
摄像头工作原理.doc VL53L0X简要说明(En.FLVL53L00216).pdf
VL53L0X简要说明(En.FLVL53L00216).pdf 原理图(DVK720-Schematic).pdf
原理图(DVK720-Schematic).pdf 原理图(Pico-Clock-Green-Schdoc).pdf
原理图(Pico-Clock-Green-Schdoc).pdf 原理图(RS485-CAN-HAT-B-schematic).pdf
原理图(RS485-CAN-HAT-B-schematic).pdf File:SIM7500_SIM7600_SIM7800 Series_SSL_Application Note_V2.00.pdf
File:SIM7500_SIM7600_SIM7800 Series_SSL_Application Note_V2.00.pdf ADS1263(Ads1262).pdf
ADS1263(Ads1262).pdf 原理图(Open429Z-D-Schematic).pdf
原理图(Open429Z-D-Schematic).pdf 用户手册(Capacitive_Fingerprint_Reader_User_Manual_CN).pdf
用户手册(Capacitive_Fingerprint_Reader_User_Manual_CN).pdf CY7C68013A(英文版)(CY7C68013A).pdf
CY7C68013A(英文版)(CY7C68013A).pdf TechnicalReference_Dem.pdf
TechnicalReference_Dem.pdf