2022-2023 学年江苏省徐州市九年级上学期化学第三次月考
试题及答案
可能用到的相对原子质量:H:1
C:12
O:16
Ca:40
Fe:56
Cl:35.5
一、选择题(共 10 题,20 分)
1. 从人类文明的历史来看,铜、铁、铝、钛等金属广泛使用的先后顺序正确的是
A. 铜、铁、铝、钛
C. 铜、铁、钛、铝
【答案】A
【解析】
B. 铁、铜、铝、钛
D. 钛、铝、铜、铁
【详解】金属的使用先后与金属活动性有关,越活泼的金属越易以化合物形式存在,越难以
冶炼成金属单质,越晚被使用,铜、铁、铝、钛等金属广泛使用的先后顺序正确的是铜、铁、
铝、钛,故选 A。
2. 下列过程主要发生化学变化的是
A. 水结冰
B. 铁矿石炼铁
C. 风力发电
D. 石蜡融
化
【答案】B
【解析】
【详解】A、水结冰,属于凝固,没有新物质产生,属于物理变化;故选项错误;
B、铁矿石炼铁,有新物质产生,属于化学变化;故选项正确;
C、风力发电,将风能转化为电能,没有新物质产生,属于物理变化;故选项错误;
D、石蜡熔化,属于熔化;没有新物质产生,属于物理变化;故选项错误;
故选:B。
3. 下列化学用语表示正确的是
A. 氯原子结构示意图:
B. 2 个氢氧根:2OH2-
C. 氧化镁的化学式:MgO2
D. 60 个氮原子:N60
【答案】A
【解析】
【详解】A、氯原子核内有 17 个质子,核外有 3 个电子层,第一层上有 2 个电子、第二层上
�
有 8 个电子,最外层上有 7 个电子,其原子结构示意图为
,正确;
B、1 个氢氧根离子带 1 个单位负电荷,表示微粒的个数在微粒前面加对应数字;2 个氢氧根
离子表示为 2OH-,错误;
C、化合物中正负化合价代数和为零,氧化镁的化学式为 MgO,错误;
D、表示微粒的个数在微粒前面加对应数字,原子用元素符号表示,60 个氮原子表示为 60N,
错误。
故选 A。
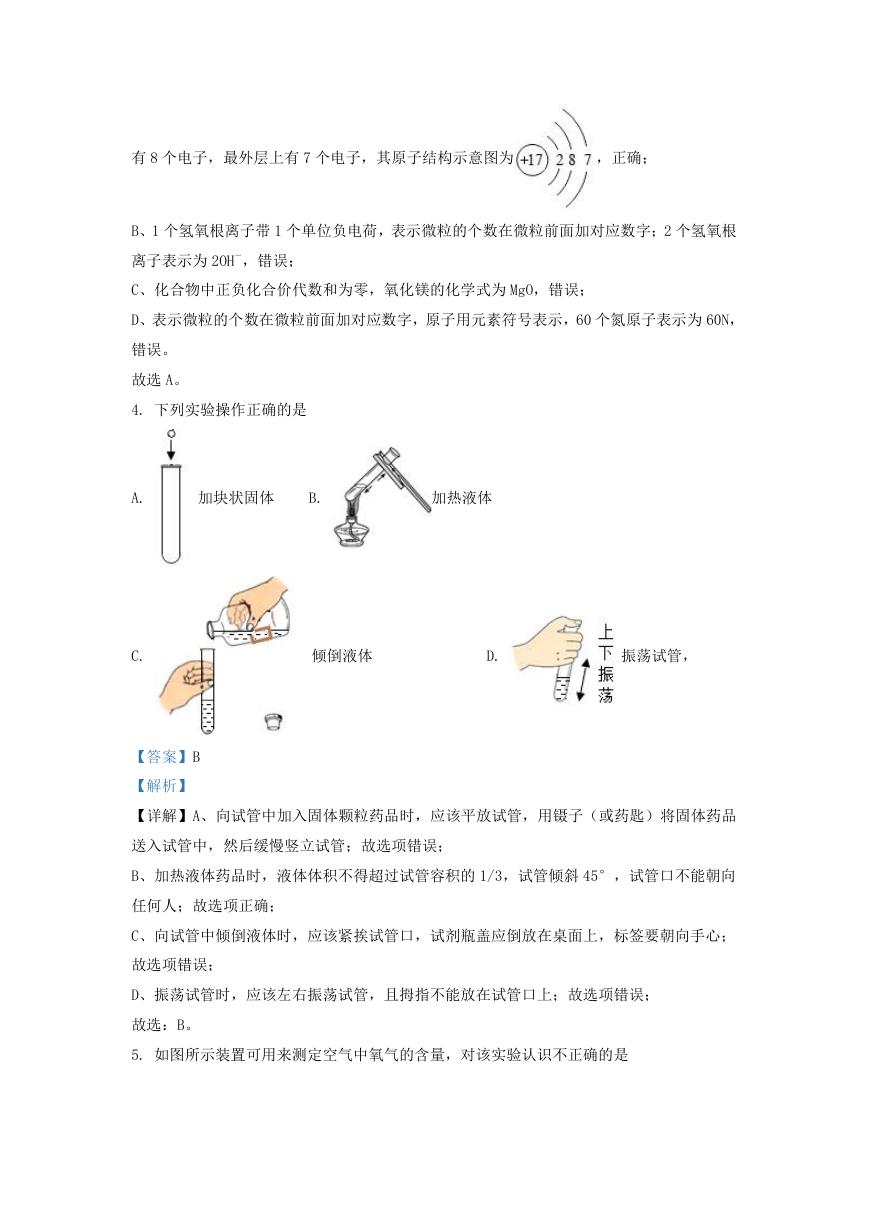
4. 下列实验操作正确的是
A.
加块状固体
B.
加热液体
C.
倾倒液体
D.
振荡试管,
【答案】B
【解析】
【详解】A、向试管中加入固体颗粒药品时,应该平放试管,用镊子(或药匙)将固体药品
送入试管中,然后缓慢竖立试管;故选项错误;
B、加热液体药品时,液体体积不得超过试管容积的 1/3,试管倾斜 45°,试管口不能朝向
任何人;故选项正确;
C、向试管中倾倒液体时,应该紧挨试管口,试剂瓶盖应倒放在桌面上,标签要朝向手心;
故选项错误;
D、振荡试管时,应该左右振荡试管,且拇指不能放在试管口上;故选项错误;
故选:B。
5. 如图所示装置可用来测定空气中氧气的含量,对该实验认识不正确的是
�
A. 红磷的量不足会影响实验结论
B. 装置不漏气是实验成功的重要因素之一
C. 将红磷改为碳也能得到正确的实验结论
D. 随着集气瓶内气体压强的减小水可以被压入集气瓶中
【答案】C
【解析】
【详解】A、红磷的量不足时,它所消耗的氧气也就不完全;导致空气中氧气的含量测定结
果偏小,会影响了实验结论,故 A 正确;
B、装置不漏气时才能保证该实验是在一个密闭的环境中进行的,才能使实验更加准确,故
B 正确;
C、如果将红磷改为碳来进行空气中氧气的含量测定实验,由于碳燃烧后生成二氧化碳气体,
集气瓶内的气压不降低,水不能倒流,不能得到正确的实验结论,故 C 不正确;
D、根据物理学中的压强知识可知随着集气瓶内气体压强的减小水可以被压入集气瓶中,进
而测定出空气中氧气的含量,故 D 正确。
故选:C。
6. 下列实验现象描述正确的是
A. 木炭在空气中燃烧生成二氧化碳
B. 铁在空气中燃烧火星四射,生成黑色固体
C. 干冰在空气中会产生大量的白烟
D. 镁条燃烧发出耀眼的白光,生成白色固体
【答案】D
【解析】
【详解】A、木炭在空气中燃烧生成无色无味的气体,生成二氧化碳是实验结论,不是实验
现象;故选项错误;
B、铁在空气中不能燃烧;故选项错误;
C、干冰在空气中升华,会产生大量的白雾;故选项错误;
D、镁条燃烧发出耀眼的白光,生成白色固体;故选项正确;
故选:D。
�
7. 下列推理正确的是
A. 蔗糖以分子形式分散在水中,所以物质都以分子分散到水中
B. CO2 能灭火,所以能使燃着的木条熄灭的无色气体一定是 CO2
C. 铜锈的主要成分是 Cu2 (OH) 2CO3,所以铜生锈可能与 H2O, CO2, O2 有关
D. 金属和稀盐酸反应能生成气体,所以和稀盐酸反应生成气体的物质一定是金属
【答案】C
【解析】
【详解】A、蔗糖以分子形式分散在水中,但不是物质都以分子分散到水中,例如氯化钠溶
液存在氯离子和钠离子;故选项错误;
B、CO2 能灭火,但能使燃着的木条熄灭的无色气体不一定是二氧化碳,可能是氮气等不支持
燃烧的气体;故选项错误;
C、铜锈的主要成分是 Cu2 (OH) 2CO3,该反应符合元素守恒,所以铜生锈可能与 H2O, CO2, O2
有关;故选项正确;
D、金属和稀盐酸反应能生成气体,但和稀盐酸反应生成气体的物质不一定是金属,例如石
灰石与稀盐酸反应产生二氧化碳气体;故选项错误;
故选:C。
8. 高锰酸钾和浓盐酸发生如下应:
2KMnO4+16HCl=2KCl=2MnCl2+
5X↑+8H20
根据质量守恒定律,推测 X 应 是
A. HClO
【答案】D
【解析】
B. ClO2
C. O2
D. Cl2
【分析】化学反应遵循质量守恒定律,即参加反应的物质的质量之和,等于反应后生成的物
质的质量之和,是因为化学反应前后,元素的种类不变,原子的种类、总个数不变。
【详解】由 2KMnO4+16HCl=2KCl+2MnCl2+5X↑+8H2O 可知,反应前后钾原子都是 2 个,锰原子
都是 2 个,氧原子都是 8 个,氢原子都是 16 个,反应前氯原子是 16 个,反应后应该是 16
个,其中 10 个包含在 5X 中,因此 X的化学式是 Cl2。故选 D。
9. 维生素 2D 的化学式为 C28H44O,下列关于维生素 2D 的说法正确的是
A. 相对分子质量是 396g
氢原子、1 个氧原子构成
B. 维生素 2D 由 28 个碳原子、44 个
C. 碳元素的质量分数为 84.8%
D. C,H,O 元素的质量比为 28:44:
1
【答案】C
【解析】
【详解】A、相对分子质量等于分子中所有原子的相对原子质量的和,所以维生素 D2 的相对
�
分子质量= (12 28)+(1 44)+16=396
,相对分子质量的单位是“1”不是“g”,“1”通
常省略不写,此选项错误;
B、分子是由原子构成的,所以一个维生素 2D 分子是由 28 个碳原子、44 个氢原子、1 个氧
原子构成,此选项错误;
C、化合物中某元素的质量分数=
该元素的相对原子质量 原子个数
×
相对分子质量
100
%
,所以维
生素 2D 中碳元素的质量分数=
28
12
3
96
10
0%
8 .
4 8%
,此选项正确;
D、化合物中元素的质量比等于相对原子质量乘以原子个数的比,所以维生素 2D 中 C,H,O
元素的质量比= (12 28):(1 44):16=84:11:4
,此选项错误;
故选 C。
10. 在一个密闭容器中,有甲、乙、丙、丁、戊五种物质,在一定条件下发生反应,测得反
应前后各物质的质量变化量如图所示(图中正数表示物质质量的增加量,负数表示物质质量
的减少是,0 表示物质质量不变),下列说法正确的是
A. 该反应一定属于置换反应
B. 戊一定是该反应的催化剂
C. 参加反应的乙、丙的质量比一定为 48:23
D. 该反应中甲、丁的相对分子质量之比一定为 44:27
【答案】C
【解析】
【详解】A、反应后甲、丁质量增大,是生成物,乙、丙质量减小,是反应物,戊质量不变,
可能是催化剂,也可能既不是催化剂也不是反应物和生成物,由题意不能确定物质的种类,
不一定是置换反应,故 A 错误;
B、戊在化学反应前后质量不变,可能是催化剂,也可能既不是催化剂也不是反应物和生成
物,故 B 错误;
�
C、根据图示可知,参加反应的乙、丙的质量比一定=4.8g:2.3g=48:23,故 C 正确;
D、该反应中甲、丁的相对分子质量之比不一定为 44:27,即甲、丁化学计量数之比是 1:1
时,甲、丁的相对分子质量之比为 44:27,甲、丁化学计量数之比不是 1:1 时,甲、丁的
相对分子质量之比不是 44:27,故 D 错误。故选 C。
【点睛】在化学反应中,反应前后质量增加的物质是生成物,质量减少的物质是反应物,质
量不变的物质,可能作该反应的催化剂,也可能没有参加反应。
二、填空题(每空 1 分,方程式 2 分,共 17 分)
11. 按要求用化学符号填空:
(1)2 个氢原子_______;
(2)3 个碳酸根离子_______;
(3)相对分子质量最小的氧化物_______;
(4)氧化铝中铝元素显+3 价_______。
【答案】(1) 2H
2-
3
(2)
3CO
(3) 2H O
(4)
+3
Al O
2
3
【解析】
【小问 1 详解】
元素符号前面的数字表示原子的个数,所以 2 个氢原子表示为 2H 。
【小问 2 详解】
碳酸根离子的符号为 2-
3CO ,离子符号前面加数字表示离子的个数,所以 3 个碳酸根离子表
示为
3CO 。
2-
3
【小问 3 详解】
氧化物的定义:由两种元素组成且其中一种元素为氧元素的化合物为氧化物;氢原子的相对
原子质量最小,所以相对分子质量最小的氧化物是水,化学式为 2H O 。
【小问 4 详解】
由氧化铝的名称可知,氧化铝是由铝元素和氧元素组成的,铝元素的化合价为+3 价,氧元
素的化合价为-2 价,根据化合物中元素的正负化合价代数和为 0 得,铝原子与氧原子的个
3Al O ;元素的化合价是在元素符号的正上方先写正
数比为 2:3,所以氧化铝的化学式为 2
负号,再写数字,所以氧化铝中铝元素显+3 价表示为
12. 铁是应用最广泛的金属。
+3
Al O 。
2
3
�
(1)为了检验铁生锈的条件,进行了如上图(略去其中的夹持装置)所示三个对比实验。
一段时间后,甲中铁丝发生锈蚀且试管中液面上升,乙和丙中均无明显变化。由此得出铁丝
锈蚀的过程,实际上是铁丝与 _________ 、 ________ 发生化学反应的过程。
(2)铁制品在下列情况:①潮湿空气中②部分浸入食盐水中③干燥的空气中 最易生锈的是
_______ 填序号,下同),不易生锈的是 _____________ 。
(3)在“南海一号”打捞出来的文物中,铁器锈迹斑斑,残存很少,而“金龙纹手镯”光
彩夺目,完好无损。这说明铁的金属活动性比金的 ______ (填“强”或“弱”)
(4)为了验证铁、铜的金属活动性顺序,除了选择用砂纸打磨干净的铁钉外,还需要选择
的一种溶液是 _________________ 溶液。
【答案】
①. 氧气
②. 水
③. ②
④. ③
⑤. 强
⑥. CuSO4
【解析】
【详解】(1)铁丝锈蚀的过程,实际上是铁丝与氧气、水发生化学反应的过程。
(2)根据提生锈的条件可知,铁制品在下列情况:①潮湿空气中②部分浸入食盐水中③干
燥的空气中 最易生锈的是②,不易生锈的是③;
(3)在“南海一号”打捞出来的文物中,铁器锈迹斑斑,残存很少,而“金龙纹手镯”光
彩夺目,完好无损。这说明铁的金属活动性比金的强,容易腐蚀;
(4)为了验证铁、铜的金属活动性顺序,除了选择用砂纸打磨干净的铁钉外,还需要选择
的一种溶液是可溶性铜盐溶液,如硫酸铜、氯化铜等溶液。
13. 某工厂从含铜废料中回收铜的生产流程如下。(提示:铜灼烧后的固体可以与稀硫酸反
应生成硫酸铜和水;含铜废料中,除铜外其余物质不与氧气或稀硫酸反应且不溶于水。)
(1)含铜废料灼烧时发生的反应的化学方程式为_______。
(2)反应Ⅱ中,铁与过滤 I 得到滤液发生反应,写出有关的化学方程式:_______。
�
(3)固体物质 Y 的成分是_______。
【答案】(1)
Δ
2Cu+O 2CuO
2
(2)
Fe+H SO FeSO +H
=
4
2
4
2
、
Fe+CuSO FeSO +Cu
=
4
4
(3)Fe、Cu
【解析】
【小问 1 详解】
铜在空气中灼烧,是铜与氧气在加热的条件下反应生成氧化铜,反应的化学方程式为
Δ
2Cu+O 2CuO 。
2
【小问 2 详解】
反应 I 中发生的反应是氧化铜与硫酸反应生成硫酸铜和水,因硫酸是过量的,所以反应 I
反应完全后,溶液中含有硫酸铜和稀硫酸,所以经过过滤 I 得到滤液中含有硫酸铜和稀硫酸,
向滤液中加入过量的铁,铁与硫酸铜反应生成硫酸亚铁和铜,反应的化学方程式为
Fe+CuSO FeSO +Cu
=
4
4
,且铁与稀硫酸反应生成硫酸亚铁和氢气,反应的化学方程式为
Fe+H SO FeSO +H
=
4
2
4
2
。
【小问 3 详解】
反应Ⅱ中发生的反应为
Fe+CuSO FeSO +Cu
=
4
4
、
Fe+H SO FeSO +H
=
4
2
4
2
,所以固体
中含有生成的铜,因铁是过量的,所以固体中也含有铁,即固体物质 Y 的成分是 Fe、Cu。
三、实验与探究题(每空 1 分,方程式 2 分,共 17 分)
14. 请回答下列实验问题:
(1)甲仪器的名称是_______。
(2)实验室用双氧水和二氧化锰制氧气的化学方程式为_______,可用 C 装置收集 O2 的原
因是_______。
(3)实验室制备 CO2 的化学方程式为_______;通常用澄清石灰水检验 CO2 气体,其化学方
程式为_______。
�















 2023年江西萍乡中考道德与法治真题及答案.doc
2023年江西萍乡中考道德与法治真题及答案.doc 2012年重庆南川中考生物真题及答案.doc
2012年重庆南川中考生物真题及答案.doc 2013年江西师范大学地理学综合及文艺理论基础考研真题.doc
2013年江西师范大学地理学综合及文艺理论基础考研真题.doc 2020年四川甘孜小升初语文真题及答案I卷.doc
2020年四川甘孜小升初语文真题及答案I卷.doc 2020年注册岩土工程师专业基础考试真题及答案.doc
2020年注册岩土工程师专业基础考试真题及答案.doc 2023-2024学年福建省厦门市九年级上学期数学月考试题及答案.doc
2023-2024学年福建省厦门市九年级上学期数学月考试题及答案.doc 2021-2022学年辽宁省沈阳市大东区九年级上学期语文期末试题及答案.doc
2021-2022学年辽宁省沈阳市大东区九年级上学期语文期末试题及答案.doc 2022-2023学年北京东城区初三第一学期物理期末试卷及答案.doc
2022-2023学年北京东城区初三第一学期物理期末试卷及答案.doc 2018上半年江西教师资格初中地理学科知识与教学能力真题及答案.doc
2018上半年江西教师资格初中地理学科知识与教学能力真题及答案.doc 2012年河北国家公务员申论考试真题及答案-省级.doc
2012年河北国家公务员申论考试真题及答案-省级.doc 2020-2021学年江苏省扬州市江都区邵樊片九年级上学期数学第一次质量检测试题及答案.doc
2020-2021学年江苏省扬州市江都区邵樊片九年级上学期数学第一次质量检测试题及答案.doc 2022下半年黑龙江教师资格证中学综合素质真题及答案.doc
2022下半年黑龙江教师资格证中学综合素质真题及答案.doc