2020-2021 学年天津市南开区九年级上学期化学期末试题及
答案
可能用到的相对原子质量:H1
C12
N14 O16
Na23
Mg24
A127
Fe 56
Cu65 Zn65
一、选择题:(本大题共 10 小题,每小题 2 分,共 20 分。每小题给出的四个选项中,只有
一个最符合题意。)
1. 下列属于化学变化的是
A. 干冰升华
B. 胆矾研碎
C. 空气液化
D. 铁钉生
锈
【答案】D
【解析】
【分析】化学变化是有新物质生成的变化。
【详解】A、干冰升华是固态变成气体,没有新物质生成,属于物理变化,故 A 不正确;
B、胆矾研碎过程没有新物质生成,属于物理变化,故 B 不正确;
C、空气液化过程没有新物质生成,属于物理变化,故 C 不正确;
D、铁钉生锈生成氧化铁,有新物质生成,属于化学变化,故 D 正确。故选 D。
2. 下列气体与空气混合后遇明火,可能发生爆炸的是(
)
B. 氮气
C. 氧气
D. 二氧化
A. 甲烷
碳
【答案】A
【解析】
【详解】试题分析:甲烷具有可燃性,和氧气遇到明火容易爆炸。故选 A.
考点:燃烧的条件
3. 将少量下列物质分别放到水中,充分搅拌,不能得到溶液的是
B. 氯化钠
C. 面粉
D. 高锰酸
A. 蔗糖
钾
【答案】C
【解析】
【详解】A.蔗糖易溶于水形成了均一、稳定的混合物,属于溶液,故 A 错;
B.氯化钠易溶于水形成了均一、稳定的混合物,属于溶液,故 B 错;
C.面粉与水混合后形成的混合物,不均一、不稳定,一会儿产生沉淀物,属于悬浊液,故
C 正确;
D.高锰酸钾易溶于水形成了均一、稳定的混合物,属于溶液,故 D 错;
故选 C。
�
MnO +H SO +H O =MnSO +O
2
2
4
2
2
4
+2X
2
,则 X 的化学式是
B. H2
C. H2O
D. H2SO3
4. 某反应:
A. SO2
【答案】C
【解析】
【详解】根据质量守恒定律可知,反应前后原子的个数不变。反应前有 1 个锰原子、4 个氢
原子、1 个硫原子、8 个氧原子,反应后有 1 个锰原子、1 个硫原子、6 个氧原子,则剩余 4
个氢原子、2 个氧原子,则 X 由 2 个氢原子、1 个氧原子构成,化学式为 H2O。
故选 C。
5. 下列物质的分类中不正确的是
A. 氧化物:干冰
B. 单质:液氧
C. 碱:碳酸钠
D. 混合
物:合金
【答案】C
【解析】
【详解】A、干冰是二氧化碳固体,是含有碳氧两种元素,其中一种元素为氧元素的化合物,
属于氧化物,正确;
B、液氧是液态氧气,是由一种元素组成的纯净物,属于单质,正确;
C、碳酸钠俗名纯碱,不是碱,是由金属阳离子和酸根阴离子构成的化合物,属于盐,错误;
D、合金是由金属和金属或非金属型熔合而成的具金属特性的混合物,正确;
故选 C。
6. 如图所示的实验操作中,正确的是(
)
A.
加热液体
B.
滴加液体
C.
D.
倾倒液体
取用固体粉末
�
【答案】D
【解析】
【详解】A、给试管中的液体加热时,用酒精灯的外焰加热试管里的液体,且液体体积不能
超过试管容积的三分之一,图中液体超过试管容积的三分之一,故 A 不正确;
B、使用胶头滴管滴加少量液体的操作,注意胶头滴管不能伸入到试管内或接触试管内壁,
应垂直悬空在试管口上方滴加液体,防止污染胶头滴管,故 B 不正确;
C、向试管中倾倒液体药品时,瓶塞要倒放,标签要对准手心,瓶口紧挨;图中瓶口没有紧
挨、瓶塞没有倒放、标签没有向着手心,故 C 不正确;
D、取用粉末状药品,试管横放,用药匙或纸槽把药品送到试管底部,故 D 正确。故选 D。
7. 人体内含量最高的金属元素是
B. 锌
C. 钾
D. 钙
A. 铁
【答案】D
【解析】
【详解】人体内含量最高的金属元素是钙,故选 D。
8. 下列有关实验现象的描述正确的是
A. 硫在空气中燃烧发出明亮的蓝紫色火焰
B. 木炭在氧气中燃烧发出白光,生成黑色固体
C. 铁丝伸入盛有氧气的集气瓶中剧烈燃烧,火星四射
D. 将通入足量二氧化碳后的石蕊溶液加热,溶液由红色变为紫色
【答案】D
【解析】
【详解】A、硫在氧气中燃烧发出明亮的蓝紫色火焰,在空气中燃烧发出淡蓝色火焰,错误;
B、木炭在氧气中燃烧发出白光,没有黑色固体生成,错误;
C、要燃着的铁丝伸入盛有氧气的集气瓶中才能剧烈燃烧,火星四射,错误;
D、将通入足量二氧化碳后的石蕊溶液加热,二氧化碳和水反应生成的碳酸受热分解,故溶
液由红色变为紫色,正确;
故选 D。
9. 下列关于化学反应 2X+Y=2Z 的叙述,不正确的是
A. Z 一定是化合物
B. 若 agX 与 bgY 充分反应,生成 Z 的质量可能为(a+b)g
C. 若 X 和 Y 的相对分子质量分别为 m 和 n,则 Z 的相对分子质量为(m+n)
D. 在反应中 X、Y、Z 三种物质的粒子数目比为 2:1:2
【答案】C
【解析】
�
【详解】A、由反应式可知,X、Y 生成 Z,属于化合反应,故 Z 一定是化合物,正确;
B、agX 与 bgY 充分反应,若两者恰好反应生成 Z的质量为(a+b)g,若两者不恰好反应,生成
Z 的质量小于(a+b)g,正确;
C、由反应式可知,若 X 和 Y 的相对分子质量分别为 m 和 n,则 Z 的相对分子质量为
2m+n
2
,
错误;
D、由反应式可知,在反应中 X、Y、Z 三种物质的粒子数目比为 2:1:2,正确;
故选 C。
10. 由两种元素组成的某合金 6g 与足量的稀硫酸充分反应后,生成 0.2g 氢气。下列说法不
合理的是
A. 合金中的元素可能是 Fe 和 Cu
B. 所得溶液中的溶质可能是硫酸镁、硫酸铝和硫酸
C. 合金中的元素可能是 Zn 和 Fe
D. 所得溶液中的溶质可能是硫酸镁和硫酸
【答案】B
【解析】
【 详 解 】 A 、 铁 和 稀 硫 酸 反 应 生 成 硫 酸 亚 铁 和 氢 气 , 反 应 的 关 系 式 为
H SO FeSO +
=
2
4
4
Fe +
5
6
H
2
2
,则 5.6g 铁和 0.4g 铜的混合物,生成 0.2g 氢气,合金中的
元素可能是 Fe 和 Cu,故 A 正确;
B、铝和稀硫酸反应生成硫酸铝和氢气,反应的关系式为
2Al+3H SO =
54
2
4
Al SO
2
3
+
4
3H
2
6
,生成 0.2g 氢气需要 1.8g 铝,生成 0.2g 氢气需要
2.4g 镁,则所得溶液中的溶质不可能是硫酸镁、硫酸铝和硫酸,故 B 不正确;
C、锌和稀硫酸反应生成硫酸锌和氢气,反应的关系式为
Zn +
6
5
H SO ZnSO +
=
2
4
4
H
2
2
,则
6.5g 锌生成 0.2g 氢气,5.6g 铁生成 0.2g 氢气,合金中的元素可能是 Zn 和 Fe,故 C 正确;
D、镁和稀硫酸反应生成硫酸镁和氢气,反应的关系式为
+
Mg H SO MgSO +
2
=
4
2
4
4
H
2
2
,
2.4g 镁与 3.6g 铜生成 0.2g 氢气,加入的硫酸过量溶质是硫酸镁和硫酸,则所得溶液中的
溶质可能是硫酸镁和硫酸,故 D 正确。故选 B。
二、选择题:(本大题共 5 题,每小题 2 分,共 10 分。每小题给出的四个选项中,有 1~2
个符合题意。)
11. 下列有关说法正确的是
�
A. 通常铝制品很耐腐蚀,是因为铝的化学性质不活泼
B. 钢的性能优良,所以钢是很纯的铁
C. 洗涤剂能洗掉餐具上的油污,因为洗涤剂能溶解油污形成溶液
D. 化学反应伴随着能量变化,燃料燃烧时一定放出热量
【答案】D
【解析】
【详解】A、铝制品耐腐蚀,是因为铝的化学性质活泼,能和氧气反应生成氧化铝保护膜,
该选项说法错误;
B、钢主要成分是铁,还含有碳等物质,该选项说法错误;
C、洗涤剂能洗掉餐具上的油污,因为洗涤剂具有乳化作用,能使植物油分散成无数细小的
液滴,而不聚成大的油珠,故选项说法错误;
D、化学反应伴随着能量变化,燃料燃烧时一定放出热量,故选项说法正确;
故选 D。
12. 为了验证 Fe、Ag、Cu 三种金属的活动性顺序,下列选用的药品可行的是
A. 硫酸亚铁溶液、铜、银
B. 硫酸铜溶液、铁、银
C. 银、铜、铁、盐酸
D. 铜、硫酸亚铁溶液、硝酸银溶液
【答案】BD
【解析】
【详解】A、Cu、Ag 与 FeSO4 溶液均不反应,说明了活动性铁>铜,铁>银,但无法确定银
和铜的活动性强弱,故该方案不合理,错误;
B、Fe 与 CuSO4 溶液反应置换出铜,说明了活动性铁>铜;Ag 与 CuSO4 溶液不反应,说明了
活动性 Cu>Ag;由此可得出三种金属活动性铁>铜>银;故该方案合理,正确;
C、银、铜都不和盐酸反应,铁和盐酸反应产生大量气泡,说明活动性铁>铜,铁>银,但
无法确定银和铜的活动性强弱,故该方案不合理,错误;
D、Cu 与 AgNO3 溶液反应置换出银,说明了活动性铜>银;Cu 与 FeSO4 溶液不反应,说明了
活动性 Fe>Cu;由此可得出三种金属活动性铁>铜>银,故该方案合理,正确;
故选 BD。
13. 下列实验方案正确的是
A. 用水鉴别氯化钠、氢氧化钠和硝酸铵三种固体
B. 用稀盐酸鉴别铁粉、木炭粉末
C. 用蒸发的方法除去氯化钠溶液中混有的少量泥沙
D. 用点燃的方法除去二氧化碳中混有的少量一氧化碳
【答案】AB
【解析】
�
【详解】A、氯化钠溶于水,温度不变;氢氧化钠溶于水,放出大量的热温度升高;硝酸铵
溶于水,温度降低,可以鉴别,正确;
B、稀盐酸和铁生成氢气,有气泡产生;稀盐酸和木炭不反应,可以鉴别,正确;
C、除去氯化钠溶液中混有的少量泥沙,应该使用过滤的方法,错误;
D、用点燃的方法除去二氧化碳中混有的少量一氧化碳需要氧气,会引入新杂质,错误;
故选 AB。
14. 工业用盐中含有的亚硝酸钠(NaNO2)是一种有毒物质,利用氯化铵溶液可使亚硝酸钠转
化为无毒物质。该反应分两步进行:①NaNO2+NH4Cl=NaCl+NH4NO2 ②NH4NO2=N2↑+2H2O。下列叙
述正确的是
A. 反应①为置换反应,反应②为分解反应
B. 利用氯化铵溶液处理亚硝酸钠最终转化为氯化钠、氮气和水
C. 上述反应所涉及的物质中,氮元素的化合价有三种
D. 若转化 69g 亚硝酸钠可产生 14g 氮气
【答案】BC
【解析】
【详解】A、反应①中两者化合物反应生成两种化合物,不符合一种单质与化合物反应生成
另一种单质和化合物的特点,所以不属于置换反应,错误;
B、亚硝酸钠含有钠元素、氮元素和氧元素,钠元素最终生成了氯化钠,氮元素则生成了氮
气,氢元素生成了水,所以亚硝酸钠转化为了氯化钠、氮气和水,正确;
C、亚硝酸钠中氮元素为+3 价,氯化铵中氮元素为-3 价,氮气中氮元素为 0 价,而亚硝酸铵
中氮元素化合价分别为-3 价和+3 价,所以氮元素化合价一共有 3 种化合价,分别为-3、0
和+3 价,正确;
D、根据这两个方程式可知,设 69g 亚硝酸钠可产生氮气的质量为 x,
2~ N
28
x
NaNO
2
69
69g
69
28
69g
x
x=28g
故转化 69g 亚硝酸钠可产生 28g 氮气,错误;
故选 BC。
�
15. 将一定质量的甲醇与 4.4g 氧气混合于密闭容器内,在一定条件下,发生如下反应:
一定条件
8CH3OH+xO2
mCO2+nCO+16H2O,当反应物完全耗尽且全部转化为生成物时,有 3.6g
水生成。下列说法正确的是
A. 2m+n 的和为 8
B. x 的值为 12
C. 反应中生成二氧化碳的质量为 3.3g
D. 若将 1.lg 碳与 4.4g 氧气混合于另
一密闭容器内,充分反应后容器中的气体为二氧化碳
【答案】C
【解析】
【 分 析 】 反 应 前 后 元 素 种 类 质 量 不 变 ; 3.6g 水 中 氢 元 素 质 量 为
3.6g
1 2
1 2+16
100%=0.4g
,故甲醇的质量为
0.4g
1 4
12+1 4+16
100%=3.2g
;参加
反应甲醇和氧气的质量比为 8×(12+1×4+16):32x=3.2g:4.4g;x=11;
【详解】A、化学反应前后原子种类数目不发生改变;反应前后碳原子数目应该都为 8,故
m+n 的和为 8,错误;
B、由分析得:x=11,错误;
C、由碳原子守恒得:m+n=8;由氧原子守恒得 8+11×2=2m+n+16;故 m=6、n=2;根据甲醇和
二氧化碳的质量关系可知二氧化碳质量为
6 44 3.2g=3.3g
8 32
,正确;
点燃
CO
2
C +O
2
12 32
D、
由碳和氧气反应的质量关系可知 1.lg 碳与 4.4g 氧气混合不能恰好反
应,产物不是二氧化碳,错误;
故选 C。
可能用到的相对原子质量:H1 O16
C12
N14 Na23
Mg24 A127
S32
Cl 35.5 Ca 40
Fe 56
Cu 64
Zn 65
Ag 108
三、填空题(本大题共 3 题,共 20 分)
16. 化学与我们的生活有着密切的联系。现有①活性炭 ②二氧化碳 ③金刚石 ④二氧化硫,
选择适当的物质填空(填序号)。
(1)可用来裁玻璃的是_______。
(2)绿色植物进行光合作用吸收的是_______。
(3)能导致酸雨的气体是_______。
(4)可用于冰箱除味剂的是_______。
�
【答案】
①. ③
②. ②
③. ④
④. ①
【解析】
【详解】(1).金刚石硬度最大,可用来裁玻璃的是金刚石;
(2).绿色植物进行光合作用吸收的是二氧化碳;
(3).能导致酸雨的气体是二氧化硫;
(4).活性炭具有吸附性,可用于冰箱除味剂的是活性炭。
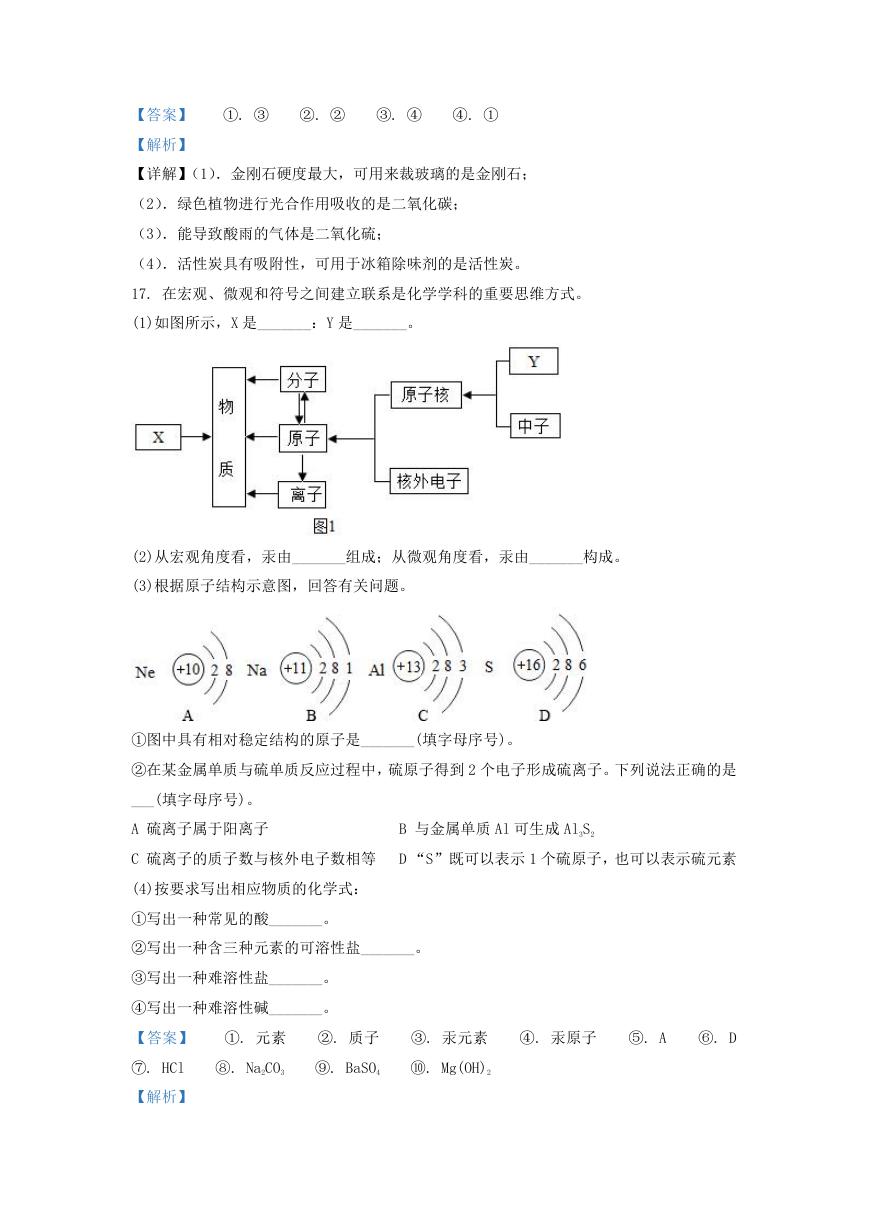
17. 在宏观、微观和符号之间建立联系是化学学科的重要思维方式。
(1)如图所示,X 是_______:Y 是_______。
(2)从宏观角度看,汞由_______组成;从微观角度看,汞由_______构成。
(3)根据原子结构示意图,回答有关问题。
①图中具有相对稳定结构的原子是_______(填字母序号)。
②在某金属单质与硫单质反应过程中,硫原子得到 2 个电子形成硫离子。下列说法正确的是
___(填字母序号)。
A 硫离子属于阳离子
B 与金属单质 Al 可生成 Al3S2
C 硫离子的质子数与核外电子数相等 D “S”既可以表示 1 个硫原子,也可以表示硫元素
(4)按要求写出相应物质的化学式:
①写出一种常见的酸_______。
②写出一种含三种元素的可溶性盐_______。
③写出一种难溶性盐_______。
④写出一种难溶性碱_______。
【答案】
①. 元素
②. 质子
③. 汞元素
④. 汞原子
⑤. A
⑥. D
⑦. HCl
⑧. Na2CO3
⑨. BaSO4
⑩. Mg(OH)2
【解析】
�















 2023年江西萍乡中考道德与法治真题及答案.doc
2023年江西萍乡中考道德与法治真题及答案.doc 2012年重庆南川中考生物真题及答案.doc
2012年重庆南川中考生物真题及答案.doc 2013年江西师范大学地理学综合及文艺理论基础考研真题.doc
2013年江西师范大学地理学综合及文艺理论基础考研真题.doc 2020年四川甘孜小升初语文真题及答案I卷.doc
2020年四川甘孜小升初语文真题及答案I卷.doc 2020年注册岩土工程师专业基础考试真题及答案.doc
2020年注册岩土工程师专业基础考试真题及答案.doc 2023-2024学年福建省厦门市九年级上学期数学月考试题及答案.doc
2023-2024学年福建省厦门市九年级上学期数学月考试题及答案.doc 2021-2022学年辽宁省沈阳市大东区九年级上学期语文期末试题及答案.doc
2021-2022学年辽宁省沈阳市大东区九年级上学期语文期末试题及答案.doc 2022-2023学年北京东城区初三第一学期物理期末试卷及答案.doc
2022-2023学年北京东城区初三第一学期物理期末试卷及答案.doc 2018上半年江西教师资格初中地理学科知识与教学能力真题及答案.doc
2018上半年江西教师资格初中地理学科知识与教学能力真题及答案.doc 2012年河北国家公务员申论考试真题及答案-省级.doc
2012年河北国家公务员申论考试真题及答案-省级.doc 2020-2021学年江苏省扬州市江都区邵樊片九年级上学期数学第一次质量检测试题及答案.doc
2020-2021学年江苏省扬州市江都区邵樊片九年级上学期数学第一次质量检测试题及答案.doc 2022下半年黑龙江教师资格证中学综合素质真题及答案.doc
2022下半年黑龙江教师资格证中学综合素质真题及答案.doc