2021 浙江省绍兴市中考化学真题及答案
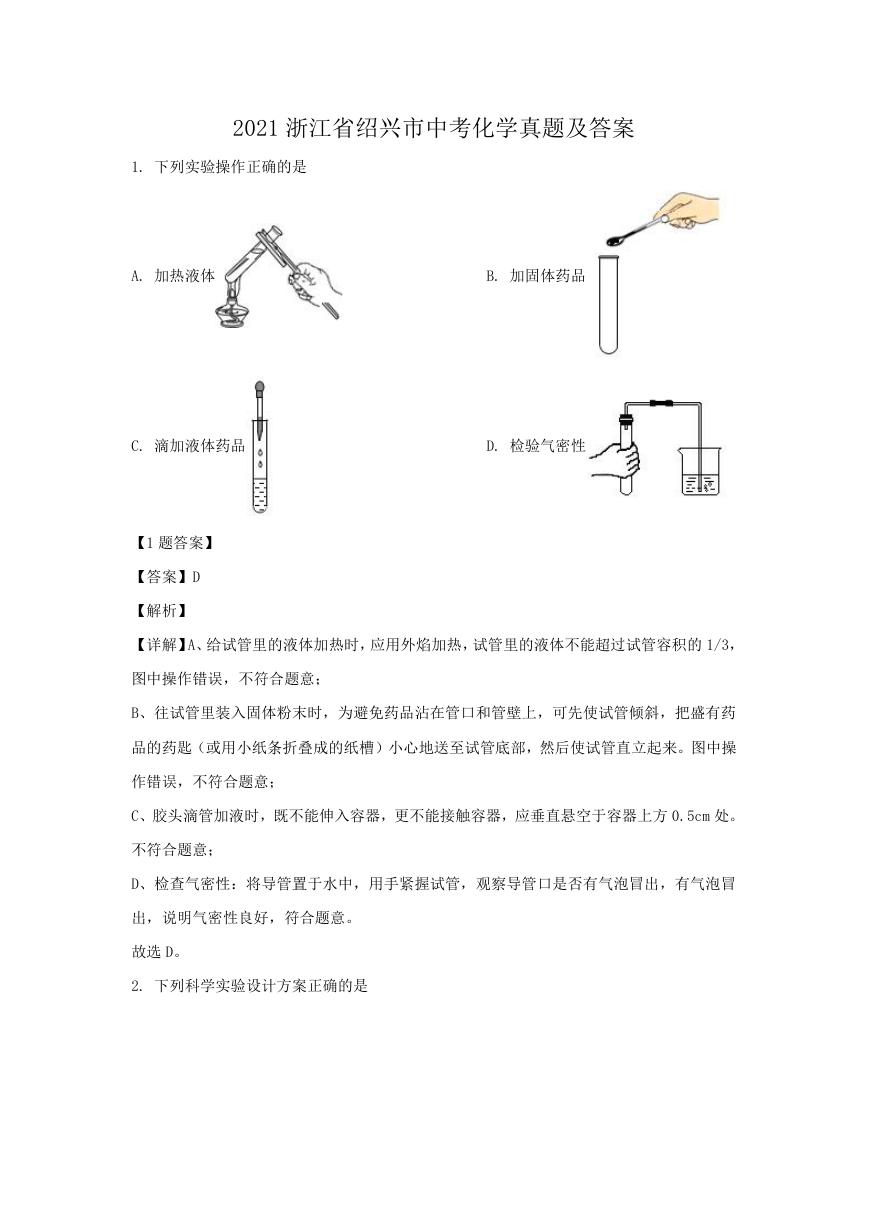
1. 下列实验操作正确的是
A. 加热液体
B. 加固体药品
C. 滴加液体药品
D. 检验气密性
【1 题答案】
【答案】D
【解析】
【详解】A、给试管里的液体加热时,应用外焰加热,试管里的液体不能超过试管容积的 1/3,
图中操作错误,不符合题意;
B、往试管里装入固体粉末时,为避免药品沾在管口和管壁上,可先使试管倾斜,把盛有药
品的药匙(或用小纸条折叠成的纸槽)小心地送至试管底部,然后使试管直立起来。图中操
作错误,不符合题意;
C、胶头滴管加液时,既不能伸入容器,更不能接触容器,应垂直悬空于容器上方 0.5cm 处。
不符合题意;
D、检查气密性:将导管置于水中,用手紧握试管,观察导管口是否有气泡冒出,有气泡冒
出,说明气密性良好,符合题意。
故选 D。
2. 下列科学实验设计方案正确的是
�
A.
①区分铁和硫化亚铁 B.
②
验证铁钉生锈需要氧气
C.
③干燥并收集一瓶氧气 D.
④测定空气中氧气的体积分数
【2 题答案】
【答案】A
【解析】
【详解】A、铁能被磁铁吸引,硫酸亚铁不能被磁铁吸引,可以用磁铁吸引区分,符合题意;
B、左边试管中铁钉与氧气和水接触,生锈,右边试管中铁钉与氧气接触,不生锈,说明铁
生锈需要水,不符合题意;
C、氧气的密度比空气大,用万用瓶收集,应“长进短出”,不符合题意;
D、木炭燃烧生成二氧化碳,化学反应前后,压强的变化不大,无法测定空气中氧气的含量,
不符合题意。
故选 A。
3. 我国发明的新型钛合金,为“奋斗者”号下潜万米海底、从事科考任务解决了材料难题。
工业制取金属钛的主要反应式是:①
2FeTiO +6C+7Cl
3
2
一定条件
2FeCl +2TiCl +6CO
3
4
;②
高温
2Mg+TiCl
4
2MgCl +Ti
2
。下列说法合理的是
A. FeTiO3 属于氧化物
B. 钛合金是一种金属单质
�
C. 反应②属于置换反应
D. TiCl4 中钛元素和氯元素的质量比为 96:71
【3 题答案】
【答案】C
【解析】
【详解】A、FeTiO3 是由 Fe、Ti、O 三种元素组成,不属于氧化物,不符合题意;
B、钛合金是在钛中加入其它物质混合而成,不属于单质,属于混合物,不符合题意;
C、反应②符合“一种单质与一种化合物反应生成另一种单质和另一种化合物”的反应,属
于置换反应,符合题意;
D、TiCl4 中钛元素和氯元素的质量比为:48:(35.5×4)=24:71,不符合题意。
故选 C。
4. 以可靠的实验事实为基础,通过推理得出结论的研究方法称为科学推理法。下列结论通
过这种方法得出的是
A. ①电流产生的热量与电阻大小有关
B. ②可燃物燃烧需要温度达到着火
点
C. ③叶片的下表面一般气孔数目较多
D. ④牛顿第一定律
【4 题答案】
【答案】D
�
【解析】
【详解】A、电流产生的热量与电阻大小有关,运用了控制变量法,不符合题意;
B、可燃物燃烧需要温度达到着火点,运用了对比的方法,不符合题意;
C、叶片的下表面一般气孔数目较多,采用的是对比的方法,不符合题意;
D、牛顿第一定律是以可靠的实验事实为基础,通过推理得出结论的研究方法(事实上不受
摩擦力的物体不存在),符合题意。
故选 D。
5. 向一定质量的 Mg(NO3)2 和 Cu(NO3)2 混合溶液中加入 a 克锌粉和铁粉的混合物,充分
反应后过滤,得到不饱和的滤液和滤渣,将滤渣洗涤、干燥后再称量,得到的固体质量仍为
a 克。下列分析合理的是
①滤渣中可能有铜
②向滤渣中加稀盐酸,可能有气泡产生
③滤液中一定有 Mg(NO3)2、Zn(NO3)2 和 Fe(NO3)2,可能有 Cu(NO3)2
④若忽略过滤操作中溶液损失,滤液中溶质的质量一定大于原混合溶液溶质的质量
A. ①②
B. ①③
C. ②③
D. ②④
【5 题答案】
【答案】C
【解析】
【详解】金属活动性:Mg>Zn>Fe>Cu,向一定质量的硝酸镁和硝酸铜的混合溶液中加入
ag 锌 粉 和 铁 粉 的 混 合 物 , 锌 先 与 硝 酸 铜 反 应 生 成 硝 酸 锌 和 铜 , 即 :
Zn+Cu(NO )
3 2
Zn=
NO +Cu
3 2
,65 份的锌置换出 64 份的铜,固体质量减小,溶液质量
增 加 , 待 硝 酸 铜 完 全 反 应 后 , 铁 与 硝 酸 铜 反 应 生 成 硝 酸 亚 铁 和 铜 , 即
Fe+Cu(NO )
3 2
Fe=
NO +Cu
3 2
,56 份的铁置换出 64 份的铜,固体质量增加,溶液质量
减小,充分反应后过滤,得到不饱和的滤液和滤渣,将滤渣洗涤、干燥后再称量,得到的固
体质量仍为 a 克,故一定发生了铁和硝酸铜的反应。
①一定发生了锌和硝酸铜、铁和硝酸铜的反应,滤渣中一定有铜,错误;
②铁可能过量,向滤渣中加稀盐酸,可能有气泡产生,正确;
③硝酸镁不参与反应,滤液中一定含硝酸镁,锌、铁一定与硝酸铜发生了反应,滤液中一定
含硝酸锌和硝酸亚铁,可能含硝酸铜,正确;
�
④锌与硝酸铜反应,溶液质量增加,铁与硝酸铜反应,溶液质量减小,完全反应后,滤渣的
质量不变,故滤液中溶质的质量等于原混合溶液溶质的质量,错误。
故正确的是②③。
故选 C。
6. 2021 年 3 月,四川三星堆遗址进行了新一轮考古发掘。至今三星堆已出土了黄金面具、
青铜纵目面具等一批珍贵文物,如图。
(1)出土的黄金面具仍金光灿灿,而青铜纵目面具已锈迹斑斑,这说明金的活动性比铜
______(选填
“强”或“弱”)。
(2)古代制作青铜器的铜来源于铜矿,如黄铜矿,黄铜矿的主要成分为二硫化亚铁铜为
(CuFeS2),其中铁元素和铜元素均为十 2 价,则硫元素的化合价为______。
(3)应用碳-14 测出三星堆遗址距今 3000 年左右,碳-12 和碳-14 是碳元素的两种同位素
原子,它们的主要区别是原子核中______数不同。
【6 题答案】
【答案】
①. 弱
②. -2
③. 中子
【解析】
【详解】(1)出土的黄金面具仍金光灿灿,而青铜纵目面具已锈迹斑斑,这说明金的活动性
比铜弱,金很难与其它物质反应;
(2)CuFeS2 中铁元素显+2 价,铜元素显+2 价,设硫元素的化合价为 x,根据化合物中,正、
负化合价的代数和为零,可得:(+2)+(+2)+2x=0,x=-2;
(3)碳-12 和碳-14 是碳元素的两种同位素原子,它们的质子数相同,主要区别是原子核中
中子数不同。
7. 物质的溶解度不同,用途也不同。请据表回答:
表一
物质的溶解度(20℃)
�
物质
NaOH
Ca(OH)2
CaCO3
CaSO3
溶解度(克)
109
0.165
0.0014
0.0043
表二
物质在水中的溶解性等级
20℃时的溶解度(克)
>10
1-10
0.01-1
<0.01
等级
易溶
可溶
微溶
难溶
(1)实验中一般用氢氧化钠溶液吸收二氧化碳,而不用澄清石灰水来吸收二氧化碳主要原
因是氢氧化钙______于水,吸收效果不好。
(2)实验中一般用澄清石灰水检验二氧化碳,但是根据上表可知能使澄清石灰水变浑浊的
不一定是二氧化碳,也可能是二氧化硫,请用化学方程式说明______。
(3)20℃时,饱和氢氧化钠溶液的溶质质量分数为______。(精确到 0.1%)
【7 题答案】
【答案】
①. 微溶
②.
【解析】
SO +Ca OH =CaSO +H O
3
2
2
2
③. 52.2%
【详解】(1)实验中一般用氢氧化钠溶液吸收二氧化碳,而不用澄清石灰水来吸收二氧化碳
主要原因是氢氧化钙微溶于水,浓度低,吸收二氧化碳的量有限;
(2)二氧化硫能与氢氧化钙反应生成亚硫酸钙和水,生成沉淀,该反应的化学方程式为:
SO +Ca(OH) =CaSO +H O
;
2
3
2
2
(3)20℃时,氢氧化钠的溶解度为 109g,饱和氢氧化钠溶液的溶质质量分数为:
109g
109g 100g
100% 52.2%
。
8. 酸碱理论的发展如下:
①17 世纪前,人们对酸碱的认识模糊,只凭感觉器官的感受来判定。
②17 世纪木,朴素的酸感理论:凡物质的水溶液能溶解某些金属,跟碱接触会失去原有特
性,且能使石蕊试液变红的物质叫酸;凡物质的水溶液有苦溜味,跟酸接触后会失去原有特
性,且使石蕊试液变蓝的物质叫碱。
③19 世纪末,酸碱电离理论:电离时所生成的阳离子全部是 H+的化合物叫酸,电离时所生
成的阴离子全部是 OH-的化合物叫碱。
�
④20 世纪初,酸碱质子理论:任何能给出质子的物质(分子、原子或离子)都是酸,任何
能接受质子的物质(分子、原子或离子)都是碱,且酸碱有如下关系:酸→H++碱,两者彼
此联系在一起叫做共轭酸碱对。酸失去一个质子后形成的物质叫做该酸的共轭碱,碱结合一
个质子后形成的物质叫做该碱的共轭酸。
(1)根据朴素的酸碱理论,Na2CO3 属于______(选填“酸”或“碱”)。
(2)根据酸碱电离理论理解酸碱反应的实质是:______。
(3)已知
H CO
2
3
碱是______。
HCO +H
-
3
+
和
HCO
3
CO +H
2
3
+
,由酸碱质子理论,H2CO3 的共轭
(4)随着认知水平的不断提高,人们对酸碱理论的描述也在不断完善。下列对不同酸碱理
论的分析合理的是______。
A.酸碱电离理论认为酸碱是两种不同的物质
B.酸碱电离理论认为氧元素是酸中必不可少的元素
C.酸碱质子理论认为酸和碱可以是分子,也可以是离子
D.酸碱质子理论扩大了酸和碱的范围,不再具有局限性
【8 题答案】
【答案】
①. 碱
②. 酸电离出的氢离子和碱电离出的氢氧根离子结合成水的过程
(或 +
H +OH =H O )
-
2
③.
3HCO
④. AC
【解析】
【详解】(1)凡物质的水溶液有苦溜味,跟酸接触后会失去原有特性,且使石蕊变蓝的物质
叫碱。碳酸钠能与酸反应,失去原有特性,且碳酸钠能使紫色石蕊试液变蓝,故根据朴素的
酸碱理论,Na2CO3 属于碱;
(2)酸碱电离理论:电离时所生成的阳离子全部是 H+的化合物叫酸,电离时所生成的阴离
子全部是 OH-的化合物叫碱。故酸碱反应的实质是:酸电离出的氢离子和碱电离出的氢氧根
离子结合成水的过程;
(3)酸失去一个质子后形成的物质叫做该酸的共轭碱,故碳酸的共轭碱是:
3HCO ;
(4)A、酸碱电离理论:电离时所生成的阳离子全部是 H+的化合物叫酸,电离时所生成的阴
离子全部是 OH-的化合物叫碱,故酸碱电离理论认为酸碱是两种不同的物质,符合题意;
B、酸碱电离理论认为氢元素是酸中必不可少的元素,不符合题意;
C、酸碱质子理论:任何能给出质子的物质(分子、原子或离子)都是酸,故酸碱质子理论
�
认为酸和碱可以是分子,也可以是离子,符合题意;
D、酸碱质子理论扩大了酸和碱的范围,但是具有局限性,不符合题意。
故选 AC。
9. 按我国政府要求 2021 年 1 月 1 日起餐饮行业已禁用不可降解的一次性塑料吸管,取而代
之的是一些可降解的环保吸管。环保纸吸管的主要成分是纤维素,化学式为(C6H10O5)n,而
原来塑料吸管的主要成分是聚丙烯,化学式为(C3H6)n。
(1)纤维素是一种______(选填“有机物”或“无机物”)。
(2)纤维素分子中,氢、氧原子的个数比为______。
(3)计算 32.4 克纤维素中所含碳元素质量与多少克聚丙烯中所含碳元素质量相同?
【9 题答案】
【答案】(1)有机物
(2)2:1
(3)32.4 克纤维素中所含碳元素质量:
32.4g
72n
72n+10n+16×5n
100%=14.4g
含碳元素质量相同的聚丙烯为:
14.4g
36n
36n 6n
100% =16.8g
【解析】
【详解】(1)纤维素含碳元素,属于有机物;
(2)纤维素分子中,氢、氧原子的个数比为:10n:5n=2:1;
(3)见答案。
10. 取敞口放置的氢氧化钠溶液于烧杯中,倒入一定量的稀硫酸充分反应。为探究反应后所
得溶液 X 的成分,兴趣小组进行了如下实验(所加试剂均足量):
(1)过滤中玻璃棒的作用是______。
(2)产生的无色气体是______。
(3)溶液 X 的溶质是______。
�














 2023年江西萍乡中考道德与法治真题及答案.doc
2023年江西萍乡中考道德与法治真题及答案.doc 2012年重庆南川中考生物真题及答案.doc
2012年重庆南川中考生物真题及答案.doc 2013年江西师范大学地理学综合及文艺理论基础考研真题.doc
2013年江西师范大学地理学综合及文艺理论基础考研真题.doc 2020年四川甘孜小升初语文真题及答案I卷.doc
2020年四川甘孜小升初语文真题及答案I卷.doc 2020年注册岩土工程师专业基础考试真题及答案.doc
2020年注册岩土工程师专业基础考试真题及答案.doc 2023-2024学年福建省厦门市九年级上学期数学月考试题及答案.doc
2023-2024学年福建省厦门市九年级上学期数学月考试题及答案.doc 2021-2022学年辽宁省沈阳市大东区九年级上学期语文期末试题及答案.doc
2021-2022学年辽宁省沈阳市大东区九年级上学期语文期末试题及答案.doc 2022-2023学年北京东城区初三第一学期物理期末试卷及答案.doc
2022-2023学年北京东城区初三第一学期物理期末试卷及答案.doc 2018上半年江西教师资格初中地理学科知识与教学能力真题及答案.doc
2018上半年江西教师资格初中地理学科知识与教学能力真题及答案.doc 2012年河北国家公务员申论考试真题及答案-省级.doc
2012年河北国家公务员申论考试真题及答案-省级.doc 2020-2021学年江苏省扬州市江都区邵樊片九年级上学期数学第一次质量检测试题及答案.doc
2020-2021学年江苏省扬州市江都区邵樊片九年级上学期数学第一次质量检测试题及答案.doc 2022下半年黑龙江教师资格证中学综合素质真题及答案.doc
2022下半年黑龙江教师资格证中学综合素质真题及答案.doc