绝密★考试结束前
2015 浙江高考理科综合试题及答案
可能用到的相对原子质量:
7.下列说法不正确...的是
A.液晶态介于晶体状态和液态之间,液晶具有一定程度的晶体的有序性和液体的流动性
B.常压下,0℃时冰的密度比水的密度小,水在 4℃时密度最大,这些都与分子间的氢键有关
C.石油裂解、煤的干馏、玉米制醇、蛋白质的变性和纳米银粒子的聚集都是化学变化
D.燃料的脱硫脱氮、SO2 的回收利用和 NOx 的催化转化都是减少酸雨产生的措施
8.下列说法正确的是
A.为测定新制氯水的 pH,用玻璃棒蘸取液体滴在 pH 试纸上,与标准比色卡对照即可
B.做蒸馏实验时,在蒸馏烧瓶中应加入沸石,以防暴沸。如果在沸腾前发现忘记加沸石,应立即停止
加热,冷却后补加
C.在未知溶液中滴加 BaCl2 溶液出现白色沉淀,加稀硝酸,沉淀不溶解,说明该未知溶液中存在 SO 2ˉ4
或 SO2ˉ3
D.提纯混有少量硝酸钾的氯化钠,应采用在较高温度下制得浓溶液再冷却结晶、过滤、干燥的方法
9.右下表为元素周期表的一部分,其中 X、Y、Z、W 为短周期元素,W 元素的核电荷数为 X 元素的 2 倍。下
列说法正确的是
A.X、W、Z 元素的原子半径及它们的气态氢化物的热稳定性均依次递
B.Y、Z、W 元素在自然界中均不能以游离态存在,它们的最高价氧化
酸性依次递增
Y
X
Z W
T
增
物 的 水 化 物 的
第 9 题表
C.YX2 晶体熔化、液态 WX3 气化均需克服分子间作用力
D.根据元素周期律,可以推测 T 元素的单质具有半导体特性,T2X3 具有氧化性和还原性
10.下列说法不正确...的是
A.己烷有 4 种同分异构体,它们的熔点、沸点各不相同
B.在一定条件下,苯与液溴、硝酸、硫酸作用生成溴苯、硝基苯、苯磺酸的反应都属于取代反应
C.油脂皂化反应得到高级脂肪酸盐与甘油
D.聚合物(—[ CH2—CH2—CH—
CH2—]n)可由单体 CH3CH=CH2 和 CH2=CH2 加聚制得
|
CH3
�
11.在固态金属氧化物电解池中,高温共电解 H2O-CO2
H2 和 CO 是一种新的能源利用方式,基本原理如图
法不正确...的是
A.X 是电源的负极
B.阴极的反应式是:H2O+2eˉ=H2+O2ˉ
CO2+2eˉ=CO+O2ˉ
C.总反应可表示为:H2O+CO2H2+CO+O2
D.阴、阳两极生成的气体的物质的量之比是 1
12.40℃时,在氨-水体系中不断通入 CO2,各种离子
下图所示。下列说法不正确...的是
混合气体制备
所示。下列说
︰1
的变化趋势如
A.在 pH=9.0 时,c(NH+
B.不同 pH 的溶液中存在关系:
4)>c(HCOˉ3 )>c(NH2COOˉ)>c(CO2ˉ3 )
c(NH+
4)+c(H+)=2c(CO2ˉ3 )+c(HCOˉ3 )+c(NH2COOˉ)+c(OHˉ)
C.随着 CO2 的通入,
c(OHˉ)
c(NH3·H2O)
不断增大
D.在溶液中 pH 不断降低的过程中,有含 NH2COOˉ的中间产物生成
13.某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为 Fe2O3、SiO2、Al2O3,不考虑其他杂质) 制取七水合硫
酸亚铁(FeSO4·7H2O) ,设计了如下流程:
足量酸
烧渣
固体 1
溶液 1
试剂 X
NaOH 溶液
控制 pH
固体 2
溶液 2
FeSO4·7H2O
下列说法不正确...的是
A.溶解烧渣选用足量硫酸,试剂 X 选用铁粉
B.固体 1 中一定含有 SiO2,控制 pH 是为了使 Al3+转化为 Al(OH)3,进入固体 2
C.从溶液 2 得到 FeSO4·7H2O 产品的过程中,须控制条件防止其氧化和分解
D.若改变方案,在溶液 1 中直接加 NaOH 至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离也可得
到 FeSO4·7H2O
�
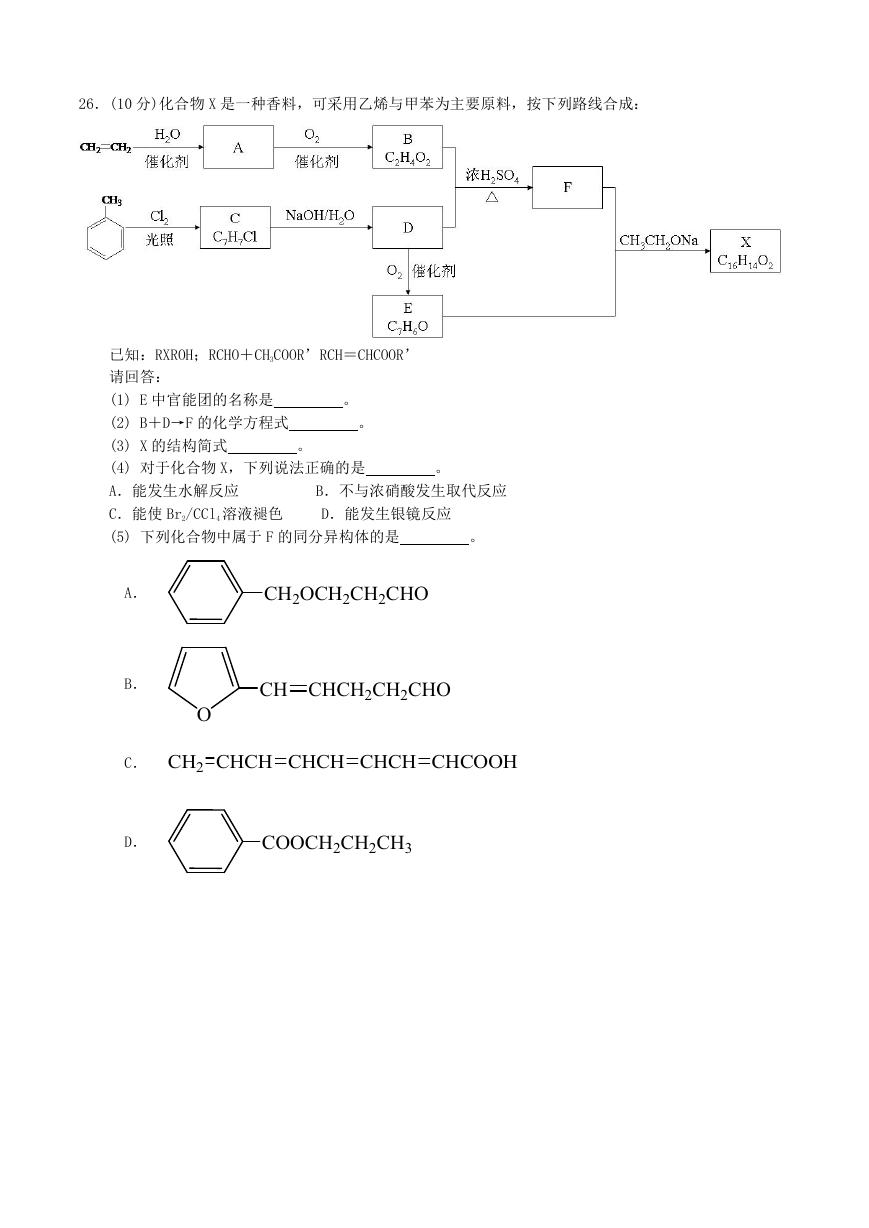
26.(10 分)化合物 X 是一种香料,可采用乙烯与甲苯为主要原料,按下列路线合成:
。
已知:RXROH;RCHO+CH3COOR’RCH=CHCOOR’
请回答:
(1) E 中官能团的名称是
(2) B+D→F 的化学方程式
(3) X 的结构简式
(4) 对于化合物 X,下列说法正确的是
A.能发生水解反应
C.能使 Br2/CCl4 溶液褪色
(5) 下列化合物中属于 F 的同分异构体的是
。
。
B.不与浓硝酸发生取代反应
D.能发生银镜反应
。
。
A.
B.
CH2OCH2CH2CHO
CH CHCH2CH2CHO
O
C. CH2 CHCH CHCH CHCH CHCOOH
D.
COOCH2CH2CH3
�
27.Ⅰ.(6 分) 请回答:
(1) H2O2 的电子式___________。
(2) 煤燃烧不能用 CO2 灭火,用化学方程式表示其理由________________。
(3) 在 AgCl 沉淀中加入 KBr 溶液,白色沉淀转化为淡黄色沉淀,写出反应的离子方程式_____________。
(4) 完成以下氧化还原反应的离子方程式:
(
)MnOˉ4 +(
)C2O2ˉ4 +______=(
)Mn2++(
)CO2↑+________
Ⅱ.(12 分) 化合物甲和 NaAlH4 都是重要的还原剂。一定条件下金属钠和 H2 反应生成甲。甲与水反应
可产生 H2,甲与 AlCl3 反应可得到 NaAlH4。将 4.80g 甲加热至完全分解,得到金属钠和 2.24 L(已折算
成标准状况) 的 H2。
请推测并回答:
(1) 甲的化学式__________。
(2) 甲与 AlCl3 反应得到 NaAlH4 的化学方程式__________。
(3) NaAlH4 与水发生氧化还原反应的化学方程式__________。
(4) 甲在无水条件下可作为某些钢铁制品的脱锈剂(铁锈的成分表示为 Fe2O3) 脱锈过程发生的化学方
程式___________。
(5) 某同学认为:用惰性气体赶尽反应体系中的空气,将铁和盐酸反应后的气体经浓硫酸干燥,再与
金属钠反应,得到固体物质即为纯净的甲;取该固体物质与水反应,若能产生 H2,即可证明得到
的甲一定是纯净的。
判断该同学设想的制备和验纯方法的合理性并说明理由___________。
�
28.(15 分)乙苯催化脱氢制苯乙烯反应:
(1)已知:
化学键
C-H
C-C
键能/kJ·molˉ1
348
计算上述反应的△H=________ kJ·mol-1。
412
C=C
612
H-H
436
(2)维持体系总压强 p 恒定,在温度 T 时,物质的量为 n、体积为 V 的乙苯蒸汽发生催化脱氢反应。
已知乙苯的平衡转化率为α,则在该温度下反应的平衡常数 K=____________(用α等符号表示)。
(3)工业上,通常在乙苯蒸汽中掺混水蒸气(原料气中乙苯和水蒸气的物质的量之比为 1︰9),控制
反应温度 600℃,并保持体系总压为常压的条件下进行反应。在不同反应温度下,乙苯的平衡转化
率和某催化剂作用下苯乙烯的选择性(指除了 H2 以外的产物中苯乙烯的物质的量分数)示意图如
下:
①掺入水蒸气能提高乙苯的平衡转化率,解释说明该事实___________。
②控制反应温度为 600℃的理由是____________。
(3)某研究机构用 CO2代替水蒸气开发了绿色化学合成工艺----乙苯-二氧化碳耦合催化脱氢制苯乙烯。
保持常压和原料气比例不变,与掺水蒸汽工艺相比,在相同的生产效率下,可降低操作温度;该
工艺中还能够发生反应:CO2+H2=CO+H2O,CO2+C=2CO。新工艺的特点有_________(填编号)。
①CO2 与 H2 反应,使乙苯脱氢反应的化学平衡右移
②不用高温水蒸气,可降低能量消耗
③有利于减少积炭
④有利用 CO2 资源利用
�
29.(15 分)某学习小组按如下实验流程探究海带中碘含量的测定和碘的制取。
实验(一) 碘含量的测定
取 0.0100 mol·Lˉ1 的 AgNO3 标准溶液装入滴定管,取 100.00 mL 海带浸取原液至滴定池,用电势滴定
法测定碘含量。测的的电动势(E) 反映溶液中 c(Iˉ)的变化,部分数据如下表:
V(AgNO3)/mL
15.0
19.0
19.8
19.9
20.0
20.0
21.0
23.0
25.0
0
0
0
8
0
2
0
0
0
E/mV
-225
-200
-150
-100
50.0
175
275
300
325
实验(二) 碘的制取
另制海带浸取原液,甲、乙两种实验方案如下:
已知:3I2+6NaOH=5NaI+NaIO3+3H2O
请回答:
(1) 实验(一) 中的仪器名称:仪器 A
(2) ①根据表中数据绘制滴定曲线:
, 仪器 B
。
② 该 次 滴 定 终 点 时 用 去 AgNO3 溶 液 的 体 积 为
mL , 计 算 得 海 带 中 碘 的 百 分 含 量
为
%。
(3) ①分液漏斗使用前须检漏,检漏方法为
②步骤 X 中,萃取后分液漏斗内观察到的现象是
③下列有关步骤 Y 的说法,正确的是
。
。
。
�
A.应控制 NaOH 溶液的浓度和体积
B.将碘转化呈离子进入水层
C.主要是除去海带浸取原液中的有机杂质
D.NaOH 溶液可以由乙醇代替
④实验(二) 中操作 Z 的名称是
(4) 方案甲中采用蒸馏不合理,理由是
。
。
�













 2023年江西萍乡中考道德与法治真题及答案.doc
2023年江西萍乡中考道德与法治真题及答案.doc 2012年重庆南川中考生物真题及答案.doc
2012年重庆南川中考生物真题及答案.doc 2013年江西师范大学地理学综合及文艺理论基础考研真题.doc
2013年江西师范大学地理学综合及文艺理论基础考研真题.doc 2020年四川甘孜小升初语文真题及答案I卷.doc
2020年四川甘孜小升初语文真题及答案I卷.doc 2020年注册岩土工程师专业基础考试真题及答案.doc
2020年注册岩土工程师专业基础考试真题及答案.doc 2023-2024学年福建省厦门市九年级上学期数学月考试题及答案.doc
2023-2024学年福建省厦门市九年级上学期数学月考试题及答案.doc 2021-2022学年辽宁省沈阳市大东区九年级上学期语文期末试题及答案.doc
2021-2022学年辽宁省沈阳市大东区九年级上学期语文期末试题及答案.doc 2022-2023学年北京东城区初三第一学期物理期末试卷及答案.doc
2022-2023学年北京东城区初三第一学期物理期末试卷及答案.doc 2018上半年江西教师资格初中地理学科知识与教学能力真题及答案.doc
2018上半年江西教师资格初中地理学科知识与教学能力真题及答案.doc 2012年河北国家公务员申论考试真题及答案-省级.doc
2012年河北国家公务员申论考试真题及答案-省级.doc 2020-2021学年江苏省扬州市江都区邵樊片九年级上学期数学第一次质量检测试题及答案.doc
2020-2021学年江苏省扬州市江都区邵樊片九年级上学期数学第一次质量检测试题及答案.doc 2022下半年黑龙江教师资格证中学综合素质真题及答案.doc
2022下半年黑龙江教师资格证中学综合素质真题及答案.doc