药学-药事管理(药品注册管理)试题及答案
1. 新药的技术转让要求,接受新药技术转让的生产企业必须取得()
2. 负责对药物临床研究、药品生产审批的是()
3. GLP规定该规范适用于()
4. 药品注册境内申请人应当是中国境内的()
5. 对获得生产或销售含有新型化学药品许可的生产者、销售者提交的自行取得的未披露数据,SFDA给予(
6. 临床研究用药物,应当()
7. 创新药(NCEs)批准生产后其药品标准试行期为()
8. 专利法规定可以授予专利权的是()
9. 药品不良反应主要是指合格药品()
10. 药品不良反应监测专业机构的人员组成包括()
11. 新药上市后监测是()
12. 随机盲法对照临床试验是()
13. 申请新药证书是在完成哪期临床试验之后()
14. 治疗作用初步评价阶段是()
15. 临床研究被批准后应当在几年内实施()
16. 《进口药品注册证》的有效期为()
17. 新药批准文号的有效期为()
18. 进口药品分包装期限一般不超过()
19. 已在国外上市尚未在国内上市的原料药()
20. 已在国外上市尚未在国内上市的复方制剂()
21. 国内外均未上市的新复方制剂()
22. 国内外均未上市的已知药物中光学异构体及制剂()
23. 药物临床前研究中的安全性评价研究必须执行()
24. 药物临床研究必须执行()
25. 《药物非临床研究质量管理规范》缩写是()
26. 新化学药品名称包括()(多选题)
27. SFDA对下列新药可以实行加快审批的()(多选题)
28. 药品不良反应监测的范围是()(多选题)
29. 授予发明专利权的药品应当具备()(多选题)
30. 药品注册申请包括()(多选题)
药学-药事管理(药品注册管理)答案解析
1. 新药的技术转让要求,接受新药技术转让的生产企业必须取得()-答案:【D】
2. 负责对药物临床研究、药品生产审批的是()-答案:【A】
3. GLP规定该规范适用于()-答案:【B】
4. 药品注册境内申请人应当是中国境内的()-答案:【A】
5. 对获得生产或销售含有新型化学药品许可的生产者、销售者提交的自行取得的未披露数据,SFDA给予(
6. 临床研究用药物,应当()-答案:【B】
7. 创新药(NCEs)批准生产后其药品标准试行期为()-答案:【B】
8. 专利法规定可以授予专利权的是()-答案:【C】
9. 药品不良反应主要是指合格药品()-答案:【D】
10. 药品不良反应监测专业机构的人员组成包括()-答案:【C】
11. 新药上市后监测是()-答案:【D】
12. 随机盲法对照临床试验是()-答案:【B】
13. 申请新药证书是在完成哪期临床试验之后()-答案:【C】
14. 治疗作用初步评价阶段是()-答案:【B】
15. 临床研究被批准后应当在几年内实施()-答案:【B】
16. 《进口药品注册证》的有效期为()-答案:【C】
17. 新药批准文号的有效期为()-答案:【C】
18. 进口药品分包装期限一般不超过()-答案:【C】
19. 已在国外上市尚未在国内上市的原料药()-答案:【C】
20. 已在国外上市尚未在国内上市的复方制剂()-答案:【C】
21. 国内外均未上市的新复方制剂()-答案:【A】
22. 国内外均未上市的已知药物中光学异构体及制剂()-答案:【A】
23. 药物临床前研究中的安全性评价研究必须执行()-答案:【A】
24. 药物临床研究必须执行()-答案:【B】
25. 《药物非临床研究质量管理规范》缩写是()-答案:【A】
26. 新化学药品名称包括()-答案:【ACDE】
27. SFDA对下列新药可以实行加快审批的()-答案:【ABCD】
28. 药品不良反应监测的范围是()-答案:【ABD】
29. 授予发明专利权的药品应当具备()-答案:【CDE】
30. 药品注册申请包括()-答案:【ABCD】
















 V2版本原理图(Capacitive-Fingerprint-Reader-Schematic_V2).pdf
V2版本原理图(Capacitive-Fingerprint-Reader-Schematic_V2).pdf 摄像头工作原理.doc
摄像头工作原理.doc VL53L0X简要说明(En.FLVL53L00216).pdf
VL53L0X简要说明(En.FLVL53L00216).pdf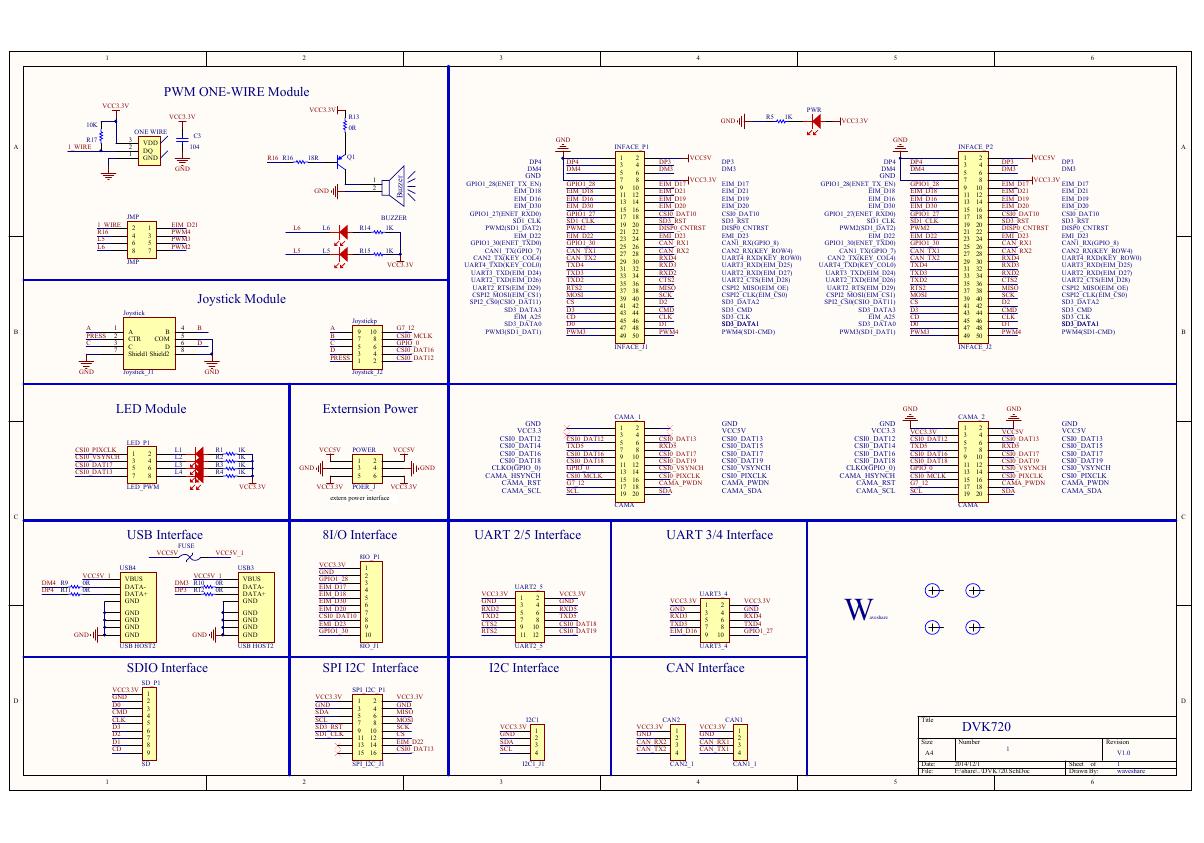 原理图(DVK720-Schematic).pdf
原理图(DVK720-Schematic).pdf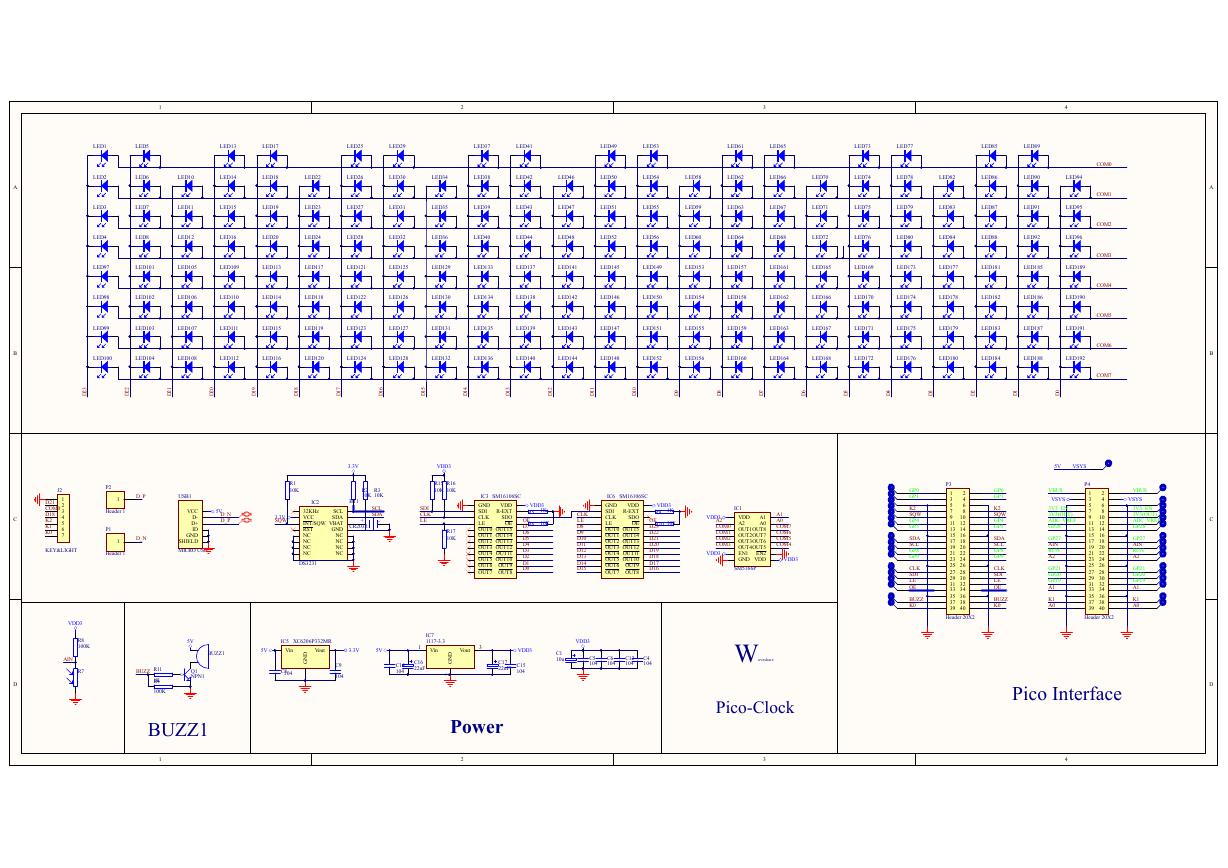 原理图(Pico-Clock-Green-Schdoc).pdf
原理图(Pico-Clock-Green-Schdoc).pdf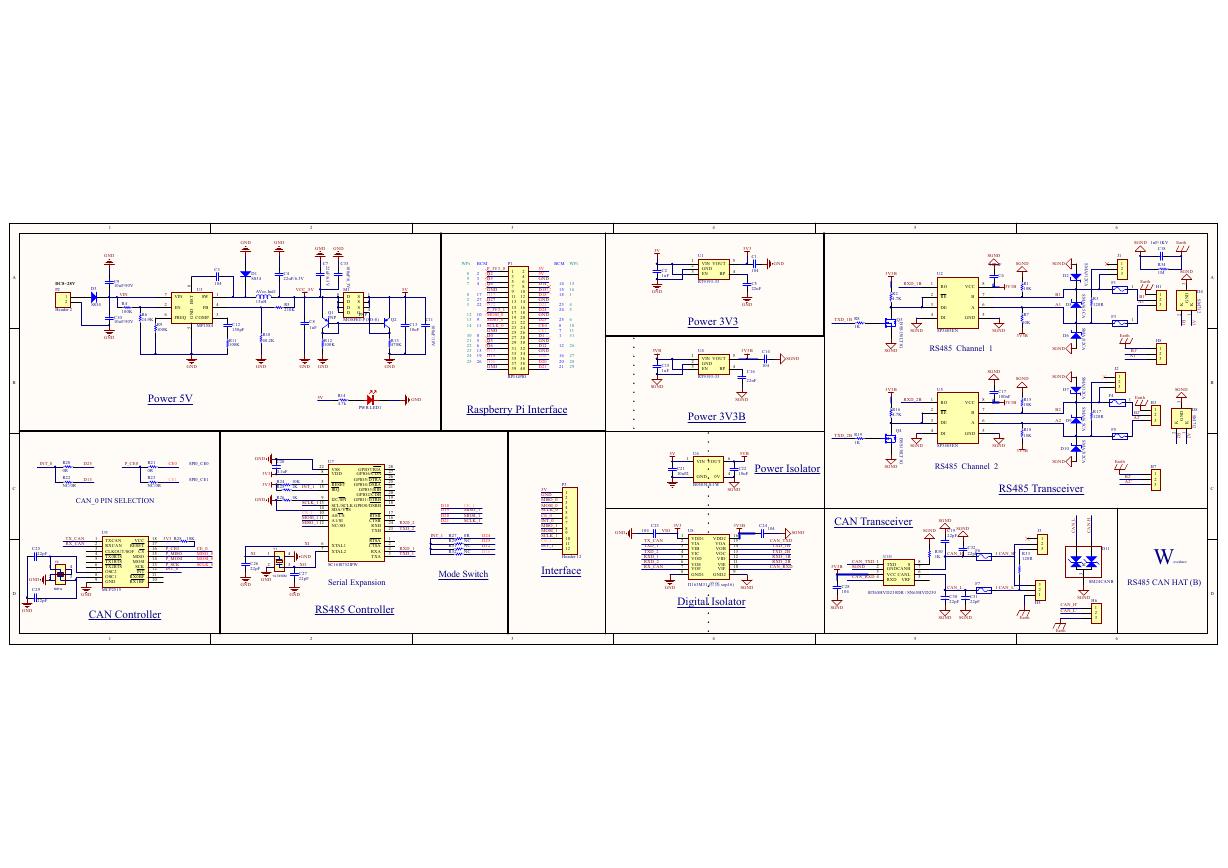 原理图(RS485-CAN-HAT-B-schematic).pdf
原理图(RS485-CAN-HAT-B-schematic).pdf File:SIM7500_SIM7600_SIM7800 Series_SSL_Application Note_V2.00.pdf
File:SIM7500_SIM7600_SIM7800 Series_SSL_Application Note_V2.00.pdf ADS1263(Ads1262).pdf
ADS1263(Ads1262).pdf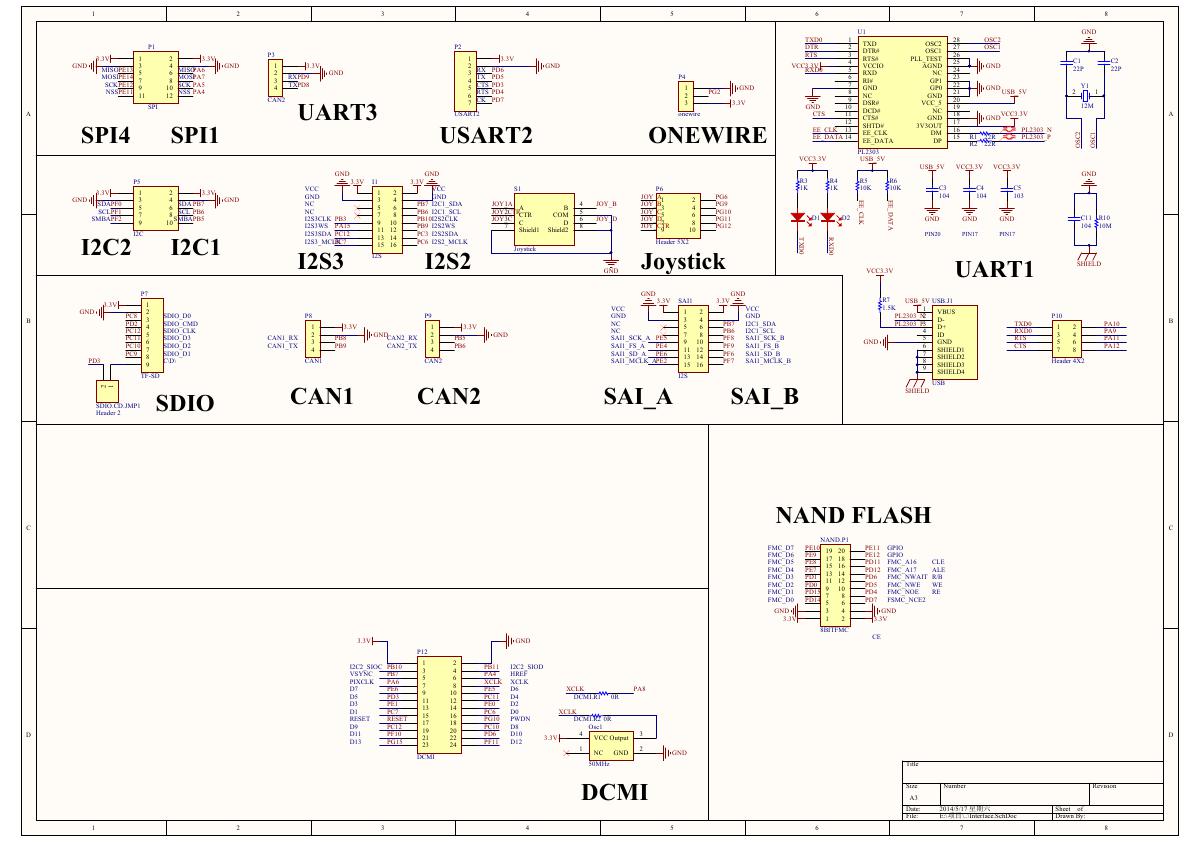 原理图(Open429Z-D-Schematic).pdf
原理图(Open429Z-D-Schematic).pdf 用户手册(Capacitive_Fingerprint_Reader_User_Manual_CN).pdf
用户手册(Capacitive_Fingerprint_Reader_User_Manual_CN).pdf CY7C68013A(英文版)(CY7C68013A).pdf
CY7C68013A(英文版)(CY7C68013A).pdf TechnicalReference_Dem.pdf
TechnicalReference_Dem.pdf