2006 年广东高考化学真题及答案
可能用到的原子量:H 1
C 12
N 14
O 16
Na 23
Mg 24
Al 27 Si 28
S 32
Cl 35.5
Ca 40
Co 59
Ag 108
第一部分 选择题(共 67 分)
一、选择题(本题包括 9 小题,每小题 3 分,共 27 分。每小题只有一个选项符合题意)
1、闪电时空气中的臭氧生成,下列说法正确的是
A、O3和O2互为同位素
B、O2比O3稳定
C、等体积O3和O2含有相同的原子数
D、O3与O2的相互转变是物理变化
2、同主族两种元素原子核外电子数差值可能为
A、6
B、12
C、26
D、30
3、下列表述正确的是
①人造刚玉溶点很高,可用作高级耐火材料,主要成分是二氧化硅
②化学家采用玛瑙研钵摩擦固体反应物进行无溶剂合成,玛瑙的主要成分是硅酸盐
③提前建成的三峡大坝使用了大量水泥,水泥是硅酸盐材料
④夏天到了,游客佩戴由涂加氧化亚铜的二氧化硅玻璃制作的变化眼科来保护眼睛
⑤太阳能电池可采用硅材料制作,其应用有利于环保、节能
A ①②③
B ②④
C ③④⑤
D ③⑤
4、某金属化物在光照下可生成具有很强氧化能力的物质,能用来消除空气水体中的污染物,
下列有关该金属氧化物应用叙述不正确的是
A、将形成酸雨的SO2氧化为SO3
B、将家居装修挥发出的甲醛化为CO2和H2O
C、将医药废水中的苯酚氧化成H2O和CO2
D、将电镀废水中的氰根离子CN-氧化成CO2和N2
5、利用合成气(H2+CO)生产汽油、甲醇和氨等已经实现了工业化,合成气也可转化成醛、
酸、酯等多种产物:下列表述正确的是
①以合成气为原料的反应都是化合反应
②改变合成气中CO与H2的体积比,可以得到不同产物
③合成气的转化反应需在适当的温度和压强下通过催化完成
�
④从合成气出发生产液态烃或醇类有机物是实现“煤变油”的有效途径
⑤以合成气为原料的反应产物中不可能有稀烃或水
A ①②④
B ②③④
C ②④⑤
D ③④⑤
6、等量镁铝合金粉末分别与下列4种过量的溶液充分反应,放出氢气最多的是
A、2mol·L-1H2SO4溶液
B、18mol·L-1H2SO4溶液
C、6mol·L-1KOH溶液
D、3mol·L-1HNO3溶液
7、下列实验能达到预期目的的是
①用乙醇和浓硫酸除去乙酸乙酯中的少量乙酸
②将Cl2的制备和性质实验联合进行以减少实验中的空气污染
③用食醋和澄清石灰水验证蛋壳中含有碳酸盐
④用硝酸钡溶液鉴别硫酸根离子与亚硫酸根离子
⑤用溴水检验汽油中是否含有不饱和脂肪烃
A ①②③
B ①③④
C ②③⑤
D ②④⑤
8、下列叙述正确的是
A、酶具有很强的催化作用,胃蛋白酶只能催化蛋白质的水解,348K时活性更强
B、医疗上的血液透析利用胶体的性质,而上壤保肥与胶体的性质无关
C、银制品久置干燥空气中因电化学腐蚀使表面变暗,
D、C60是由60个碳原子构成的形似足球的分子,结构对称,稳定性好
9、研究发现,烯烃在合适催化剂作用下可双键断裂、两端基因重新组合为新的烯径。若CH2
=C(CH3)CH2CH3与CH2=CHCH2CH3的混合物发生该类反应,则新生成的烯烃中共平面的碳原子数
可能为
A、2,3,4
B、3,4,5
C、4,5,6
D、 5,6,7
二、选择题(本题包括10小题,每小题4分,共40分,每小题有一个或两个选项符合题意。
若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且
正确的得2分,选两个且都正确的得4分,但只要选错一个,该小题就为0分)
10、下列物质性质的变化规律,与共价键的键能大小有关的是
A、F2、Cl2、Br2、I2 的溶点、沸点逐渐升高 B、HF、HCl、HBr、HI 的热稳定性依次减弱
C、金刚石的硬度、熔点、沸点都高于晶体硅 D、NaF、NaCl、NaBr、NaI 的溶点依次降低
11、下列离子方程式正确的是
A、Cl2 与 NaOH 溶液反应:Cl2+2OH-=Cl-+ClO-+H2O
B、F2 与 NaOH 溶液反应:F2+4OH-=2F-+O2+2H2O
C、AgNO3 溶液中加入过量氨水:Ag++2NH3·H2O=Ag(NH3)2
++2H2O
�
D、Fe3O4 与稀 HNO3 反应:Fe3O4+8H+=Fe2++2Fe3++4H2O
12、下列条件下,两瓶气体所含原子数一定相等的是
A、同质量、不同密度的 N2 和 CO
C、同体积、同密度的 C2H4 和 C3H0
B、同温度、同体积的 H2 和 N2
D、同压强、同体积的 N2O 和 CO2
13、下列反应中,氧化剂与还原剂物质的量关系为 1︰2 的是
A、O3+2KI+H2O2=KOH+I2+O2 B、2CH3COOH+Cu(ClO)2=2HClO+Ca(CH3COO)2
C、 I2+2NaClO3=2NaIO3+Cl2 D、4HCl+MnO2=MnCl2+Cl2↑+2H2O
14、室温时,将 xmL pH=a 的稀 NaOH 溶液与 ymL pH=b 的稀盐酸充分反应。下列对于反应
溶液 pH 的判断,正确的是
A 若 x=y,且 a+b=14,则 pH>7
C 若 ax=by,且 a+b=13,则 pH=7
B 若 10x=y,且 a+b=13,则 pH=7
D 若 x=10y,且 a+b=14,则 pH>7
15、下表中,对陈述Ⅰ、Ⅱ的正确性及两者间是否具有因果关系的判断都正确的是
陈述Ⅰ
选
项
陈述Ⅱ
判断
A 工业生产硫酸用水吸收 SO3
B
Ⅰ对,Ⅱ对;有
Cl2 和 SO2 混合后可用于漂白纸浆 Cl2 和 SO2 都有较好的漂白作用 Ⅰ对,Ⅱ错;无
高压钠灯发出透雾性强的黄光 Ⅰ对,Ⅱ对;无
C 金属钠具有强还原性
SO3 可与水反应
D 石墨常用作电解池的电极
石墨的化学性质稳定且导电性 Ⅰ对,Ⅱ对;有
16、某可充电的锂离子电池以 LiMn2O4 为正极,嵌入锂的碳材料为负极,含 Li+导电固体为
电解质。放电时的电池反应为:Li+LiMn2O4=Li2Mn2O4。下列说法正确的是
A 放电时,LiMn2O4 发生氧化反应
B 放电时,正极反应为:Li++LiMn2O4+e-=Li2Mn2O4
C 充电时,LiMn2O4 发生氧化反应
D 充电时,阳极反应为:Li++e-=Li
17、SO4
2-和 S2O8
2-结构中,硫原子均位于氧原子组成的四面体的中心,且所有原子的最外层
电均满足 8 电子结构,下列说法正确的是
A
SO4
2-的电子式为
B
S2O8
2-中没有非极性键
C
S2O8
2-比 SO4
2-稳定
D
S2O8
2-有强氧化性
18、下列实验中,深液颜色有明显变化的是
A 少量明矾溶液加入过量 NaOH 溶液中
B 往 FeCl3 溶液中滴入 KI 溶液,再滴入淀粉溶液
C 少量 Na2O2 固体加入到过量 NaHSO3 溶液中
D 往酸性高锰酸钾溶液中滴入少量 Fe2(SO4)3 稀溶液
19、合成氨工业对国民经济和社会发展具有重要的意义对于密闭容器中的反应:
�
N2(g)+3H2(g)
2NH3(g)673K、30MPa 下 n(NH3)和 n(H2)随时间变化的关系如右图所示,
下列叙述正确的是
A 点 a 的下反应速率比点 b 的大
B 点 c 处反应达到平衡
C 点 d(t1 时刻)和点 e(t2 时刻)处 n(N2)不一样
D 其他条件不变,773K 下反应至 t1 时刻,n(H2)比上图中 d 点的值大
第二部分 非选择题(共 83 分)
三、(本题包括 2 小题,共 24 分)
20、氧化铜有多种用途,如作玻璃着色剂,油类脱硫剂等,为获得纯净的氧化铜以探究其性
质,某同学用工业硫酸铜(含硫酸亚铁等杂质)进行如下实验:
(1)制备氧化铜
工业 CuSO4
CuSO4 溶液
CuSO4·5H2O
……
CuO
①步骤Ⅰ的目的是除不溶性杂质。操作是
。
②步骤Ⅱ的目的是除铁。操作是:滴加 H2O2 溶液,稍加热:Fe2+转化完全后,慢慢加入
Cu2(OH)2CO3 粉末,搅拌,以控制溶液 pH=3.5;加热煮沸一段时间,过滤,用稀硫酸酸化滤
液 至 pH = 1 。 控 制 溶 夜 pH = 3.5 的 原 因
是
。
③ 步 骤 Ⅲ 的 目 的 是 得 到 CuSO4 · 5H2O , 操 作
是
特点是
(2)探究氧化铜性质
。
,过滤,水浴加热烘干。水浴加热的
①取 A、B 两支试管,往 A 中先加入适量 CuO 粉末,再分别向 A 和 B 中加入等体积的 3% H2O2
溶液,只观察到 A 中有大量气泡,结论是
。
�
② 为 探 究 试 管 A 中 反 应 的 速 率 , 收 集 气 体 并 测 定 其 体 积 必 需 的 实 验 仪 器
有
。
21、某研究小组进行与 NH3 有关的系列实验。
(1)从上图中挑选所需的仪器,画出制取干燥 NH3 的装置简图(添加必须的塞子、玻璃导
管、胶皮管;固定装置和尾气处理装置不用画),并标明所用试剂。
( 2 ) 将 NH3 通 入 溴 水 中 , 有 N2 生 成 , 反 应 的 化 学 方 程 式
为
。
(3)为验证:“同温同压下,相同体积的任何气体都含有相同的数目的分子”。该小组同
学设计了如右图所示的装置,图中 B 管的容积是 A 管的 2 倍。活塞 K1、K2、K3、K4、K5 均关
闭(固定装置和尾气处理装置略:HCl 和 NH3 均不溶于石蜡油,也不与之反应;装置气密性
好)
①在 A 管中充满与大气压强相等的干燥 HCl 气体。操作是
。
控制活塞 K4、K5,调节 C,使 B 管充满与 A 管同压的干燥 NH3。
②缓慢开启活塞 K3,A 管中的现象是
。
要达到实验目的,当反应完成并恢复到室温时,B 管中预期的现象是
;若观察
不到预期现象,主要原因是
。
四、(本题包括 2 小题,共 21 分)
22、往有机聚合物中添加阻燃剂,可增加聚合物的使用安全性,扩大其使用范围。例如,在
�
某聚乙烯树脂中加入等质量由特殊工艺制备的阻燃型 Mg(OH)2,树脂可燃性大大降低,该
Mg(OH)2 的生产工艺如下:
。
。
→合成→水热处理→过滤→水洗→表面处理→过滤水洗→干燥
石灰乳
精制卤
水
(1)精制卤水中的 MgCl2 与适量石灰乳反应合成碱式氯化镁[Mg(OH)2-nCln·mH2O],反应的
化学方程式为
(2)合成反应后,继续在 393K~523K 下水热处理 8h,发生发应:
Mg(OH)2-nCln·mH2O=(1-x/2)Mg(OH)2+x/2MgCl2+mH2O
水热处理后,过滤、水洗。水洗的目的是
(3)阻燃型 Mg(OH)2 具有晶粒大,易分散、与高分子材料相容性好等特点。上述工艺流程
中与此有关的步骤是
。
(4)已知热化学方程式:
Mg(OH)2(s)=MgO(s)+H2O(g);ΔH1=+81.5kJ/mol
Al(OH)3(s)=1/2Al2O3(s)+3/2H2O(g);ΔH2=+87.7kJ/mol
①Mg(OH)2 和 Al(OH)3 起阻燃作用的主要原因是
②等质量 Mg(OH)2 和 Al(OH)3 相比,阻燃效果最好的是
是
(5)常用阻燃剂主要有三类:A.卤系,如四溴乙烷;B.磷系,如磷酸三苯酯;C.无机类,
主要是 Mg(OH)2 和 Al(OH)3。从环保的角度考虑,应用时较理想的阻燃剂是______(填代号),
理由是
23、水体中重金属铅的污染方向问题备受关注。水溶液中铅的存在形态主要有 Pb2+、Pb(OH)
+、Pb(OH)2、Pb(OH)-、Pb(OH)4
2-,各形态的浓度分数α随溶液 pH 变化的关系如图所示:
,原因
。
。
。
(1)Pb(NO3)2 溶液中,c(NO3
-)/c(Pb2+)
2(填“>”、“=”、“<”=;往该溶液中滴入氯化铵溶液后,c(NO3
-)/c(Pb2
+)增加,可能的原因是
(2)往 Pb(NO3)2 溶液中滴入稀 NaOH 溶液,pH=8 时溶液中存在的阳离子(Na+除外)
有
为
(3)某课题组制备了一种新型脱铅剂,能有效去除水中的痕量铅,实验结果如下表:
,pH=9 时主要反应的离子方程式
。
。
离子
处理前浓度/(mol·L-1)
处理前浓度/(mol·L-1)
Pb2+
0.100
Cu2+
29.80
0.004
22.6
Fe3+
0.120
0.040
Mn2+
0.087
Cl-
51.9
0.053
49.8
�
上 表 中 除 Pb2 + 外 , 该 脱 铅 剂 对 其 它 离 子 的 去 除 效 果 最 好 的
是
。
(4)如果该脱铅剂(用 EH)脱铅过程中主要发生的反应为:
2EH(s)+Pb2+
E2Pb(s)+2H+,则脱铅的最合适 pH 范围为
(填代号)。
A
4~5
B
6~7
C
9~10
D
11~12
五、(本题包括 2 小题,共 18 分)
24、环丙烷可作为全身麻醉剂,环己烷是重要的有机溶剂。下面是部分环烷烃及烷烃衍生物
的结构简式、键线式和某些有机化合物的反应式(其中 Pt、Ni 是催化剂)
结构简式
键线式
(环己烷)
(环丁烷)
Br-CH2-CH2-CH(CH3)-CH2-Br
是同分异构体。
回答下列问题:
(1)环烷烃与
(2)从反应①~③可以看出,最容易发生开环加成反应的环烷烃是
判断依据为
(3)环烷烃还可与卤素单质、卤化氢发生类似的开环加成反应,如环丁烷与 HBr 在一定条
件下反应,其化学方程式
为
(4)写出鉴别环丙烷与丙烯的一种方法,试剂
论
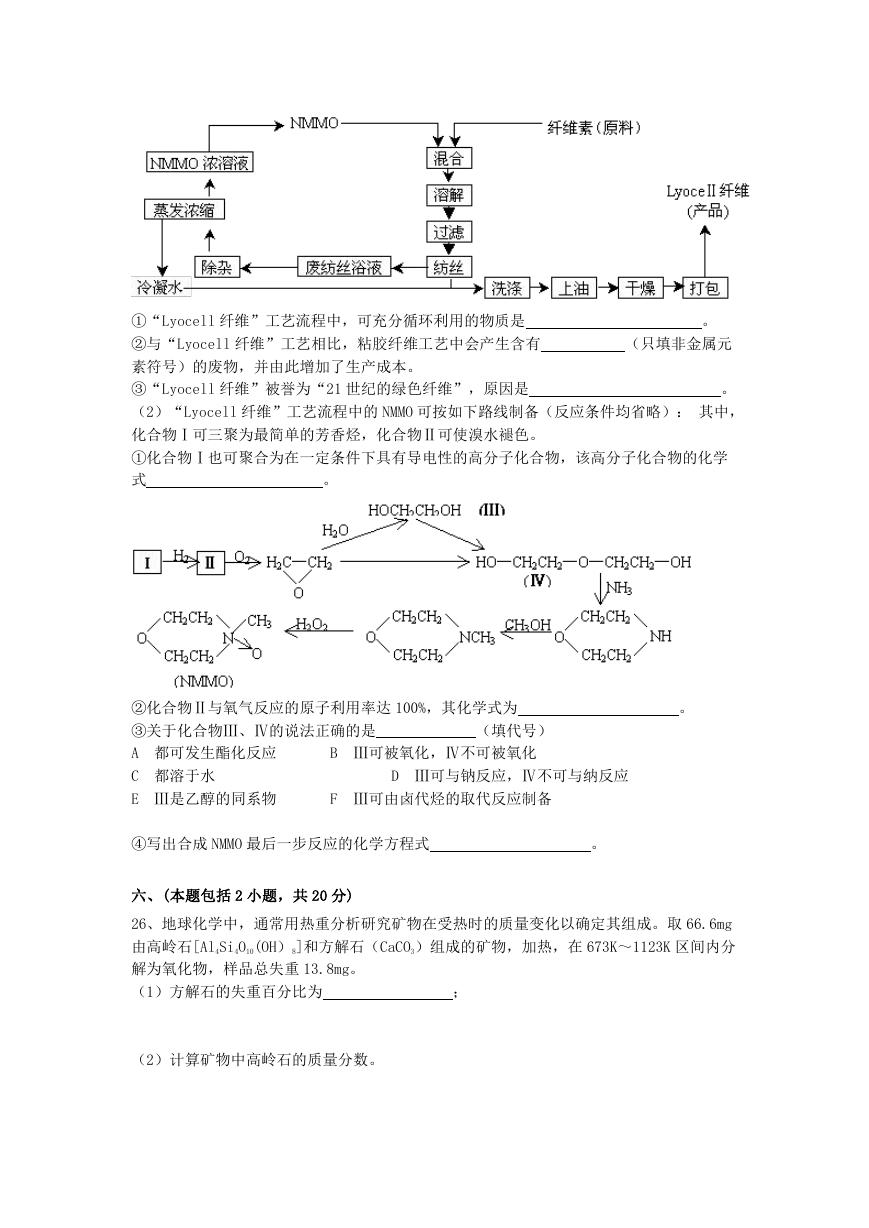
25、纤维素是自然界最为丰富的可再生的天然高分子资源。
(1)纤维素可制备用于纺织、造纸等的粘胶纤维[成分是(C6H10O5)n],生产过程涉及多个化
学反应。工艺简图如下:
(不需注明反应条件)
(填名称),
。
。
;现象与结
近来,化学家开发了一种使用 NMMO 加工纤维素的新方法,产品“Lyocell 纤维”成分也是
(C6H10O5)n。工艺流程示意图如下:
�
①“Lyocell 纤维”工艺流程中,可充分循环利用的物质是
②与“Lyocell 纤维”工艺相比,粘胶纤维工艺中会产生含有
素符号)的废物,并由此增加了生产成本。
③“Lyocell 纤维”被誉为“21 世纪的绿色纤维”,原因是
(2)“Lyocell 纤维”工艺流程中的 NMMO 可按如下路线制备(反应条件均省略): 其中,
化合物Ⅰ可三聚为最简单的芳香烃,化合物Ⅱ可使溴水褪色。
①化合物Ⅰ也可聚合为在一定条件下具有导电性的高分子化合物,该高分子化合物的化学
式
(只填非金属元
。
。
。
②化合物Ⅱ与氧气反应的原子利用率达 100%,其化学式为
③关于化合物Ⅲ、Ⅳ的说法正确的是
A 都可发生酯化反应
C 都溶于水
E Ⅲ是乙醇的同系物
B Ⅲ可被氧化,Ⅳ不可被氧化
F Ⅲ可由卤代烃的取代反应制备
(填代号)
D Ⅲ可与钠反应,Ⅳ不可与纳反应
。
④写出合成 NMMO 最后一步反应的化学方程式
。
六、(本题包括 2 小题,共 20 分)
26、地球化学中,通常用热重分析研究矿物在受热时的质量变化以确定其组成。取 66.6mg
由高岭石[Al4Si4O10(OH)8]和方解石(CaCO3)组成的矿物,加热,在 673K~1123K 区间内分
解为氧化物,样品总失重 13.8mg。
(1)方解石的失重百分比为
;
(2)计算矿物中高岭石的质量分数。
�















 2023年江西萍乡中考道德与法治真题及答案.doc
2023年江西萍乡中考道德与法治真题及答案.doc 2012年重庆南川中考生物真题及答案.doc
2012年重庆南川中考生物真题及答案.doc 2013年江西师范大学地理学综合及文艺理论基础考研真题.doc
2013年江西师范大学地理学综合及文艺理论基础考研真题.doc 2020年四川甘孜小升初语文真题及答案I卷.doc
2020年四川甘孜小升初语文真题及答案I卷.doc 2020年注册岩土工程师专业基础考试真题及答案.doc
2020年注册岩土工程师专业基础考试真题及答案.doc 2023-2024学年福建省厦门市九年级上学期数学月考试题及答案.doc
2023-2024学年福建省厦门市九年级上学期数学月考试题及答案.doc 2021-2022学年辽宁省沈阳市大东区九年级上学期语文期末试题及答案.doc
2021-2022学年辽宁省沈阳市大东区九年级上学期语文期末试题及答案.doc 2022-2023学年北京东城区初三第一学期物理期末试卷及答案.doc
2022-2023学年北京东城区初三第一学期物理期末试卷及答案.doc 2018上半年江西教师资格初中地理学科知识与教学能力真题及答案.doc
2018上半年江西教师资格初中地理学科知识与教学能力真题及答案.doc 2012年河北国家公务员申论考试真题及答案-省级.doc
2012年河北国家公务员申论考试真题及答案-省级.doc 2020-2021学年江苏省扬州市江都区邵樊片九年级上学期数学第一次质量检测试题及答案.doc
2020-2021学年江苏省扬州市江都区邵樊片九年级上学期数学第一次质量检测试题及答案.doc 2022下半年黑龙江教师资格证中学综合素质真题及答案.doc
2022下半年黑龙江教师资格证中学综合素质真题及答案.doc