2017 江苏扬州中考化学真题及答案
可能用到的相对原子质量:H 1
C 12
O 16
Mg 24
S 32
Cl 35.5
选择题
单项选择题:本题包括 15 小题,每题 2 分,共计 30 分。每小题只有一个选项符合题意
1.2017 年 5 月,扬州市启动“公众看环保“活动。下列做法不合理的是
A.乱排废水
B.垃圾分类
C.节约用电
D.增加植被
2.下列过程仅包含物理变化的是
A.光合作用计
B.干冰升华
C.煤的燃烧
D.金属锈蚀
3.下列物质由离子构成的是
A.Al
B.H2O
C.CO2
D.NaCl
4.下列物质属于盐的是
A.Fe
B.CuO
C.Na2CO3
D.H2SO4
5.下列物质溶于水,能使溶液温度降低的是
A.硝酸铵
B.氧化钙
C.氢氧化钠
D.浓硫酸
6.下列为“中国节能”标志的是
7.下列属于置换反应的是
A.2H2O=======2H2↑+O2↑
通电
点燃
C.S+O2======SO2
8.“高钙牛奶”中的“钙”应理解为
A.单质 B.原子 C.分子 D.元素
9.下列物质可用作氮肥的是
加热
B.H2+CuO====Cu+H2O
D.NaOH+HCl=====NaCl+H2O
A.K2SO4
B.Ca3(PO4)2
C.NH4HCO3
D.NaCl
10.下列物质是碱性的是
A.血液 pH 为 7.35~7.45
B.胃液 pH 为 0.8~1.5
C.牛奶 pH 为 6.3~6.6
D.苹果汁 pH 为 2.9~3.3
11.瘦西湖工人将赤霉素(C19H22O6)注入柳树,以减少柳絮。下列关于赤霉素的说法正确的
是
A.C、H 原子个数为 12:1
B.相对分子质量为 47g
C.氢元素的质量分数最小
D.赤霉素中含 47 种元素
12.下列说法正确的是
A.粉笔灰分散到水中形成溶液
B.自来水是纯净物
C.长期饮用硬水有益于人体健康
D.水是宝贵的资源
13.下列鉴别方法可行的是
�
A.用燃着的木条鉴别 CO2 和 N2
B.用水鉴别 NaOH 固体和 CaCO3 固体
C.用酚酞试液鉴别稀盐酸和氯化钠溶液
D.用 Na2CO3 溶液鉴别稀盐酸和稀硫酸
14.下列实验现象的描述正确的是
A.灼燃棉纱线,有烧焦的羽毛味
B.铜片投 入稀盐酸,产生大量气泡
C.铁丝在纯氧中燃烧,生成白色固体
D.加热“铜绿”,固体变黑
15.某反应前后现象的描述正确的是
A.反应物与生
成物共有 3 种物质
B.反应后原子个数增多
C.该图可示意 CO 与 O2 反应
D.反应物中元素的化合价都为 0
不定项选择题:本题包括 5 小题,每小题 2 分,共计 10 分。每小题只有一 个或两个选项符
合题意。若正确答案只有一个选项,多选时,该小题得 0 分;若正确答案包括两个选项,
只选一个且正确的得 1 分,选两个且正确的得满分,但只要选错一个,该小题就得0 分。
16.下列操作正确的是
17.物质甲与乙的溶解度曲线如右图所示。下列说法一定正确 的是
A.常温下,乙易溶于水
B.甲溶液中溶质的质量分数比乙的大
C.从 t2℃降至 t1℃,甲溶液中有晶体析出
D.甲的溶解度受温度的影响程度比乙的大
18.除去下列物质中的少量杂质,所选试剂和操 作都正确的是
序号
物质
A
B
C
D
NaCl 溶液
MnO2
CaCO3
CO2
杂质
CuCl2
KCl
CaO
HCl
试剂
NaOH 溶液
水
稀盐酸
NaOH 溶液
操作
洗气
过滤
过滤
洗气
19.某实验过程如下:取 ag 锡粉置于密闭容器中,称得容器和固体的总质量为 bg,煅烧使
锡粉与 O2 充分反应;冷却 后打开容器时发现有空气冲入,待容器内气体组成恢复到反应前,
称得容器和固体的总质量为 cg;取出所有固体,称得固体为 dg ,则 c 等于
A.d+b+a
B.d-b-a
C.d-b+a
D.d+b-a
20.分解水制氢的一种原理如图。下列关于该原理的说法正确的是
�
A.反应过程中化合价改变的元素有 H、S、O、I
B.涉及的反应类型有分解反应和化合反应
C.理论上,每 生成 16gO2,就能得到 2gH2
D.理论上,每分解 18gH2O,就需向体系内再补充 32gSO2
21.(12 分)化学用语是学习化学的重要工具。
⑴写出下列微粒的化学符号
非选择题
① 钠原子________________________②三氧化二氮分子______________
③5 个氢氧根离子__________________④ 锌离子______________________
⑵用下列字母序号真空:
a. 明矾 b。碘水 c。氮气 d。碳酸氢钠
①_________用于净水
②___________用于检验淀粉
③_________用于治疗胃酸过多
④__________用于粮食保护气
⑶写出下列反应的化学方程式
① 磷与氧气反应___________________②硫酸铜溶液与氢氧化钙溶液反应______________
② 碳酸钙分解_______________________④铜与硝酸银溶液反应_____________________
22.(8 分)化学与生活密切相关。
⑴每 100 克巧克力中营养成分的含量如下表
蛋白质/g 脂肪/g 糖类/g
矿物质/mg
维生素
维生素
总能量
B/mg
C/mg
/千焦
5
32
51
50
4
120
0.2
—
2142
① 表中 2142 千焦能量全部来自糖类吗?________(填“是”或“不是”)。葡萄糖(C6H12O6)
完全烧焦后得到黑色物质,说明葡萄糖含_________(填元素符号)。
② 摄入________元素不足,会导致骨骼疏松,易得佝偻病,铁、磷元素中属于人体必需微
量元素的是___________________。
③ 补充维生素 C,选择___________为宜(填序号)
a.猪肉
b.青菜
c.纯净水
⑵2017 年,扬州电缆助力我国货运飞船“天舟一号”顺利升空,
① 电缆内一般是铜芯,外面包有聚乙烯绝缘层。
铜属于_____________,聚乙烯属于_________。(填序号)
a.金属材料 b.合成材料 c.复合材料
②纯铜制作铜芯电缆,只要是因为___________。(填序号)
a.密度大否
b.色彩鲜艳
c.导电能力强
�
23.(8 分)能源和环境一直受到人们关注
⑴太阳能和天然气中属于可再生能源的是_________,属于不可再生能源的是______。天然
气的主要成分是 CH4,CH4 中 H 的质量分数为___________,CH4 燃烧主要是将化学能转化为
_________能。
⑵造成大气中 CO2 含量增加的主要原因是_____________。(填序号)
a.动植物的呼吸作用
b.实验室逸出 CO2
c.化石燃料的大量燃烧
⑶汽车尾气中的 CO 和 NO,在催化剂作用下能转化为 CO2 和 N2。该反应中 CO 和 NO 的分子个
数比为___________。
⑷下列可用来改良酸性土壤的是_________________ 。(填序号)
a.熟石灰
b.氯化钠
c.稀硫酸
⑸下列做法会导致“白色污染”的是______。(填序号)
a.丢弃废旧电池
b.随意丢弃废旧塑料
c.使用含铅汽油
24.(11 分)为测定钢铁中的含碳量,设计如下装置。钢铁样品在装置 A 中煅烧时,气体产
物只有 CO 和 SO2。
⑴钢样品处理成粉末的主要目的是_________。钢样品中的 Fe3C 煅烧时的化学方程式为
Fe3C+3O2=====_________+CO2。
⑵实验室用 KClO3 和 MnO2 制备 O2 的化学方程式为___________________,MnO2 中 Mn 的化合
价为____________。
⑶装置 B 的作用是_______________,装置 B 中的现象是_________________________。
⑷装置 C 的作用是_______________,若无装置 C,则测定结果_______(填“偏大”“无影响”
或“偏小”)
⑸装置 D 的作用是_______________,装置 E 的作用是__________________。
⑹钢样中加入某物质可降低煅烧温度,为不影响测定结果,该物质在组成上需满足的条件是
______________________________。
25.(9 分)某工厂以含有 FeSO4 和少量 H2SO4 的废水为原料制备 FeSO4·7H2O 的步骤如下:
①调节废水 pH;②过滤;③蒸发浓缩;④结晶池中结晶;⑤收集晶体,洗涤、干燥。
⑴调节废水 pH 时,适宜加入_______(填序号)
a.Fe
b.Cu
c.Ca(OH)2
⑵实验室中,完成过滤操作需要的玻璃仪器有玻璃棒、
________和_______,过滤和蒸发操作中玻璃棒的作用分别
是__________、____________ .
⑶结晶池底部有一定坡度的主要目的是_____________。
⑷用冰水洗涤 FeSO4·7H2O 晶体的目的是__________。
低温干燥的目的是______________________。
�
⑸结合右图,补充完整由硫酸亚铁溶液中结晶出 FeSO4·4H2O 的实验方案:蒸发浓缩,
________,过滤、洗涤、干燥。
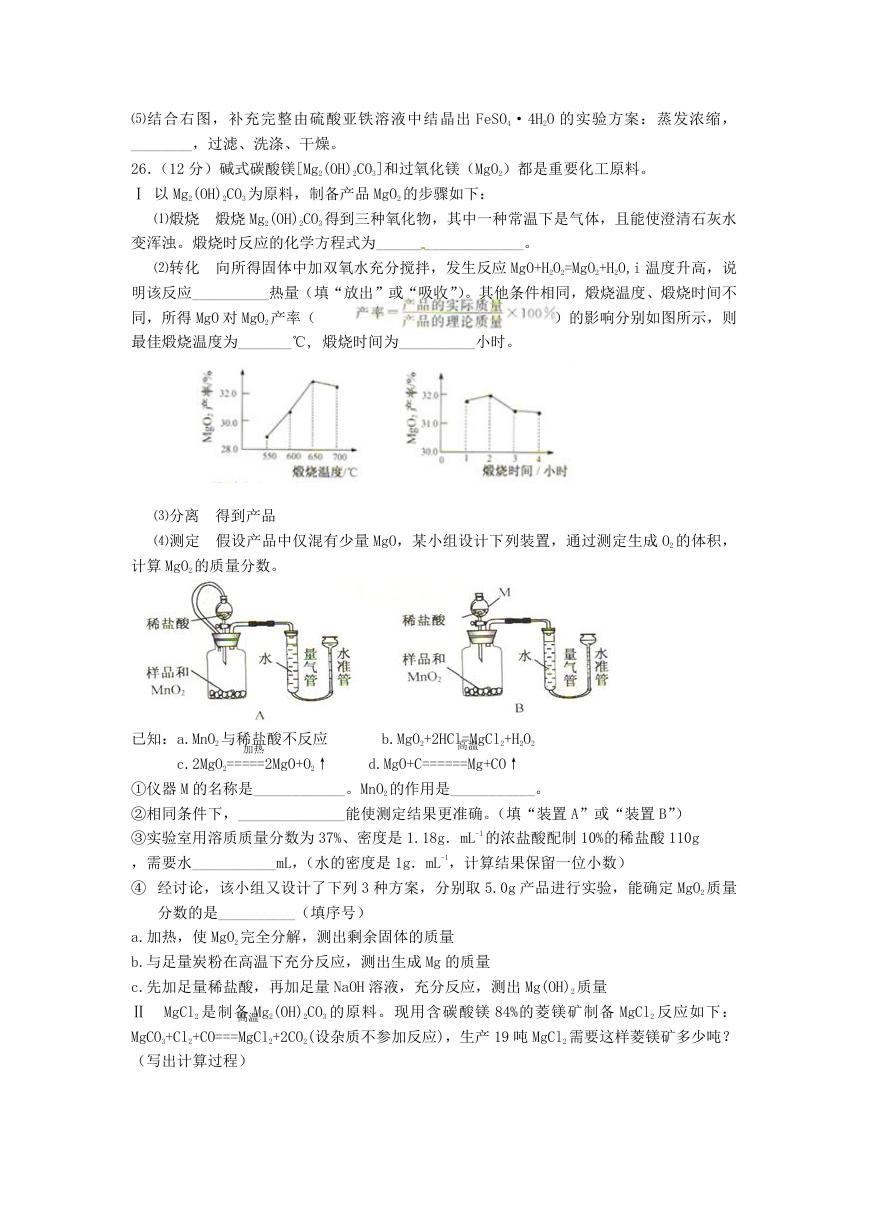
26.(12 分)碱式碳酸镁[Mg2(OH)2CO3]和过氧化镁(MgO2)都是重要化工原料。
Ⅰ 以 Mg2(OH)2CO3 为原料,制备产品 MgO2 的步骤如下:
⑴煅烧 煅烧 Mg2(OH)2CO3 得到三种氧化物,其中一种常温下是气体,且能使澄清石灰水
变浑浊。煅烧时反应的化学方程式为______ _____________。
⑵转化 向所得固体中加双氧水充分搅拌,发生反应 MgO+H2O2=MgO2+H2O,i 温度升高,说
明该反应__________热量(填“放出”或“吸收”)。其他条件相同,煅烧温度、煅烧时间不
同,所得 MgO 对 MgO2 产率(
)的影响分别如图所示,则
最佳煅烧温度为_______℃, 煅烧时间为__________小时。
⑶分离 得到产品
⑷测定 假设产品中仅混有少量 MgO,某小组设计下列装置,通过测定生成 O2 的体积,
计算 MgO2 的质量分数。
已知:a.MnO2 与稀盐酸不反应
加热
b.MgO2+2HCl=MgCl2+H2O2
高温
c.2MgO2=====2MgO+O2↑
d.MgO+C======Mg+CO↑
①仪器 M 的名称是____________。MnO2 的作用是___________。
②相同条件下,______________能使测定结果更准确。(填“装置 A”或“装置 B”)
③实验室用溶质质量分数为 37%、密度是 1.18g.mL-1 的浓盐酸配制 10%的稀盐酸 110g
,需要水___________mL,(水的密度是 1g.mL-1,计算结果保留一位小数)
④ 经讨论,该小组又设计了下列 3 种方案,分别取 5.0g 产品进行实验,能确定 MgO2 质量
分数的是__________(填序号)
a.加热,使 MgO2 完全分解,测出剩余固体的质量
b.与足量炭粉在高温下充分反应,测出生成 Mg 的质量
c.先加足量稀盐酸,再加足量 NaOH 溶液,充分反应,测出 Mg(OH)2 质量
Ⅱ MgCl2 是制备 Mg2(OH)2CO3 的原料。现用含碳酸镁 84%的菱镁矿制备 MgCl2 反应如下:
高温
MgCO3+Cl2+CO===MgCl2+2CO2(设杂质不参加反应),生产 19 吨 MgCl2 需要这样菱镁矿多少吨?
(写出计算过程)
�
2017 江苏扬州中考化学真题参考答案
单项选择题:本题包括 15 小题,每题 2 分,共计 30 分。每小题只有一个选项符合题意
题号 1
答案 A
2
B
3
D
4
C
5
A
6
B
7
B
8
D
9
C
10
A
11
C
12
D
13
B
14
D
15
A
不定项选择题:本题包括 5 小题,每小题 2 分,共计 10 分。每小题只有一个或两个选项符
合题意。若正确答案只有一个选项,多选时,该小题得 0 分;若正确答案包括两个选项,只
选一个且正确的得 1 分,选两个且正确的得满分,但只要选错一个,该小题就得 0 分。
题号
答案
16
B
17
AD
18
B
19
D
20
AC
非选择题
21.⑴①Na ②N2O3 ③5OH- ④Zn2+
⑵①a
②b
③d
④c
⑶①4P+ 5O2
点燃 2P2O5
②Ca(OH)2 + CuSO4 == Cu(OH)2↓ + CaSO4
③CaCO3
高温 CaO + CO2↑ ④Cu+2AgNO3==Cu(NO3)2+2Ag
22.⑴①不是 C
②Ca
Fe
③b
⑵①a
b
②c
23.⑴太阳能天然气 25% 热能
⑵c
⑶1:1
⑷a
⑸b
24.⑴增大反应物间的接触面积,使反应更充分发挥,Fe3O4
⑵
MnO2
KClO
2
KCl
O3
+4
,
2
2
3
⑶除去 CO2 中的 SO2,高锰酸钾溶液颜色变浅。
⑷吸收 CO2 中的水蒸气(或干燥 CO2),偏大。
⑸吸收 CO2 测量生成 CO2 的质量, 防止空气中的 CO2 和 H2O 进入 D 装置影响测量结果。
⑹不能含有碳元素。
25.⑴a ⑵漏斗、烧杯 引流、防止局部温度过高造成液滴飞溅
⑶便于收集晶体
⑷降低晶体在水中的溶解度,从而减少晶体溶于水而造成损失。
防止温度过高晶体失去结晶水
⑸降温结晶(或冷却结晶)
26.⑴Mg2(OH)2CO3======2MgO+CO2↑+H2O
⑵放出
650
2
⑷①分液漏斗 催化作用
②A
③80.3
④abc
Ⅱ解:设需要菱镁矿的质量为 x
MgCO3+Cl2+CO===MgCl2+2CO2
高温
84
X×84%
95
19t
84:95== X×84%:19t
x=20t
答:需要这样的菱镁矿 20t
�











 2023年江西萍乡中考道德与法治真题及答案.doc
2023年江西萍乡中考道德与法治真题及答案.doc 2012年重庆南川中考生物真题及答案.doc
2012年重庆南川中考生物真题及答案.doc 2013年江西师范大学地理学综合及文艺理论基础考研真题.doc
2013年江西师范大学地理学综合及文艺理论基础考研真题.doc 2020年四川甘孜小升初语文真题及答案I卷.doc
2020年四川甘孜小升初语文真题及答案I卷.doc 2020年注册岩土工程师专业基础考试真题及答案.doc
2020年注册岩土工程师专业基础考试真题及答案.doc 2023-2024学年福建省厦门市九年级上学期数学月考试题及答案.doc
2023-2024学年福建省厦门市九年级上学期数学月考试题及答案.doc 2021-2022学年辽宁省沈阳市大东区九年级上学期语文期末试题及答案.doc
2021-2022学年辽宁省沈阳市大东区九年级上学期语文期末试题及答案.doc 2022-2023学年北京东城区初三第一学期物理期末试卷及答案.doc
2022-2023学年北京东城区初三第一学期物理期末试卷及答案.doc 2018上半年江西教师资格初中地理学科知识与教学能力真题及答案.doc
2018上半年江西教师资格初中地理学科知识与教学能力真题及答案.doc 2012年河北国家公务员申论考试真题及答案-省级.doc
2012年河北国家公务员申论考试真题及答案-省级.doc 2020-2021学年江苏省扬州市江都区邵樊片九年级上学期数学第一次质量检测试题及答案.doc
2020-2021学年江苏省扬州市江都区邵樊片九年级上学期数学第一次质量检测试题及答案.doc 2022下半年黑龙江教师资格证中学综合素质真题及答案.doc
2022下半年黑龙江教师资格证中学综合素质真题及答案.doc