2023 年北京普通高中学业水平等级性考试化学真题及答案
可能用到的相对原子质量:H-1
C-12
N-14
O-16
Mg-24
S-32
第一部分
本部分共 14 小题,每题 3 分,共 42 分。在每题列出的四个选项中,选出最符合题目要求的一项。
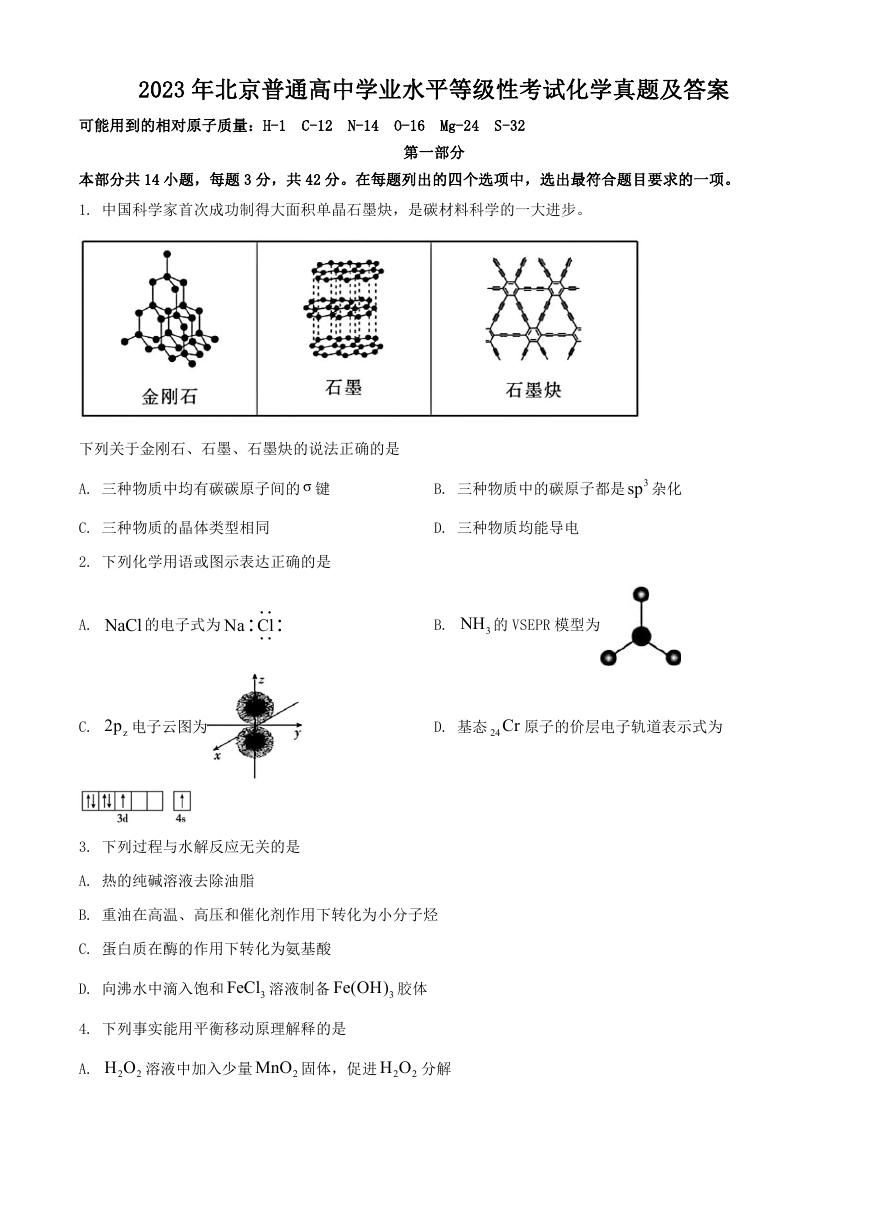
1. 中国科学家首次成功制得大面积单晶石墨炔,是碳材料科学的一大进步。
下列关于金刚石、石墨、石墨炔的说法正确的是
A. 三种物质中均有碳碳原子间的 σ 键
B. 三种物质中的碳原子都是 3sp 杂化
C. 三种物质的晶体类型相同
D. 三种物质均能导电
2. 下列化学用语或图示表达正确的是
A. NaCl 的电子式为
:
Na Cl
:
B.
3NH 的 VSEPR 模型为
C.
z2p 电子云图为
D. 基态 24Cr 原子的价层电子轨道表示式为
3. 下列过程与水解反应无关的是
A. 热的纯碱溶液去除油脂
B. 重油在高温、高压和催化剂作用下转化为小分子烃
C. 蛋白质在酶的作用下转化为氨基酸
D. 向沸水中滴入饱和
FeCl 溶液制备
3
Fe(OH) 胶体
3
4. 下列事实能用平衡移动原理解释的是
A.
2H O 溶液中加入少量
2
2MnO 固体,促进 2
2H O 分解
�
B. 密闭烧瓶内的 2NO 和 2
4N O 的混合气体,受热后颜色加深
C. 铁钢放入浓
HNO 中,待不再变化后,加热能产生大量红棕色气体
3
D. 锌片与稀 2
H SO 反应过程中,加入少量
4
CuSO 固体,促进 2H 的产生
4
5. 回收利用工业废气中的 2CO 和 2SO ,实验原理示意图如下。
下列说法不正确的是
A. 废气中 2SO 排放到大气中会形成酸雨
B. 装置 a 中溶液显碱性的原因是
3HCO 的水解程度大于
3HCO 的电离程度
C. 装置 a 中溶液的作用是吸收废气中的 2CO 和 2SO
D. 装置 b 中的总反应为 2
SO
3
CO H O
2
2
电解
HCOOH SO
2
4
6. 下列离子方程式与所给事实不相符的是
A.
2Cl 制备 84 消毒液(主要成分是 NaClO ): 2
Cl
2OH
Cl
ClO H O
2
B. 食醋去除水垢中的
CaCO :
3
CaCO 2H
3
Ca
2
H O CO
2
2
C. 利用覆铜板制作印刷电路板: 3
2Fe
Cu
2Fe
2
Cu
2
D.
2Na S 去除废水中的 2Hg : 2
Hg
2
S
HgS
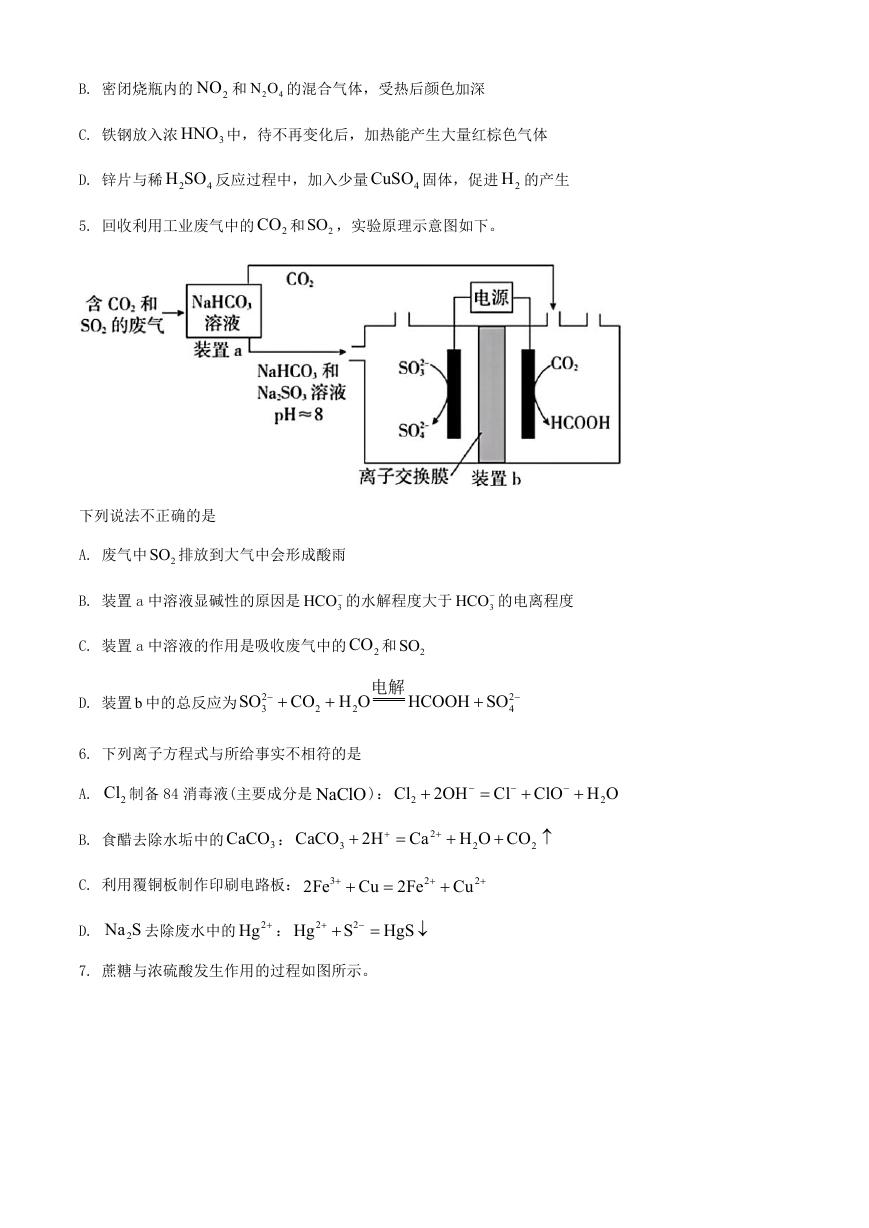
7. 蔗糖与浓硫酸发生作用的过程如图所示。
�
下列关于该过程的分析不正确的是
A. 过程①白色固体变黑,主要体现了浓硫酸的脱水性
B. 过程②固体体积膨胀,与产生的大量气体有关
C. 过程中产生能使品红溶液褪色的气体,体现了浓硫酸的酸性
D. 过程中蔗糖分子发生了化学键的断裂
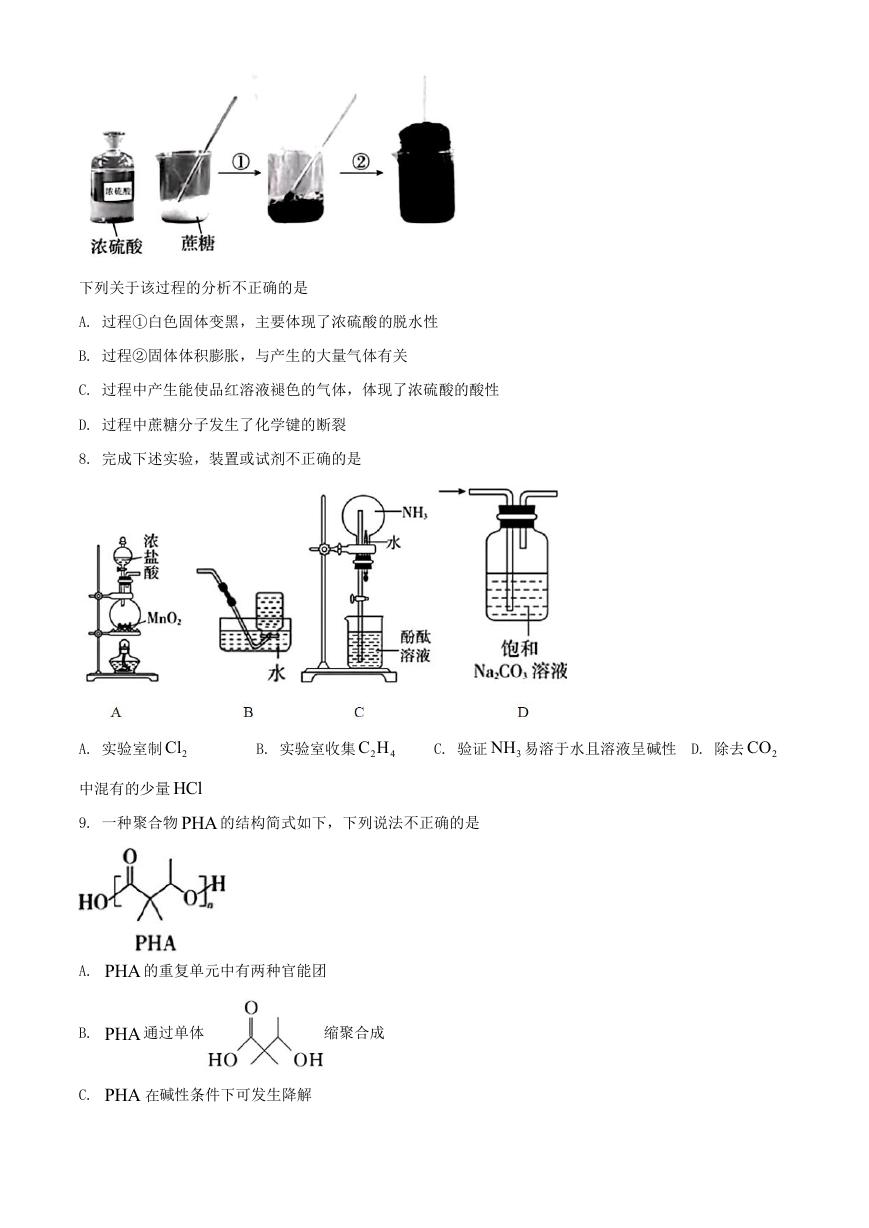
8. 完成下述实验,装置或试剂不正确的是
A. 实验室制 2Cl
B. 实验室收集 2
4C H
C. 验证 3NH 易溶于水且溶液呈碱性 D. 除去 2CO
中混有的少量 HCl
9. 一种聚合物 PHA 的结构简式如下,下列说法不正确的是
A. PHA 的重复单元中有两种官能团
B. PHA 通过单体
缩聚合成
C. PHA 在碱性条件下可发生降解
�
D. PHA 中存在手性碳原子
10. 下列事实不能通过比较氟元素和氯元素的电负性进行解释的是
A. F F 键的键能小于 Cl Cl 键的键能
B. 三氟乙酸的 aK 大于三氯乙酸的 aK
C. 氟化氢分子的极性强于氯化氢分子的极性
D. 气态氟化氢中存在
(HF) ,而气态氯化氢中是 HCl 分子
2
11. 化合物 K 与 L 反应可合成药物中间体 M ,转化关系如下。
已知 L 能发生银镜反应,下列说法正确的是
A. K 的核磁共振氢谱有两组峰
B. L 是乙醛
C. M 完全水解可得到 K 和 I
D. 反应物 K 与 L 的化学计量比是 1∶1
12. 离 子 化 合 物 2
Na O 和
2
2CaH 与 水 的 反 应 分 别 为 ①
②
A.
CaH 2H O Ca(OH)
2
2
2H
2
2
。下列说法正确的是
Na O CaH、
2
2
中均有非极性共价键
2
2Na O 2H O 4NaOH O
2
2
2
;
2
B. ①中水发生氧化反应,②中水发生还原反应
C.
Na O 中阴、阳离子个数比为1: 2 ,
2
2
2CaH 中阴、阳离子个数比为 2 :1
D. 当反应①和②中转移的电子数相同时,产生的 2O 和 2H 的物质的量相同
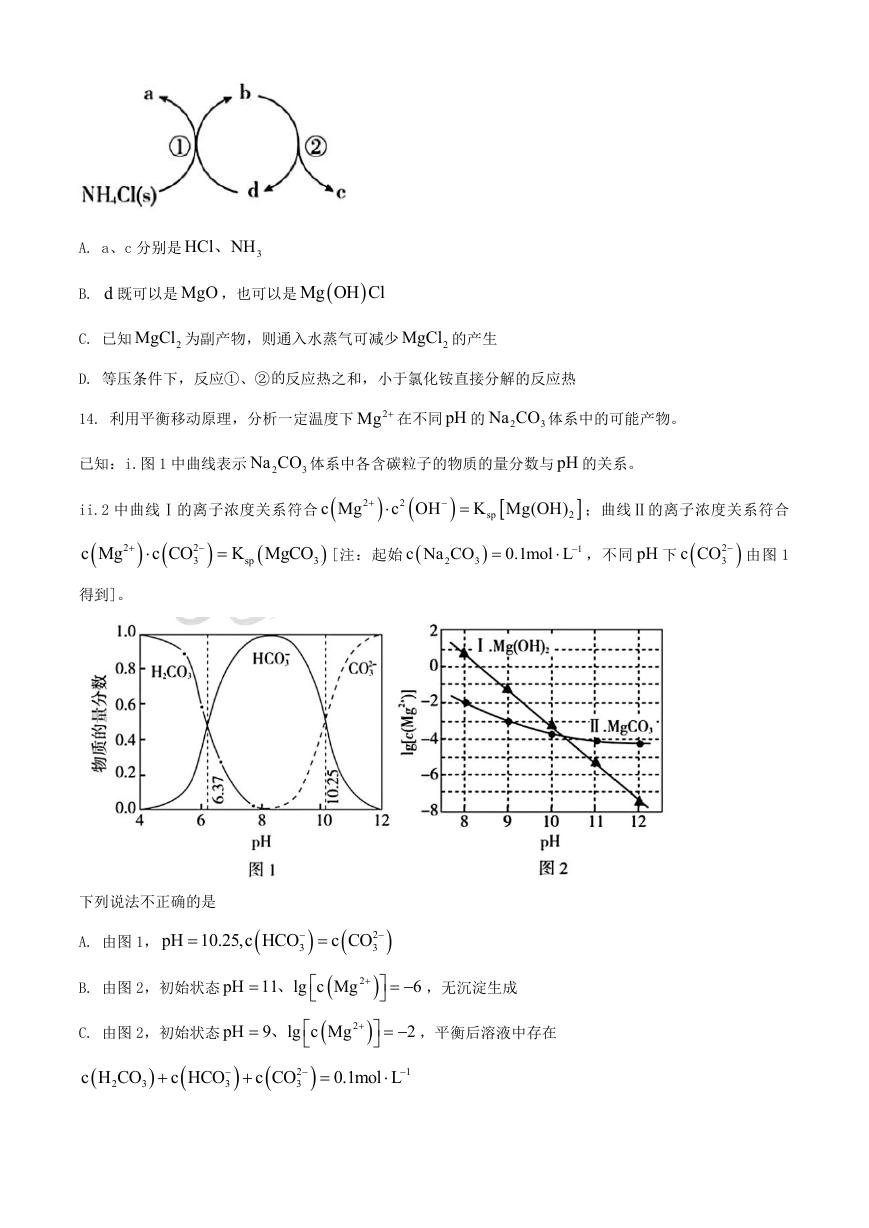
13. 一种分解氯化铵实现产物分离的物质转化关系如下,其中 b
d、 代表 MgO 或
Mg OH Cl 中的一种。
下列说法正确的是
�
A. a、c 分别是
HCl NH、
3
B. d 既可以是 MgO ,也可以是
Mg OH Cl
C. 已知
2MgCl 为副产物,则通入水蒸气可减少
2MgCl 的产生
D. 等压条件下,反应①、②的反应热之和,小于氯化铵直接分解的反应热
14. 利用平衡移动原理,分析一定温度下 2Mg 在不同 pH 的 2
Na CO 体系中的可能产物。
3
Na CO 体系中各含碳粒子的物质的量分数与 pH 的关系。
3
已知:i.图 1 中曲线表示 2
ii.2 中曲线Ⅰ的离子浓度关系符合
c Mg
K MgCO
c CO
2
3
sp
2
3
2
c OH
2
c Mg
[注:起始
K Mg(OH)
sp
2
;曲线Ⅱ的离子浓度关系符合
c Na CO
2
3
0.1mol L
,不同 pH 下
1
c CO 由图 1
2
3
得到]。
下列说法不正确的是
A. 由图 1,
pH 10.25,c HCO
3
3
、
2
c CO
2
pH 11 lg c Mg
2
pH 9 lg c Mg
2
c CO
、
3
3
1
0.1mol L
B. 由图 2,初始状态
C. 由图 2,初始状态
c H CO
2
3
c HCO
6
,无沉淀生成
2
,平衡后溶液中存在
�
D. 由图 1 和图 2,初始状态 pH 8 、
lg c Mg
2
1
,发生反应:
2
Mg
2HCO MgCO
3
CO
2
H O
2
3
第二部分
本部分共 5 小题,共 58 分。
15. 硫代硫酸盐是一类具有应用前景的浸金试剂。硫代硫酸根
原子取代的产物。
3S O 可看作是 2
2
4SO 中的一个 O 原子被S
2
(1)基态S 原子价层电子排布式是__________。
(2)比较S 原子和 O 原子的第一电离能大小,从原子结构的角度说明理由:____________________。
(3) 2
3S O 的空间结构是__________。
2
(4)同位素示踪实验可证实 2
3S O 中两个S 原子的化学环境不同,实验过程为
2
SO
2
3
S
ⅰ
S O
2
2
3
Ag
ⅱ
Ag S SO
2
2
4
。过程ⅱ中, 2
3S O 断裂的只有硫硫键,若过程ⅰ所用试剂是
2
32
Na SO 和 35S ,过程ⅱ含硫产物是__________。
2
3
(5)
MgS O 6H O
2
2
3
的晶胞形状为长方体,边长分别为 anm 、 bnm cnm、
,结构如图所示。
晶胞中的
Mg H O
2
6
常数为 ΛN ,该晶体的密度为__________
2
MgS O 6H O
个数为__________。已知
。
1nm 10 cm
g cm
7
2
3
2
3
的摩尔质量是
1
Mg mol
,阿伏加德罗
(6)浸金时, 2
3S O 作为配体可提供孤电子对与 Au 形成
2
3 2
子和端基S 原子能否做配位原子并说明理由:____________________。
Au S O
2
3
。分别判断 2
3S O 中的中心S 原
2
16. 尿素
CO NH
2 2
合成的发展体现了化学科学与技术的不断进步。
(1)十九世纪初,用氰酸银
AgOCN 与 4NH Cl 在一定条件下反应制得
CO NH ,实现了由无机物到
2 2
�
有机物的合成。该反应的化学方程式是____________________。
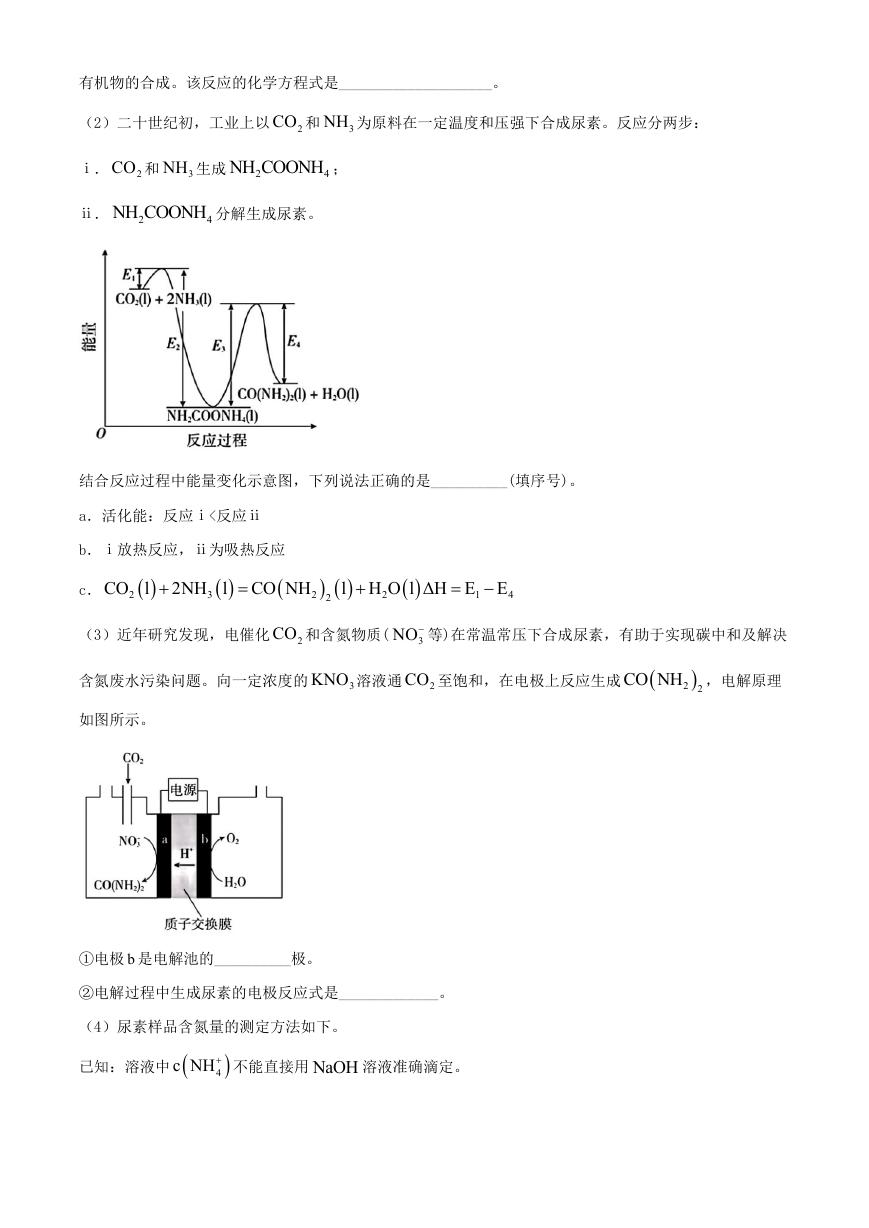
(2)二十世纪初,工业上以 2CO 和 3NH 为原料在一定温度和压强下合成尿素。反应分两步:
ⅰ. 2CO 和 3NH 生成 2
NH COONH ;
4
ⅱ. 2
NH COONH 分解生成尿素。
4
结合反应过程中能量变化示意图,下列说法正确的是__________(填序号)。
a.活化能:反应ⅰ<反应ⅱ
b.ⅰ放热反应,ⅱ为吸热反应
2NH l CO NH
CO l
c.
2
3
2
2
l H O l ΔH E E
2
1
4
(3)近年研究发现,电催化 2CO 和含氮物质(
3NO 等)在常温常压下合成尿素,有助于实现碳中和及解决
含氮废水污染问题。向一定浓度的
如图所示。
KNO 溶液通 2CO 至饱和,在电极上反应生成
3
CO NH ,电解原理
2 2
①电极 b 是电解池的__________极。
②电解过程中生成尿素的电极反应式是_____________。
(4)尿素样品含氮量的测定方法如下。
已知:溶液中
4
c NH 不能直接用 NaOH 溶液准确滴定。
�
①消化液中的含氮粒子是__________。
②步骤ⅳ中标准 NaOH 溶液的浓度和消耗的体积分别为 c 和 V ,计算样品含氮量还需要的实验数据有
__________。
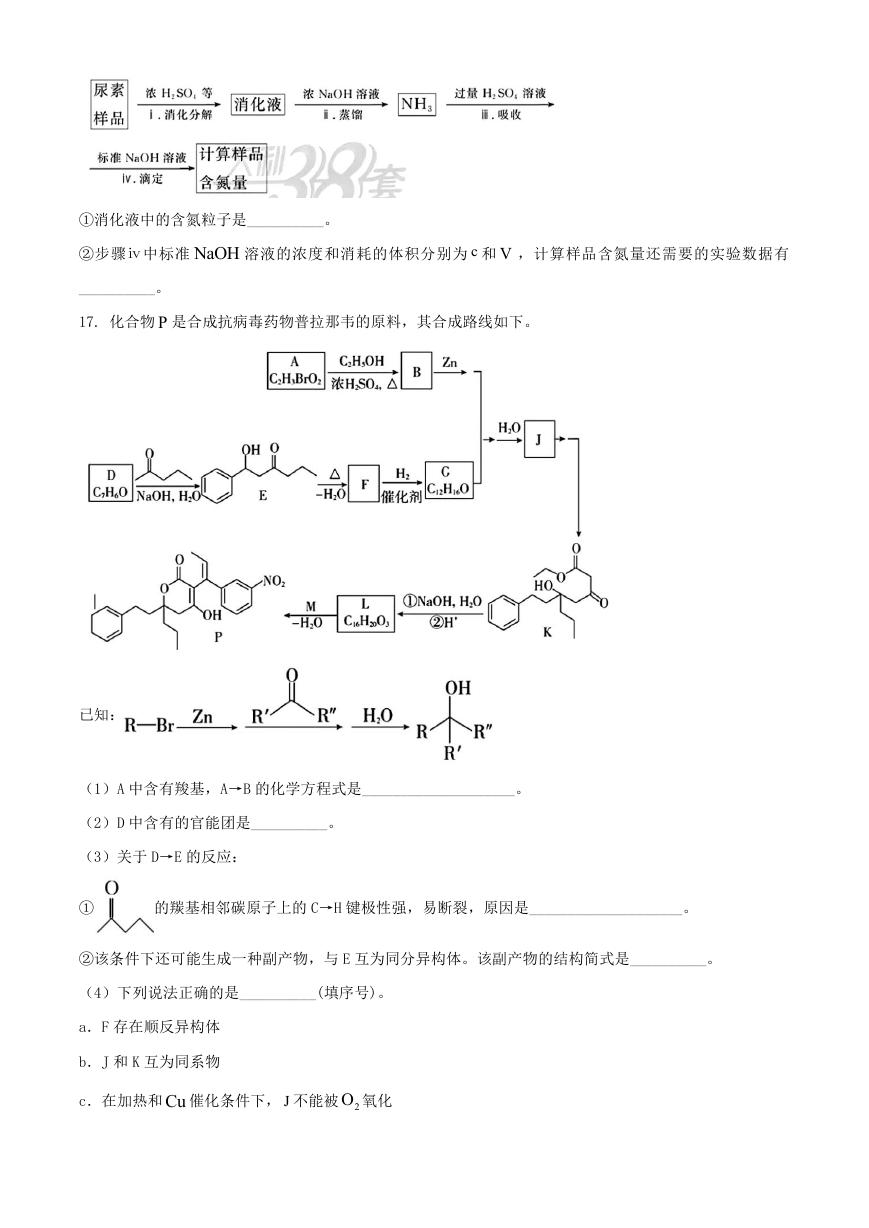
17. 化合物 P 是合成抗病毒药物普拉那韦的原料,其合成路线如下。
已知:
(1)A 中含有羧基,A→B 的化学方程式是____________________。
(2)D 中含有的官能团是__________。
(3)关于 D→E 的反应:
①
的羰基相邻碳原子上的 C→H 键极性强,易断裂,原因是____________________。
②该条件下还可能生成一种副产物,与 E 互为同分异构体。该副产物的结构简式是__________。
(4)下列说法正确的是__________(填序号)。
a.F 存在顺反异构体
b.J 和 K 互为同系物
c.在加热和Cu 催化条件下, J 不能被 2O 氧化
�










 2023年江西萍乡中考道德与法治真题及答案.doc
2023年江西萍乡中考道德与法治真题及答案.doc 2012年重庆南川中考生物真题及答案.doc
2012年重庆南川中考生物真题及答案.doc 2013年江西师范大学地理学综合及文艺理论基础考研真题.doc
2013年江西师范大学地理学综合及文艺理论基础考研真题.doc 2020年四川甘孜小升初语文真题及答案I卷.doc
2020年四川甘孜小升初语文真题及答案I卷.doc 2020年注册岩土工程师专业基础考试真题及答案.doc
2020年注册岩土工程师专业基础考试真题及答案.doc 2023-2024学年福建省厦门市九年级上学期数学月考试题及答案.doc
2023-2024学年福建省厦门市九年级上学期数学月考试题及答案.doc 2021-2022学年辽宁省沈阳市大东区九年级上学期语文期末试题及答案.doc
2021-2022学年辽宁省沈阳市大东区九年级上学期语文期末试题及答案.doc 2022-2023学年北京东城区初三第一学期物理期末试卷及答案.doc
2022-2023学年北京东城区初三第一学期物理期末试卷及答案.doc 2018上半年江西教师资格初中地理学科知识与教学能力真题及答案.doc
2018上半年江西教师资格初中地理学科知识与教学能力真题及答案.doc 2012年河北国家公务员申论考试真题及答案-省级.doc
2012年河北国家公务员申论考试真题及答案-省级.doc 2020-2021学年江苏省扬州市江都区邵樊片九年级上学期数学第一次质量检测试题及答案.doc
2020-2021学年江苏省扬州市江都区邵樊片九年级上学期数学第一次质量检测试题及答案.doc 2022下半年黑龙江教师资格证中学综合素质真题及答案.doc
2022下半年黑龙江教师资格证中学综合素质真题及答案.doc