2021 浙江省杭州市中考化学真题及答案
一、选择题(本大题共 60 分,每小题 3 分。每小题只有一个选项符合题意)
1. 下列有关说法正确的是
A. O2 具有助燃性
B. 铁生锈属于物理变化
C. 金属活动性 Cu 比 Mg 强
D. KClO3 属于氧化物
【答案】A
【解析】
【分析】
【详解】A、O2 具有助燃性,故 A 说法正确;
B、铁生锈,生成了新的物质,属于化学变化,故 B 说法不正确;
C、金属活动性 Cu 比 Mg 弱,故 C 说法不正确;
D、氧化物是由两种元素组成、一种元素是氧元素的化合物,KClO3 由三种元素组成,不属于
氧化物,故 D 说法不正确。
故选:A。
2. 有一种人造氢原子(可表示为 4
1H )的原子核中有 3 个中子,它可以结合成 4
1
2H 分子。
一个 4
1
2H 分子中,下列微粒的个数不等于 2 的是
B. 质子
C. 中子
D. 电子
A. 原子
【答案】C
【解析】
【分析】
【详解】由题可知,一个 4
1
2H 分子中原子、质子、电子的个数均为 2,而中子的个数为 6。
故选 C。
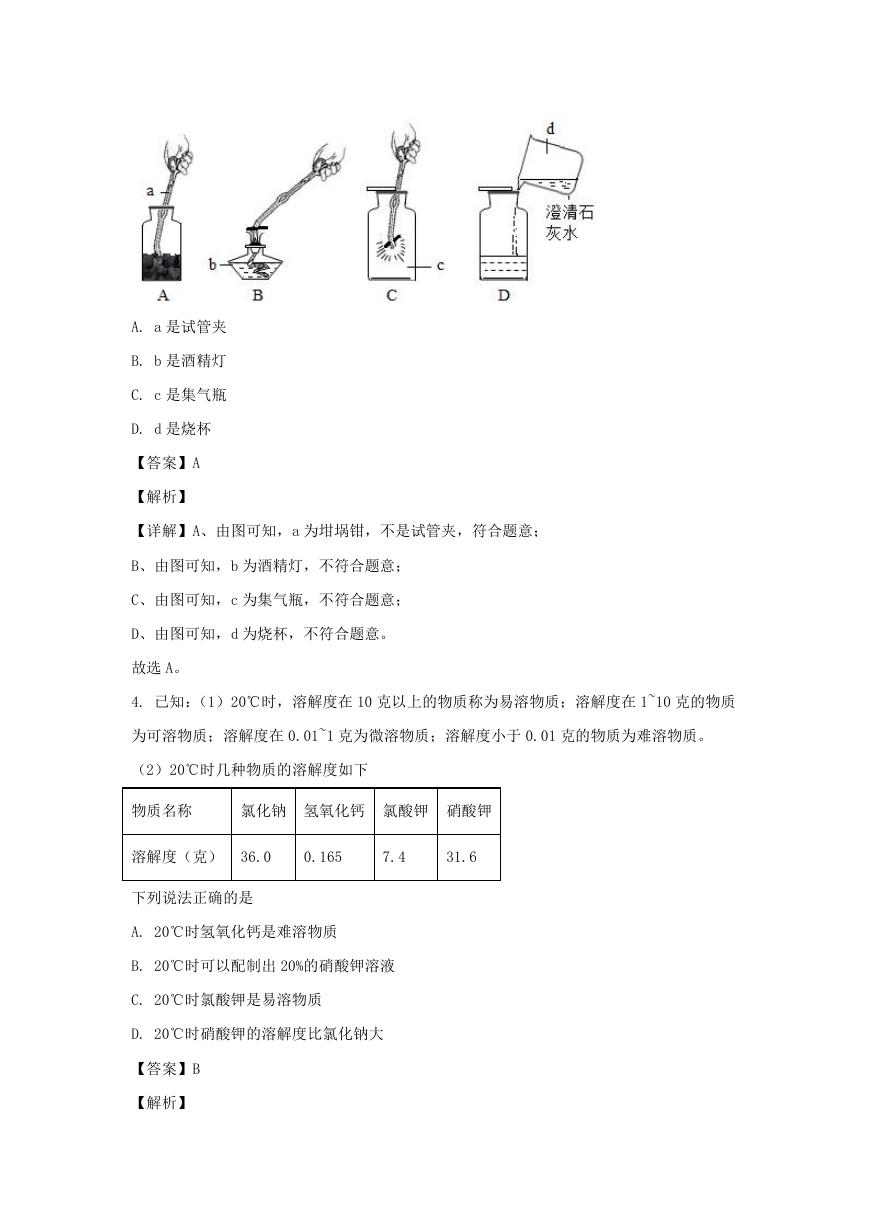
3. 以下是进行木炭在氧气中燃烧实验的示意图,有关实验仪器名称的判断,错误的是
�
A. a 是试管夹
B. b 是酒精灯
C. c 是集气瓶
D. d 是烧杯
【答案】A
【解析】
【详解】A、由图可知,a 为坩埚钳,不是试管夹,符合题意;
B、由图可知,b 为酒精灯,不符合题意;
C、由图可知,c 为集气瓶,不符合题意;
D、由图可知,d 为烧杯,不符合题意。
故选 A。
4. 已知:(1)20℃时,溶解度在 10 克以上的物质称为易溶物质;溶解度在 1~10 克的物质
为可溶物质;溶解度在 0.01~1 克为微溶物质;溶解度小于 0.01 克的物质为难溶物质。
(2)20℃时几种物质的溶解度如下
物质名称
氯化钠 氢氧化钙 氯酸钾 硝酸钾
溶解度(克) 36.0
0.165
7.4
31.6
下列说法正确的是
A. 20℃时氢氧化钙是难溶物质
B. 20℃时可以配制出 20%的硝酸钾溶液
C. 20℃时氯酸钾是易溶物质
D. 20℃时硝酸钾的溶解度比氯化钠大
【答案】B
【解析】
�
【分析】
【详解】A、在 20℃时氢氧化钙的溶解度是 0.165g,在 0.01~1g 之间,属于微溶物质,故 A
说法不正确;
B、20℃时硝酸钾的溶解度是 31.6g,饱和溶液的溶质质量分数是:
31.6g
100g+31.6g
100% 24.0%
>20%,所以可以配制出 20%的硝酸钾溶液,故 B 说法正确;
C、20℃时氯酸钾的溶解度是 7.4g,在 1~10g 之间,属于可溶物质,故 C 说法不正确;
D、由表中的数据可知,20℃时硝酸钾的溶解度比氯化钠小,故 D 说法不正确。
故选:B。
5. 下列依据实验现象得出的结论错误的是
选
项
A
B
C
D
实验操作与现象
实验结论
将 1g 白磷、1g 红磷分别放入两支带塞的试管中,再将试
管同时浸入约 80℃的热水里,只有白磷燃烧
白磷的着火点比红磷低
将二氧化碳通入紫色石蕊试液,试液变红
二氧化碳是一种酸
在常温常压下,硫在氧气中燃烧比在空气中燃烧得更剧烈
该条件下,氧气的浓度越
大,硫燃烧越剧烈
将铁粉、硫粉按一定比例混合加热后,所得固体物质不能
铁粉已跟硫粉发生了化学
被磁铁吸引
反应
B. B
C. C
D. D
A. A
【答案】B
【解析】
【分析】
【详解】A、将 1g 白磷、1g 红磷分别放入两支带塞的试管中,再将试管同时浸入约 80℃的
热水里,白磷、红磷都与氧气接触,白磷燃烧,红磷不燃烧,说明白磷的着火点比红磷低,
不符合题意;
B、将二氧化碳通入紫色石蕊试液,试液变红,是因为二氧化碳和水反应生成碳酸,碳酸显
�
酸性,能使紫色石蕊试液变红,二氧化碳不是酸,符合题意;
C、在常温常压下,硫在氧气中燃烧比在空气中燃烧得更剧烈,说明该条件下,氧气的浓度
越大,硫燃烧越剧烈,不符合题意;
D、将铁粉、硫粉按一定比例混合加热后,所得固体物质不能被磁铁吸引,说明铁发生了反
应,应该是铁粉与硫粉发生了反应,不符合题意。
故选 B。
6. 取稀盐酸与氢氧化钠反应后的溶液进行实验。下列能说明稀盐酸、氢氧化钠恰好都完全
反应的是
A. 加硝酸银溶液,有白色沉淀生成
B. 加氢氧化镁固体,固体全部溶解
C. 加酚酞试液,溶液显红色
D. 测定溶液的 pH,刚好显中性
【答案】D
【解析】
【分析】
【详解】A、加硝酸银溶液,则生成的氯化钠也能与硝酸银反应产生白色沉淀,不能证明稀
盐酸、氢氧化钠恰好都完全反应,说法错误;
B、加氢氧化镁固体,固体全部溶解,说明溶液中含有剩余的盐酸,二者没有恰好完全反应,
说法错误;
C、加酚酞试液,溶液显红色,,说明溶液中含有氢氧化钠,二者没有恰好完全反应,说法错
误:
D、测定溶液的 pH,刚好显中性,证明稀盐酸、氢氧化钠恰好完全反应,说法正确。
故选:D
二、填空题(本大题共 26 分)
7. 二氧化碳的资源化利用是实现碳减排的重要途径。以下是一种实现二氧化碳转化为重要
原料二甲醚(化学式为 C2H6O)的途径:
(1)转化①是二氧化碳与一种常见单质反应生成甲醇和水,这种单质的化学式为
___________。
�
(2)转化②是甲醇发生分解反应生成二甲醚和水,反应中生成二甲醚和水的分子数之比为
___________。
【答案】
①. H2 ②. 1:1
【解析】
【分析】
【详解】(1)转化①是二氧化碳与一种常见单质反应生成甲醇和水,根据质量守恒定律,化
学反应前后,元素的种类不变,反应物中含 C、O 元素,生成物中含 C、H、O,故反应物中
还应含氢元素,故单质为氢气,化学式为 H2;(2)由题可知,转化②是甲醇发生分解反应生
成二甲醚和水,该反应的化学方程式为:
一定条件
2CH O
4
甲醚和水的分子数之比为 1:1。
C H O+H O
2
6
2
,反应中生成二
8. 实验室常用锌和稀硫酸来制取氢气,向盛有稀硫酸溶液的烧杯中加入足量的锌至反应完
全。
(1)写出该反应的化学方程式___________。
(2)如图的“ ”“ ”“
”表示溶液中由溶质电离产生的不同反应前离子,则“
”
表示___________(填写离子符号)。
【答案】
①. Zn+H2SO4=ZnSO4+H2↑
②.
2-
4SO
【解析】
【分析】
【详解】(1)锌和稀硫酸反应生成硫酸锌和氢气,反应的化学方程式为 Zn+H2SO4==ZnSO4+H2
↑。
(2)由图可知,其一,反应后 消失,所以可推断出 代表的是氢离子,其二, 反应后
才出现,所以可推断出 是锌离子,最后因为反应前后都存在
,所以可推断出
是
硫酸根离子,其离子符号为:SO4
2—。
�
三、实验探究题(本大题共 42 分)
9. 某种粗盐水中有少量含 2-
4SO 、K+的杂质,小金用这种粗盐水经过下列实验流程制取纯净
氯化钠晶体。
(1)固体 A 是___________。(填化学式)
(2)加碳酸钠溶液时发生反应的化学方程式___________。
(3)若将溶液 C 蒸发至出现大量固体时停止加热,利用余热将溶液蒸干得到晶体,所得晶
体仍不是纯净的氯化钠,理由是___________。
【答案】
①. BaSO4
②. BaCl2+Na2CO3=BaCO3↓+2NaCl
③. 钾离子未除去
【解析】
【分析】
【详解】(1)粗盐水中有少量含 SO4
2-、K+,加入过量氯化钡,Ba2+与 SO4
2-结合生成硫酸钡白
色沉淀,化学式为 BaSO4;
(2)溶液 A 中有过量氯化钡,加入过量碳酸钠溶液,氯化钡与碳酸钠反应生成碳酸钡沉淀
和氯化钠,化学方程式为:BaCl2+Na2CO3═BaCO3↓+2NaCl;
(3)溶液 B 中含过量的碳酸钠,还有氯化钠和 K+,加过量盐酸,碳酸钠与盐酸反应生成氯
化钠、水和二氧化碳,溶液 C 含有氯化钠和 K+,若将溶液 C 蒸发至出现大量固体时停止加热,
利用余热将溶液蒸干得到晶体,所得晶体仍不是纯净的氯化钠,理由是钾离子未除去。
10. 小金为了探究氧化铜与氢气的反应和反应产物,用如图所示装置进行实验。注射器内装
满氢气,并将注射器针头扎 200mL 注射器入橡皮塞中。将少许氧化铜粉末送入长柄 U 形石英
玻璃管内并平铺于管底。将少量白色的无水硫酸铜粉末送入长柄 U 形石英玻璃管中并平铺于
直管中部。然后将一个气球套在长柄氢气 U 形石英玻璃管的直管出口处,连接好整个实验装
置并检查装置气密性……
�
(1)为确保实验安全,在点燃酒精灯加热前的操作是___________。
(2)装置末端连接的气球的作用是___________。
(3)实验过程中,当观察到___________现象时可判断一定有产物水生成。
(4)实验开始时加入 a 克纯氧化铜粉末,实验结束后取出 U 形管底的固体称量为 b 克,当
b 为___________(用含有 a 式子表示)时,可判断氧化铜已完全转化为铜。
【答案】
①. 通入氢气
②. 收集尾气(或防止空气中的水蒸气进入)
③. U 形
石英玻璃管的直管中部白色粉末变蓝
④. 解:设 ag 氧化铜完全反应生成铜的质量为 x
H +CuO Cu + H O
2
Δ
2
80
ga
64
x
g
80
a
64
x
x=0.8a,
故当 b为 0.8a时,可判断氧化铜已完全转化为铜。
【解析】
【分析】
【详解】(1)氢气具有可燃性,不纯时点燃或加热可能产生爆炸,故做氢气还原氧化铜实验
时要先通一段时间氢气将空气排净后再加热;
(2)装置末端连接的气球的作用是收集尾气或防止空气中的水蒸气进入。
(3)无水硫酸铜遇到水会变成蓝色,所以当观察到 U 形石英玻璃管的直管中部白色粉末变
蓝现象时可判断一定有产物水生成。
�
(4)见答案。
11. 牙是人体口腔内的消化器官。而龋齿(俗称蛀牙)是青少年中发生率很高的牙病。
含氟牙膏中摩擦剂的种类对氟化物能否有效预防龋齿有较大影响。假如某含氟牙膏中使用的
摩擦剂成分可能为碳酸钙、水合硅石(不溶于水且不与盐酸反应)中的一种或两种,而牙膏
的其他成分均能溶于水且不与盐酸反应。请设计实验探究此牙膏中摩擦剂的成分。
___________(写出实验思路即可)
【答案】①取一定量的牙膏样品,加蒸馏水溶解。②过滤,分离滤液与沉淀。③取沉淀加过
量盐酸,观察其溶解的情况,若全部溶解,则摩擦剂的成分是 CaCO3;若部分溶解,则摩擦
剂的成分是 CaCO3 和水合硅石;若全部不溶解,则摩擦剂的成分是水合硅石
【解析】
【详解】碳酸钙与盐酸反应生成二氧化碳、可溶性氯化钙和水;水合硅石(不溶于水且不与
盐酸反应)。
实验探究此牙膏中摩擦剂的成分实验思路为:
①取一定量的牙膏样品,加蒸馏水溶解。
②过滤,分离滤液与沉淀。
③取沉淀加过量盐酸,观察其溶解的情况,
若全部溶解,则摩擦剂的成分是 CaCO3;
若部分溶解,则摩擦剂的成分是 CaCO3 和水合硅石;若全部不溶解,则摩擦剂的成分是水合
硅石。
四、解答题(本大题共 32 分)
12. 磁铁矿石(含 Fe3O4)是常用的炼铁原料,工业上可通过如下反应:
高温
4CO+Fe3O4
Fe+4CO2,将其中的 Fe3O4 转化为 Fe。
(1)Fe3O4 中铁元素和氧元素的质量比为___________。
(2)假设治炼过程中铁没有损耗,用含有 464 吨 Fe3O4 的磁铁矿石可提炼出含铁质量分数为
96%的生铁多少吨?
【答案】(1)21:8
(2)Fe3O4 中含铁元素的质量为 464t
168 100%
232
=336t,
�














 2023年江西萍乡中考道德与法治真题及答案.doc
2023年江西萍乡中考道德与法治真题及答案.doc 2012年重庆南川中考生物真题及答案.doc
2012年重庆南川中考生物真题及答案.doc 2013年江西师范大学地理学综合及文艺理论基础考研真题.doc
2013年江西师范大学地理学综合及文艺理论基础考研真题.doc 2020年四川甘孜小升初语文真题及答案I卷.doc
2020年四川甘孜小升初语文真题及答案I卷.doc 2020年注册岩土工程师专业基础考试真题及答案.doc
2020年注册岩土工程师专业基础考试真题及答案.doc 2023-2024学年福建省厦门市九年级上学期数学月考试题及答案.doc
2023-2024学年福建省厦门市九年级上学期数学月考试题及答案.doc 2021-2022学年辽宁省沈阳市大东区九年级上学期语文期末试题及答案.doc
2021-2022学年辽宁省沈阳市大东区九年级上学期语文期末试题及答案.doc 2022-2023学年北京东城区初三第一学期物理期末试卷及答案.doc
2022-2023学年北京东城区初三第一学期物理期末试卷及答案.doc 2018上半年江西教师资格初中地理学科知识与教学能力真题及答案.doc
2018上半年江西教师资格初中地理学科知识与教学能力真题及答案.doc 2012年河北国家公务员申论考试真题及答案-省级.doc
2012年河北国家公务员申论考试真题及答案-省级.doc 2020-2021学年江苏省扬州市江都区邵樊片九年级上学期数学第一次质量检测试题及答案.doc
2020-2021学年江苏省扬州市江都区邵樊片九年级上学期数学第一次质量检测试题及答案.doc 2022下半年黑龙江教师资格证中学综合素质真题及答案.doc
2022下半年黑龙江教师资格证中学综合素质真题及答案.doc