2006 年江苏南京农业大学化学考研真题
一、单项选择题(每题 1 分,共 20 分)
有机部分
1. 下列碳正离子中稳定性最大的是
(
)
A 叔丁基碳正离子 B 异丙基碳正离子 C 乙基碳正离子 D 甲基碳正离子
2. 用化学方法区别丙烯和环丙烷,应采用的试剂是
(
)
A 溴水
B 溴的四氯化碳溶液
C 酸性高锰酸钾
D 硝酸银的氨溶液
3. 下列几种酚中 pKa 最大是
(
)
A 苯酚
B 2,4,6-三硝基苯酚
C 对硝基苯酚
D 对甲苯酚
4. 丙烯在光照条件下与氯反应生成烯丙基氯,该反应属于
(
)
A 亲电加成
B 亲核取代
C 自由基取代
D 亲电取代
5. 乙醇的水溶性大于 1-丁烯,这主要是因为
(
)
A 乙醇的分子量小于正丁烷
B 乙醇分子中的氧原子为 sp3 杂化
C 乙醇可与水形成氢键
D 乙醇分子中没有 键
6. 不具有还原性的糖是
A 蔗糖
B 麦芽糖
C 纤维二糖
D 果糖
7. 等电点时蛋白质的电荷状态为
(
)
(
)
A 带正电荷
B 带负电荷
C 净电荷为零
D 与非等电点时状态相同
8. 油脂碘值的大小可以说明其
(
)
A 酸败程度
B 平均相对分子质量
C 干性好坏
D 水解活泼性
9. 回流反应所采用的冷凝管为
(
)
A 直型冷凝管
B 蛇型冷凝管
C 球型冷凝管
D 空气冷凝管
10. 下列脂肪酸中,属于饱和脂肪酸的是
(
)
A 亚麻酸
B 亚油酸
C 油酸
D 软脂酸
11. 和 D-果糖生成相同糖脎的是
(
)
A 麦芽糖
CH3
B
D-核糖
C ?D-葡萄糖
D
L-甘露糖
OH
为同一物质的是
(
)
OH
H
CH3
C
H
OH
Cl
D
CH3
HO
CH3
H
Cl
12. 与
A
H
Cl
Cl
B
H
OH
Cl
CH3
�
13. 下列化合物中碱性最强的是
A 苯胺
B 乙胺
C 乙酰苯胺
D 吡咯
14. 能发生碘仿反应的化合物为
A 甲醛
B 乙醛
C 丙醛
D 3-戊酮
15. 水解反应最快的化合物是
(
)
(
)
(
)
O
A
R-C-Cl
B
(RCO)2O
C
RCOOR'
D
16. 下列化合物中可以和亚硫酸氢钠发生反应的是
RCONH2
(
)
A 二苯酮
B 丙醛
C
1-苯-1-丁酮
D
3-己酮
17. 具有顺反异构体的是
(
)
A
C
CH3
CH
CH3
C
CH3
C
CH3
CH
COOH
COOH
B
D
CH3
CH
CH3
C
CH3
CH2
CH2
18. 在实验室的合成实验中对酯类产物进行干燥,常用的干燥剂是
(
)
A 无水 K2CO3
B 无水 CaCl2
C 粒状 NaOH
D 无水 MgSO4
19. SN2 反应历程的特点是
(
)
A 反应分两步进行
B 反应速度与碱的浓度无关
C 产物的构型完全转化
D 反应过程中生成活性中间体 R+
20. 乙酰苯胺常用的纯化方法是
(
)
A 常压蒸馏
B 重结晶
C 萃取分液
D 水蒸汽蒸馏
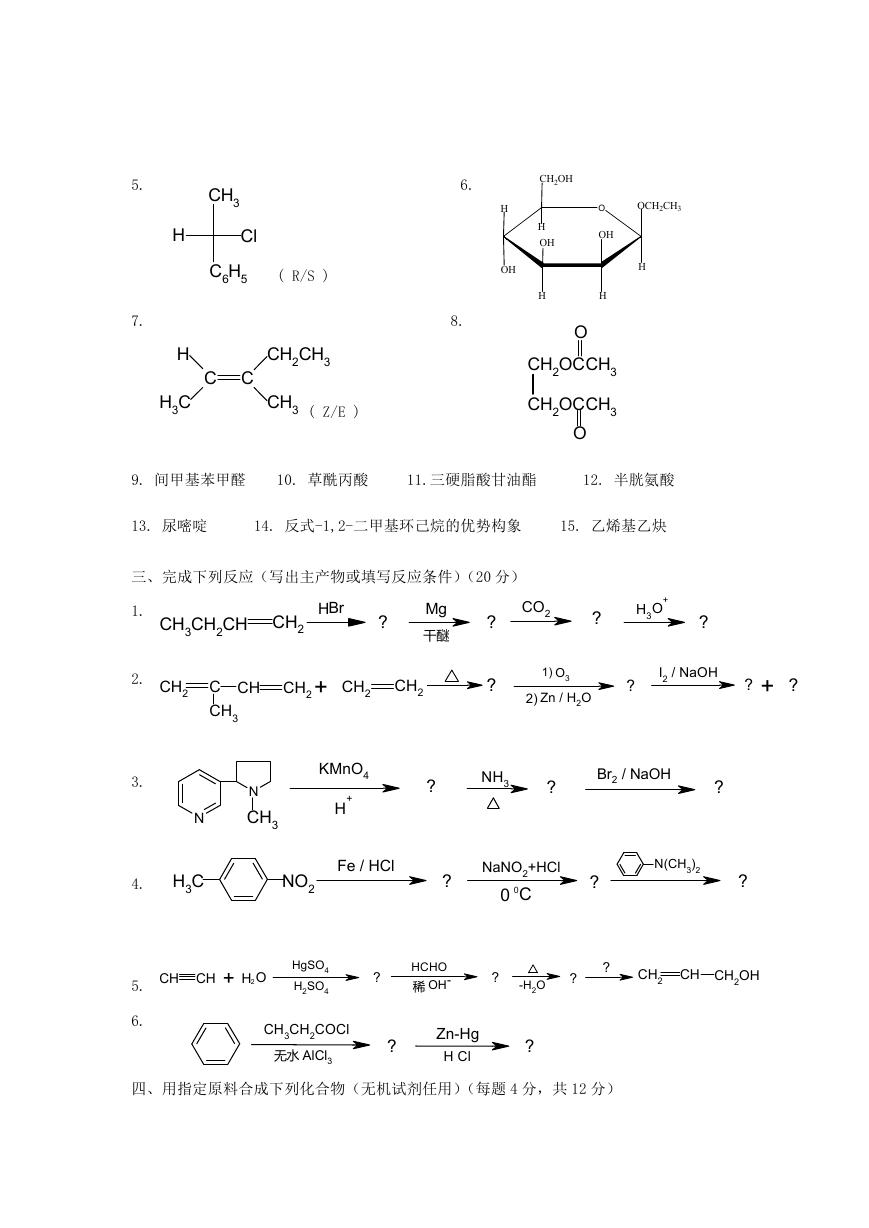
二、命名下列化合物或写出下列化合物的结构简式(每题 1 分,共 15 分)
O
O
CH3CCH2CCH3
1.
3.
HO
+Br
N2
2.
4.
CH3
NHCH3
CH3-CH-CH2-CH-CH3
H
H
CH3
C6H5
H
H
�
H
CH3
Cl
C6H5
( R/S )
5.
7.
H
H3C
C C
CH2CH3
CH3
( Z/E )
6.
CH2OH
H
OH
H
OH
H
OCH2CH3
H
O
OH
H
8.
O
CH2OCCH3
CH2OCCH3
O
9. 间甲基苯甲醛
10. 草酰丙酸
11.三硬脂酸甘油酯
12. 半胱氨酸
13. 尿嘧啶
14. 反式-1,2-二甲基环己烷的优势构象
15. 乙烯基乙炔
三、完成下列反应(写出主产物或填写反应条件)(20 分)
1.
CH3CH2CH CH2
HBr
?
Mg
干醚
2.
CH2
CH
C
CH3
CH2+
CH2
CH2
?
?
CO2
H3O+
?
?
1)
O3
2) Zn / H2O
I2 / NaOH
?
?
+
?
3.
N
CH3
N
KMnO4
H+
?
NH3
?
Br2 / NaOH
?
4.
H3C
NO2
Fe / HCl
?
NaNO2+HCl
0
0 C
?
N(CH3)2
?
5.
6.
CH CH + OH2
HgSO4
H2SO4
?
HCHO
稀 OH-
?
-H2O
?
?
CH2
CH
CH2OH
CH3CH2COCl
无水
AlCl3
?
Zn-Hg
H Cl
?
四、用指定原料合成下列化合物(无机试剂任用)(每题 4 分,共 12 分)
�
1.
CH3
COOH
2.
CH2
CH2
CN
CH2COOC2H5
CH2COOC2H5
3.
CH2=CH-CH=CH2
五、推导化学结构式(4 分)
有一化合物 C8H14O(A),能很快使溴的四氯化碳溶液褪色,并能与苯肼反应生成黄色沉
淀。A 经酸性高锰酸钾氧化生成一分子丙酮和另一酸性化合物 B。B 与碘的氢氧化钠作用后
生成碘仿和丁二酸盐。试求出 A 的结构简式并写出相关的化学反应方程式。
六、设计水杨酸甲酯的合成实验方案,其中包括合成原料、反应方程式、提高合成收率及产
物纯化的方法(4 分)。
无机部分
一、选择题(单选题,共 30 分)
1、下列说法正确的是(
)
A.热物体比冷物体含有更多内能
C.热是一种传递中能量
)
2、下列说法正确的是(
A.质量作用定律适用于任何化学反应
B.反应速率常数与反应物浓度无关
C.反应活化能越大,反应速率也越大
D.要加热才能进行的反应一定是吸热反应
B.物体温度高说明含有热量也高
D.同一状态下有多个热力学能值
3、以下说法恰当的是(
)
A.放热反应是自发反应
C.冰在室温下自动熔化为水是熵变起主要作用
B.熵变为负的反应不能自发进行
D. r mGΘΔ 数据可以用来判定反应自发方向
4、铜的价电子构型为 3d104s1,而不是 3d94s2,这主要是由(
)决定的。
A. 玻尔原子理论
C. 泡利不相容原理
5、下列各组分子中,只存在色散力的是(
B.能量最低理论
D.洪特规则
)
A.I2 和 CCl4
B.NH3 和 H2O
C.Br2 和 H2O
D.HCl 和 HF
6、根据酸碱质子理论,下列物质中既是酸、又是碱的是(
)
A. HAc
B. CO
C. HPO
D. NH
�
7、下列离子中,S 的氧化数最高的是(
)
A. S2O
B. S2O
C. S2O
D. S2O
8、已知反应 C(s,石墨)+ O2(g)= CO2(g)的标准摩尔焓为 r
mH ΘΔ
,则该反应的
mrU ΘΔ
等
于(
)
mH ΘΔ
r
mH ΘΔ
r
A.
C.
- 2.48 kJ/mol
mH ΘΔ
r
B.
+ 2.48 kJ/mol
mH ΘΔ
r
D.
9、如果反应 2A(g) + B(g) = C (g) 的速率方程为 v = kc2 (A)c(B)。若反应容器体积增加
一倍,则反应速率为原来的(
)
A. 6 倍
B.1/6 倍
C. 8 倍
D. 1/8 倍
10、pH=6 的溶液的酸度是 pH=3 的溶液的(
)倍
A. 3
B. 1/3
C. 300
D. 1/1000
11、295K 时,水的 wKΘ 是 1.0×10-14;313K 时, wKΘ 是 3.8×10-14。313K 时,c(H3O+)=1.0×10-7
的水溶液是(
)
A. 酸性
B. 中性
C. 碱性
D. 缓冲溶液
12、某温度下, spKΘ (Mg(OH)2) = 8.39×10-12,则 Mg(OH)2 的溶解度为(
)mol·L-1
A. 1.28×10-4
B. 2.03×10-4
C. 2.89×10-6
D. 2.90×10-4
13、已知在室温时,醋酸的电离度约为 2.0%,其 aKΘ =1.75×10-5,该醋酸的浓度是(
)
mol·L-1
A. 4.0
B. 0.044
C. 0.44
D. 0.005
14、下列成对物质的标准电极电位值最大的是( )
A. Ag 和 AgCl
B. Ag 和 AgNO3
C. Ag 和 Ag(NH3)2
+
D. Ag 和 AgOH
15、已知
Θ
3+
2+
(Fe /Fe )
=0.77V,下列哪一种物质加入到电极溶液中可以使电对 Fe3+/Fe2+的电
极电位升高(
A. HCl
)
B. EDTA
C. H2C2O4
D. 邻啡罗林
二、名词解释(共 15 分)
1、反渗透
2、标准摩尔生成焓
3、稀释定律
4、多基(齿)配位体
�
5、磁量子数的物理意义
三、简答题(共 10 分)
1、元素
[Kr]4d 5s ,
7
1
He 2s 2p ,
2
2
Xe 4f 5d 6s ,
1
1
2
Rn 5f 6d 7s 的序号各是多少,
14
4
2
排列是否规律。如不规律,违反核外电子排布原则的哪一条?(4 分)
2、简述盐析和聚沉各针对什么溶液而言,它们之间的不同点是什么? (3 分)
3、为什么不能根据反应方程式直接写出反应速率方程式,但可以直接写出平衡常数表达式?
(3 分)
四 计算题(共 20 分)
1、30℃条件下,在一个容积为 10.0L 的容器中,O2、N2 和 CO2 气体总压力为 100kPa,其中
p
(O ) 28.0kPa
2
,CO2 的含量为 4.40g,试求:
(1) 容器中 CO2 分压
(2) 容器中 N2 分压
(3) O2 的摩尔分数
2 、 已 知 反 应 Ag+ + 2CN = [Ag(CN)2]- 的 fKΘ =1.3×1021 , 反 应 Ag2S(s) = 2Ag+ + S2- 的
spKΘ =1.6×10-49。求反应 2[Ag(CN)2]- + S2- = Ag2S(s) + 4CN- 的平衡常数。
3、在含有 0.010mol/L Zn2+,0.10mol/L HAc 和 0.05mol/LNaAc 的溶液内,不断通入 H2S 气
体并且使之饱和(饱和 H2S 溶液浓度是 0.1mol/L)沉淀出 ZnS 后,溶液中残留的 Zn2+浓度多少?
( spKΘ (ZnS)=2.5×10–22 , a (HAc)
KΘ
=1.8×10–5,
KΘ
1a
(H S)
2
=1.3×10 –7,
KΘ
2a
(H S)
2
=7.1×
10–15)
4、已知
Θ
2+
(Zn /Zn)
= -0.703V,
Θ
(Zn(CN)
2
4
/Zn)
= -1.259V,求
KΘ
f
(Zn(CN)
2
4
)
之值。
�











 2023年江西萍乡中考道德与法治真题及答案.doc
2023年江西萍乡中考道德与法治真题及答案.doc 2012年重庆南川中考生物真题及答案.doc
2012年重庆南川中考生物真题及答案.doc 2013年江西师范大学地理学综合及文艺理论基础考研真题.doc
2013年江西师范大学地理学综合及文艺理论基础考研真题.doc 2020年四川甘孜小升初语文真题及答案I卷.doc
2020年四川甘孜小升初语文真题及答案I卷.doc 2020年注册岩土工程师专业基础考试真题及答案.doc
2020年注册岩土工程师专业基础考试真题及答案.doc 2023-2024学年福建省厦门市九年级上学期数学月考试题及答案.doc
2023-2024学年福建省厦门市九年级上学期数学月考试题及答案.doc 2021-2022学年辽宁省沈阳市大东区九年级上学期语文期末试题及答案.doc
2021-2022学年辽宁省沈阳市大东区九年级上学期语文期末试题及答案.doc 2022-2023学年北京东城区初三第一学期物理期末试卷及答案.doc
2022-2023学年北京东城区初三第一学期物理期末试卷及答案.doc 2018上半年江西教师资格初中地理学科知识与教学能力真题及答案.doc
2018上半年江西教师资格初中地理学科知识与教学能力真题及答案.doc 2012年河北国家公务员申论考试真题及答案-省级.doc
2012年河北国家公务员申论考试真题及答案-省级.doc 2020-2021学年江苏省扬州市江都区邵樊片九年级上学期数学第一次质量检测试题及答案.doc
2020-2021学年江苏省扬州市江都区邵樊片九年级上学期数学第一次质量检测试题及答案.doc 2022下半年黑龙江教师资格证中学综合素质真题及答案.doc
2022下半年黑龙江教师资格证中学综合素质真题及答案.doc