2010 年云南楚雄中考化学真题及答案
(全卷三个大题,共 30 个小题,共 8 页,满分 100 分,考试时间 120 分钟)
可能用到的相对原子质量:H-1
Cl-35.5
S-32
一.选择题(本大题共 15 小题,每小题 2 分,共 30 分)
1.下列变化不属于化学变化的是(
Na-23
N-14
O-16
C-12
)
Ca-40
)
B.淀粉
C.蛋白质
D.淀粉水解成葡萄糖
B.铜首表面产生铜绿 C.水蒸发
A.铝箔在氧气中燃烧
2.多吃蔬菜、水果有益健康,主要原因是蔬菜、水果中富含人体需要的(
A.油脂
D.维生素
3.“海宝”是 2010 年上海世博会的吉祥物,其形象如右图所示。有一种“海宝”的外用材
料为纯羊线,内充物为聚酯纤维。下列说法错误的是(
A.羊毛和聚酯纤维都属于合成材料
B.羊毛和聚酯纤维都属于高分子化合物
C.羊毛和聚酯纤维都是有机物
D.可以用燃烧的方法区分羊毛和聚酯纤维
4.在社会主义新农村建设中,下列做法对新农村建设有促进作用的是( )
A.为了提高农作物的产量,大量使用农药和化肥
B.积极推广沼气和太阳能的使用
C.随意丢弃使用过的废旧塑料薄膜
D.采用焚烧的方法处理农作物秸秆和垃圾
)
5.根据实验操作规范要求,下列实验操作不正确的是( )
A.过滤
B.加热液体
C.气密性检查
D.稀释浓硫酸
6.分类是学习化学的一种重要科学方法。下列物质分类正确的是( )
A.常见的活泼金属:镁、锌、铜
B.常见的氧化物:水、氧化铜、熟石灰
C.常见的易燃物:汽油、酒精、浓硫酸
D.常见的营养素:糖类、蛋白质、无机盐
7.2010 年 2 月 25 日,元谋-禄丰交界处发生地震。为了防止灾区传染病发生,必须进行环
境消毒。下列关于常用消毒剂的叙述正确的是( )
A.高锰酸钾的化学式:K2MnO4
�
)
)
B.H2O2 中氢元素的质量分数为 11.1%
C.“84 消毒液”的有效成分次氯酸钠(NaClO)中氯元素的化合价为-1 价
D.过氧乙酸的化学式为 C2H4O3,其碳、氢、氧三种元素的质量比为 6:1:12
8.下列物质发生的变化与空气的成分无关的是(
A.钢铁在空气中生锈
B.在晾干的咸菜表面出现食盐晶体
C.熟石灰在空气中 变质
D.浓硫酸敞口放置在空气中质量增重
9.右图是实验室里一瓶标签破损的白色粉末状固体。小明同学取出少量该固体放
入一洁净试管中,加水振荡后固体溶解,形成无色透明溶液,继续加入少一盐酸,
有无色无味的气体产生。该固体可能是(
A.Na2SO4
C.NaHCO3
10.根据复分解反应发生的条件,判断下列各组物质不能发生反应的一组是(
A.Na2CO3 溶液和 CaCl2 溶液
B.NaOH 溶液和盐酸溶液
C.CuSO4 溶液和 BaCl2 溶液
D.K2SO4 溶液和 NaCl 溶液
11.下列化学方程式书写正确的是( )
A.湿法炼铜:Fe+CuSO4=Cu+FeSO4
B.NaCl
D.NaOH
)
B.白磷在空气中燃烧:P+O2
P2O5
C.铁与盐酸反应:2Fe+6HCl=2FeCl3+3H2↑
D.硫酸铜溶液和氢氧化钠溶液反应:CuSO4+NaOH=CuOH↓+NaSO4
12.用右图装置电解水,一段时间后的现象如图所示。对该实验的描述错误的是( )
A.甲试管中收集到的是一种可燃性气体
B.该实验能证明水是由氢元素和氧元素组成网 ZXXK]
C.向水中加入少 量硫酸,能增强水的导电性
D.甲、乙两试管内收集到的气体的质量比约为 8:1
13.下列判断错误的是( )
A.分子间的间隙:水蒸气>冰
C.碳元素的质量分数:C2H4氯化钠溶液
D.一个分子中原子总数:H2O2=NH3
)
A.向硫酸溶液中不断加水
B.一定量的稀硫酸与锌粒反应
C.加热二氧化锰和氯酸钾的混合物
D.向稀 H2SO4 中滴加 BaCl2 溶液
�
15.某同学对下列 4 个实验都设计了两种方案,其中方案一、方案二都合理的是(
)
选项
实验目的
A
B
C
D
除去炭粉中少量
的氧化铜
证明长期露置的
氢氧化钠溶液已
变质
鉴别硫酸钾和硝
酸铵
证明稀醋酸溶液
呈酸性
方案一
方案二
加稀硫酸
高温灼烧
加稀盐酸
看外观
加澄清石灰水
加熟石灰研磨闻
气味
加无色酚酞试液
加氢氧化钠溶液
二.填空与简答题(本大题共 9 个小题,化学方程式每个 2 分,其余每空 1 分,共 40 分)
16.(6 分)(1)用化学符号填空:
①一个氮分子___________;②两个铁原子______________;
③硫 酸铜溶液中的金属离子____________;④标出氧化铁中铁元素的化合价_______;
(2)硫 在空气中燃烧的化学方程式_____________________________________。
16.(1)①N2 ②2Fe③ Cu2+ ④
17.(5 分)下图 A、B 是碳元素和氮元素在元素周期表中的部分信息,C、D 是两种粒子的 结
(2)S+O2
SO2
构示意图。仔细观察,按要求回答下列问题:
(1)碳元素的原子序数是________________。
(2)氮元素的质子数是___________________。
(3)若 D 粒子的化学符号为 O2-,则 X=___________________。
(4)上述四种元素都属于_______________________(填“金属”或“非金属”)元素。
(5)上述四种元素可组成几种常见的化肥,请写出其中一种的化学式________________。
17.(1)6(2)7(3)8(4)非金属(5)NH4HCO3
18.(3 分)小明同学取下列生活中的物质,测得其 pH 如下表所示:
物质
pH
肥皂水
10.2
雨水
5.2
糖水
7.0
柠檬汁
2.5
洗洁精
12.2
由此判断:
(1)酸性最强的物质是__________________________。
(2)能使无色酚酞试液变红色的物质是_______________________(填一种物质即可)。
(3)正常雨水的 pH 约为 5.6。小明生活的环境所降的雨水_____________(填“属于”或“不
属于”)酸雨。
18.(1)柠檬汁(2)肥皂水(或洗洁精)(3)属于
19.(4 分)学习化学能使我们更好地认识生活中的有关现象,更合理地解决实际问题。
(1)铝和铜常用于制造电线,是用到了铝和铜的________________性。
(2)衣服上沾上了较多的油污时,可用汽油洗去的原因是________________________。
(3)防止铁锅生锈的方法是(写一条)______________________________________。
�
(4)25m3 的石油气在加压的情况下可装入容积 0.024m3 的钢瓶中,原因是___________。
19.(1)导电(2)油污 易溶于汽油(3)保持铁锅干燥、清洁(其他合理答案也可)(4)
压强增大时,气体分子间的空隙变得很小(其他合理答案也可)
20.(4 分)如图是甲、乙两种物质的溶解度曲线,回答
下列问题:
(1)从甲物质的溶解度曲线可以得到哪些信息(请写
出其中的一条)___________________________。
( 2 ) t1 ℃ 时 , 甲 、 乙 两 种 物 质 的 溶 解 度 较 大 的 是
___________。
(3)t1℃时,将 20g 甲物质放入 50g 水中,充分搅拌能
否全部溶解____________(填“能”、“不能”或“无法
判断”)。
(4)将一定量 t2℃时甲物质的饱和溶液降温到 t1℃时,该过程中没有发生改变的是
___________(填序号)
A.溶质质量 B.溶液质量 C.溶剂质量 D.溶质的质量分数
20.(1)甲的溶解度随着温度的升高而变大(其他合理答案也可)(2)乙(3)不能(4)C
21.(5 分)下图是用来表示某物质发生化学变化的微观示意图。图中●和○分别表示两种
元素的原 子,仔细观察下图,回答下列问题:
(1)A 物质属于_____________________(填“混合物”、“单质”或“化合物”)。
(2)该反应的反应类型为_________________________。
(3)若 A、B、C 为初中化学中的常见物质,写出符合该反应的化学方程式________________。
(4)根据上述示意图,你能得到哪些化学变化的信息?(请写一条)__________________。
21.(1)单质(2)化合反应(3)2H2+O2=2H2O(4)化学反应前后,元素的种类不变(其他
合理答案也可)
22.(5 分)今年,我国西南地区遭遇了百年不遇的特大旱灾,全国人民众志成城,共抗大
旱。
(1)抗旱首先要节约用水,下列做法与节约用水不相符的是_________(填
序号)
A.农业上推广使用滴灌技术
B.洗衣、洗菜、淘米水用来浇花、拖地、冲厕所
C.任由水龙头漏水而不及时修理
D.关停一些污染大、用水量大、产能低的工厂
(2)人工降雨对抗旱发挥了很大作用。常用的人工降雨剂有碘化银 (AgI)和干冰。碘化
银属于___________________________(填“酸”、“碱”、“盐”或“氧化物”),干冰用于人
工降雨主要是利用干冰升华时会___________________(填“吸收”或“放出”)大量热。
(3)右图是某同学自制的简易净水装置。其中石英砂的作用是_______________,起吸附作
用的是_____________________________。
�
22.(1)C(2)盐 吸收(3)过滤 活性炭
23.(4 分)减少二氧化碳排放,减缓全球气体变暖是当今世界要解决的重大环境问题,这
一问题的解决地人类社会的发展极为重要。
(1)近年来大气中二氧化碳含量不断上升的主要原因是________________________。
(2)下列变化中,对维持大气中二氧化碳气体总量平衡至关重要的是____________(填序
号)
A.CO2+H2O=H2CO3
B.6CO2+6H2O
C6H12O6+6O2
C.CO2+C
2CO
D.CO2+2NaOH=Na2CO3+H2O
(3)科学家采用新技术,将二氧化碳和氢气以一定比例混合,在一定条件下发生了如下反
应:2CO2+6H2=4H2O+X,则 X 的化学式为______________ ______。
(4)为减缓大气中二氧化碳含量的增加,以下建议可行的是_______________(填序号)。
①开发太阳能、水能、风能等新能源;
②禁止使用煤、石油、天然气等化石燃料;
③大力植树造林,禁止乱砍滥伐。
23.(1)大量化石燃烧的使用(2)B(3)C2H4(4)①③
24.(4 分)A、B、C、D、E、F 是初中化学内容所涉及到的物质,其中 A、B 是氧化物,在一
定条件下,它们的转化关系如下图所示:
根据上图推断:
(1)C 的化学式为________________。
(2)D 物质在氧气中燃烧,也能生成 B,则 B 的化学式为______________。
(3)写出 D 与稀硫酸反应的化学方程式________________________________。
24.(1)CO2(2)Fe3O4(3)Fe+H2SO4=FeSO4+H2↑
三.综合题(本大题共 6 个小题,计算题 6 分,化学方程式每个 2 分,其余每空 1 分)
25.(6 分)下图是实验室常用的实验仪器与装置,根据所学化学知识回答下列问题:
(1)写出标号①的仪器名称_____________________。
(2)写出用 A 装置制取氧气的一个化学方程式____________________________。
(3)用 E 装置收集 CO2 时,检验 CO2 是否收集满的方法是_________________________。
(4)常温下,乙炔是一种无色气体,密度比空气略小,难溶于水。实验室常用碳化钙 固体
�
与饱和食盐水反应来制取乙炔。现选择合适的装置来制取并收集乙炔,应该选择的发生装置
是______________(填序号,下同),收集装置是_________________。
2KCl+3O2↑(3)将燃烧着的木条放在集气瓶口(4)B C
25.(1)锥形瓶(2)2KClO3
26.(3 分)正确的实验操作对实验结果很重要。
(1)用高锰酸钾制氧气时,收集到的氧气略显红色,可能的错误操作是____________。
(2)用水将 pH 试纸润湿后,再测某稀盐酸的 pH,结果_________________(填“偏大”、“偏
小”或“无影响”)。
(3)配制溶质质量分数一定的溶液,用量筒量取水时,视线俯视凹液面最低处
(如图所示),所配溶液的溶质质量分数是______________(填“偏大”、“偏小”
或“无影响”)。
26.(1)没有在试管口放一小团棉花(2)偏大(3)偏大
27.(6 分)下图是同学们探究过的三个重要实验,仔细观察,回答下列问题:
(1)图 1 是测定空气中中氧气含量的实验。在实验过程中,观察到红磷燃烧的现象是:剧
烈燃烧、放出大量热和____________________。排除了气密性不好等因素外,过量红磷燃烧
熄灭后集气瓶内__________________(填”“仍有”或“没有”)残余的氧气。
(2)图 2 是燃烧条件的实验探究。①铜片上的白磷燃烧,水中的白磷不燃烧,可得出的燃
烧条件之一是_______________________________;②铜片上的白磷燃烧而红磷不燃烧,可
得出的燃烧条件之一是________________________________。
(3)图 3 是硫酸中和反应的实验探究。某同学在烧杯中加入 10mL 氢氧化钠溶液,用滴管滴
入稀盐酸并不断搅拌,再滴入几滴酚酞试液,溶液呈无色,此时烧杯中的溶质(除酚酞外)
可能有两种情况:
①溶质是_________________________(填化学式,下同);②溶质是_________________。
27.(1)产生浓厚的白烟 没有(2)燃烧时可燃物要与氧气接触 燃烧 时可燃物的温度要达
到它的着火点(3)NaCl
28.(3 分)请从下列物质中选择适当的试剂,设计不同的方法对锌、铁、铜三种金属的活
动性顺序进行探究:A.锌片 B.铁钉 C.铜片 D.硫酸铜 E.稀硫酸 F.硫酸锌 G.硫酸
亚铁。
(1)方法一所选用的三种试剂是 CuSO4、ZnSO4 和___________________(填化学式,下同)。
(2)方法二所选用的是四种试剂是 Fe、Cu、Zn 和___________________。
(3)方法三所选用的三种试剂是_____________________________________。
28.(1)Fe (2)H2SO4 (3)Zn、Cu、FeSO4
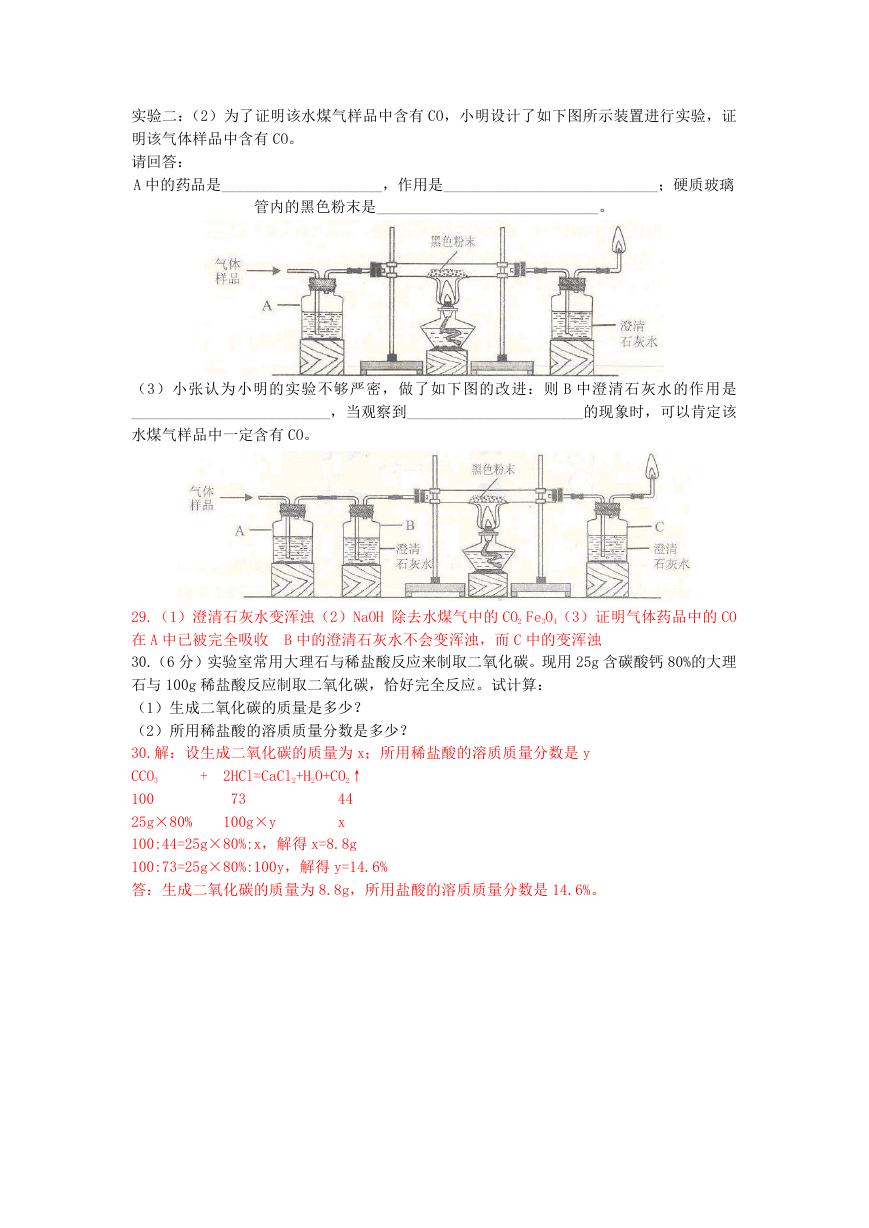
29.(6 分)水煤气是重要的气体燃料,某水煤气样品可能含有 CO2、CO 和 H2,某化学兴趣小
组的同学对该水煤气样品的成分进行探究。
实验一:(1)将该水煤气样品通入澄清石灰水,若看到_____________________,证明该气
体样品中含有 CO2.
NaCl 和 HCl
�
实验二:(2)为了证明该水煤气样品中含有 CO,小明设计了如下图所示装置进行实验,证
明该气体样品中含有 CO。
请回答:
A 中的药品是_____________________,作用是____________________________;硬质玻璃
管内的黑色粉末是_____________________________。
(3)小张认为小明的实验不够严密,做了如下图的改进:则 B 中澄清石灰水的作用是
__________________________,当观察到_______________________的现象时,可以肯定该
水煤气样品中一定含有 CO。
29.(1)澄清石灰水变浑浊(2)NaOH 除去水煤气中的 CO2 Fe3O4(3)证明气体药品中的 CO
在 A 中已被完全吸收 B 中的澄清石灰水不会变浑浊,而 C 中的变浑浊
30.(6 分)实验室常用大理石与稀盐酸反应来制取二氧化碳。现用 25g 含碳酸钙 80%的大理
石与 100g 稀盐酸反应制取二氧化碳,恰好完全反应。试计算:
(1)生成二氧化碳的质量是多少?
(2)所用稀盐酸的溶质质量分数是多少?
30.解:设生成二氧化碳的质量为 x;所用稀盐酸的溶质质量分数是 y
CCO3
100
25g×80%
100:44=25g×80%:x,解得 x=8.8g
100:73=25g×80%:100y,解得 y=14.6%
答:生成二氧化碳的质量为 8.8g,所用盐酸的溶质质量分数是 14.6%。
2HCl=CaCl2+H2O+CO2↑
73
+
100g×y
44
x
�













 2023年江西萍乡中考道德与法治真题及答案.doc
2023年江西萍乡中考道德与法治真题及答案.doc 2012年重庆南川中考生物真题及答案.doc
2012年重庆南川中考生物真题及答案.doc 2013年江西师范大学地理学综合及文艺理论基础考研真题.doc
2013年江西师范大学地理学综合及文艺理论基础考研真题.doc 2020年四川甘孜小升初语文真题及答案I卷.doc
2020年四川甘孜小升初语文真题及答案I卷.doc 2020年注册岩土工程师专业基础考试真题及答案.doc
2020年注册岩土工程师专业基础考试真题及答案.doc 2023-2024学年福建省厦门市九年级上学期数学月考试题及答案.doc
2023-2024学年福建省厦门市九年级上学期数学月考试题及答案.doc 2021-2022学年辽宁省沈阳市大东区九年级上学期语文期末试题及答案.doc
2021-2022学年辽宁省沈阳市大东区九年级上学期语文期末试题及答案.doc 2022-2023学年北京东城区初三第一学期物理期末试卷及答案.doc
2022-2023学年北京东城区初三第一学期物理期末试卷及答案.doc 2018上半年江西教师资格初中地理学科知识与教学能力真题及答案.doc
2018上半年江西教师资格初中地理学科知识与教学能力真题及答案.doc 2012年河北国家公务员申论考试真题及答案-省级.doc
2012年河北国家公务员申论考试真题及答案-省级.doc 2020-2021学年江苏省扬州市江都区邵樊片九年级上学期数学第一次质量检测试题及答案.doc
2020-2021学年江苏省扬州市江都区邵樊片九年级上学期数学第一次质量检测试题及答案.doc 2022下半年黑龙江教师资格证中学综合素质真题及答案.doc
2022下半年黑龙江教师资格证中学综合素质真题及答案.doc