2014 年山东普通高中会考化学考试真题
本试卷分第 I 卷选择题和第 II 卷非选择题两部分,共 8 页。满分 100 分。考试限定用
时 90 分钟。第 I 卷为必做(48 分),第 II 卷为必做部分(36 分)和选做部分(16 分)。答
卷前,考生务必将自己的姓名、考籍号、座号填写在试卷和答题卡规定的位置。考试结束
后,将本试卷和答题卡一并交回。
可能用到的相对原于质量:H l
C 12
N 14
O 16
Mg 24
S 32
Cl 35.5
注意事项:
第 I 卷(选择题 共 48 分)
每小题选出答案后,用 2B 铅笔把答题卡上对应的答案标号( A、B、C、D)涂黑。如需
改动,用橡皮擦干净后,再选涂其它答案标号。不涂在答题卡上,只答在试卷上无效。
一、选择题(本题包括 16 小题,每小题 3 分,共 48 分。每小题只有 1 个选项符合题意)
1.汽车尾气中的污染物除碳氢化合物、可吸入颗粒物、一氧化碳外,还主要含有
A. 氮气
B. 氮氧化物
C. 水蒸气
D.氧气
2.以下是一些常用危险化学品的标志,其中装运浓硫酸的包装箱应贴的图标是
A
B
C
D
3.“嫦娥飞天,玉兔登月”, 实现了中华民族“九天揽月”的伟大梦想。制造登月车太阳
能电池板的半导体材料是
A. 硅
B. 二氧化硅
C. 铝合金
D. 铁合金
4. 13
6 C—NMR(核磁共振)可以用于含碳化合物的结构分析,有关 13
6 C 的说法正确的是
A. 电子数为 13
B. 质子数为 6
C. 中子数为 6
D. 质量
数为 6
5.下列有关煤、石油、天然气等资源的说法中,正确的是
A. 煤是碳单质
B. 石油是纯净物
C. 煤、石油、天然气都是绿色能源
D. 天然气的主要成分是甲烷
6.通常情况下,既能用浓硫酸干燥、又能用碱石灰干燥的是
�
A.HCl
B.Cl2
C.NH3
D.CO
7.区别二氧化硫和二氧化碳气体的最佳方法是
A. 通入澄清石灰水
B.用湿润的蓝色石蕊试纸
C.用品红溶液
D.用氯化钡溶液
8.为了除去 FeCl3 溶液中混有的少量 FeCl2,可以向此溶液中通入氯气。在除去 FeCl2 的反应
中
A.Cl-被氧化
B.Cl2 作还原剂
C.Fe2+被氧化
D. Fe2+被还原
9.设 NA 表示阿伏加德罗常数的值,下列叙述正确的是
A.H2SO4 的摩尔质量是 98g
B.14g N2 的物质的量为 1mol
C.标准状况下,22.4L H2O 所含分子数为 NA
D.常温下,1L 0.1mol/L NaCl 溶液中含 Na+数为 0.1NA
10.下列离子方程式的书写正确的是
A.铜和氯化铁溶液反应:2Fe3+ + Cu =2Fe2+ + Cu2+
B.钠和冷水反应:Na + 2H2O = Na+ + H2↑ + 2OH-
C.大理石和稀盐酸反应:2H+ + CO3
2-= CO2↑+ H2O
D.醋酸和氢氧化钠溶液反应:OH-+ H+= H2O
11.下列有关化学反应速率和限度的说法中,不正确的是
A.双氧水制氧气时加入少量二氧化锰,反应速率明显加快
B.铁粉代替铁钉与稀硫酸反应可以加快制取氢气的速率
C. 2SO2+O2
2SO3 反应中,SO2 的转化率不能达到 100%
D. 2SO2+O2
2SO3 反应达到化学平衡状态时,正、逆反应速率等于零
12.下列装置中能构成原电池的是
A
B
C
D
�
13.下列关于有机物的叙述中不正确的是
A.动物毛发的主要成分是蛋白质
B.苯可以使酸性高锰酸钾溶液褪色
C.乙醇可以与金属钠反应放出氢气
D.乙酸可以与乙醇在一定条件下发生酯化反应
14.有 FeCl2、MgCl2、AlCl3 三种溶液,只用一种试剂就可把它们鉴别开来,这种试剂是
A.烧碱溶液
B.盐酸
C.氨水
D.KSCN 溶液
15.已知同一短周期中 X、Y 两种元素的最高价氧化物对应水化物的酸性强弱为 HXO4>H2YO4,
则下列判断中正确的是
A.元素非金属性 X>Y
B.原子半径 X>Y
C.气体氢化物的稳定性 X<Y
D.单质的氧化性 X<Y
16.下列实验装置或操作不能达到实验目的的是
检查装置
实验室制氨气
用食盐水制
用四氯化碳萃
气密性
A
注意事项:
食盐晶体
取碘水中的碘
B
C
D
第 II 卷(必做 36 分+选做 16 分,共 52 分)
l.第 II 卷共 5 道题。其中 17-20 题为必做部分,21 题为选做部分。
2.第 II 卷所有题目的答案,考生须用 0.5 毫米黑色签字笔答在答题卡上规定的区域内,
在试卷上答题无效。
3.选做部分,考生必须从所给的 6 个模块中选择 1 个作答。模块[A]化学反应原理;模块
[B]化学与生活;模块[C]化学与技术;模块[D]物质结构与性质;模块[E]有机化学基础;
模块[F]实验化学。答题前,请考生务必将所选模块代码用 2B 铅笔涂黑,答完题后,再次
确认所选模块代码。
二、非选择题(本题包括 5 小题,共 52 分)
【必做部分】
�
17.(8 分)甲烷、乙烯、乙醇都是重要的有机化合物。请回答下列问题:
(1)甲烷在光照条件下能与氯气发生反应,其反应类型是
。
(2)把乙烯通入到少量酸性高锰酸钾溶液中,振荡后,可以观察到的现象是
。
(3)把乙烯通入到溴的四氯化碳溶液中,充分振荡,静置,观察到溴的四氯化碳溶液褪色,
写出该过程中发生反应的化学方程式
。
(4)乙醇在催化剂、加热的条件下可以与氧气反应生成
和水。
18.(8 分)(1)取一只盛满 SO2 的试管,将其倒扣在水槽中,静置一段时间,观察到的现
象是
,写出 SO2 与水反应的化学方程式
(2)存放石灰水的瓶子内壁常有一层白色固体,除去该固体的试剂是
。
。
(3)要除去氯化钠固体中的少量氯化铵,最简单的方法是
。
19.(10 分)有 A、B、C 三种短周期元素,原子序数依次增大。A 的单质与 B 的单质能在一
定条件下化合生成一种使湿润的红色石蕊试纸变蓝的气体 X;C 处于第 3 周期,其最高正价
为+7 价。请回答下列问题:
(1)C 的元素符号是
,其原子的最外层电子数为
。
(2)B 的最高价氧化物对应的水化物的化学式为
。
(3)X 所含化学键的类型为
,写出 A 与 B 的单质化合生成 X 的化学方程式
。
20.(10 分)A、B、C 三种物质的转化关系如下图所示,其中 A 是金属单质,B 是一种淡黄
色固体。请回答相关问题:
A
O2,燃烧
①
B
(1)B 的化学式是
H2O
②
。
C
CO2
③
Na2CO3
(2)反应①中还原剂的化学式是
。
(3)反应②、③中属于氧化还原反应的是
(填“②”、“③”或“②③”)。
(4)反应②的化学方程式为
。反应③的离子方程式为
。
【选做部分】
模块[A] 化学反应原理(选修模块)(共 16 分)
21.(16 分)请按要求完成下列各小题:
�
(1)在一个容积为 2L 的密闭容器中,充入 2mol A 和 1mol B,发生如下反应:
2A(g) + B(g)
3C(g) + D(s)
2min 时反应达到平衡,此时 C 的浓度为 1.2 mol·L-1。
①2 min 内 B 的平均反应速率为
。
②若将容器体积缩小至 1L,反应达到平衡时 C 的浓度为
mol·L-1,该反应的
平衡常数
(填“增大”、“减小”或“不变”)。
(2)已知某溶液中只存在 OH-、H+、NH4
+、Cl-四种离子,某同学推测该溶液中各离子浓度
大小顺序可能有如下四种关系:
a.c(Cl-)> c(NH4
+)> c(H+)> c(OH-)
b. c(Cl-)> c(NH4
+)> c(OH-)>c(H+)
c.
c(Cl-)> c(H+)> c(NH4
+)> c(OH-)
d. c(NH4
+)> c(Cl-)> c(OH-)> c(H+)
若溶液中只溶解一种物质,该物质为______,上述离子
浓度关系大小顺序正确的是
(填编号)。
(3)氢氧燃料电池的反应原理示意图如右图所示。
①该电池中电极 b 是
(填“正极”或
“负极”),发生
(填“氧化”或“还原”)
反应;
②该电池的总反应为
。
模块[B] 化学与生活(选修模块)(共 16 分)
21.(16 分)化学与人类生活密切相关。
(1)请按要求完成下列各问题:
①下列三种物质中,富含淀粉的是
(填编号,下同),富含蛋白质的是
;
a.大米
b.黄瓜
c.牛奶
②下列三种物质中,属于高分子化合物的是
,在一定条件下能水解的是
。
a.葡萄糖
b.油脂
c.蛋白质
(2)近年来,全国多个省市出现严重的雾霾天气,严重危害人们的健康。导致雾霾形成的
主要污染物是
。
a.O2
b.CO2
c.PM2.5
�
(3)材料的不断发展可以促进社会进步。
①“玉兔号”月球车开创了我国月球表面探索的先河,其制备材料中使用了镁铝合金。
镁铝合金的优点是
;
a.强度大
b.密度大
c.绝缘性好
d.耐腐蚀
②生产玻璃时,纯碱与石英砂在高温下发生反应的化学方程式为
,碳化硅硬
度很大,它属于
。
a.金属材料
b.无机非金属材料
c.有机高分子材料
模块[C] 化学与技术(选修模块)(共 16 分)
21.(16 分)海水是名符其实的液体矿藏,从海水中综合提取各种物质的生产过程叫做海水
的综合利用。请按要求回答下列问题:
(1)下列四种生产过程中,其原理可能不涉及化学变化的是
(填编号)。
a.利用海水生产烧碱
b.利用海水生产金属镁
c.利用海水生产原盐
d.利用海水生产液溴
(2)右图所示为电解饱和食盐水的装置。图中 e 为
饱和食盐水,由原盐获得饱和食盐水的过程中需使
用①氯化钡溶液、②稀盐酸、③氢氧化钠溶液、
④碳酸钠溶液,这四种溶液的使用顺序是下列各项
中的
(填编号)。
a.④①③②
b.①④③②
c.④②①③
d.③④①②
右图中电极 1 为
(填“阳”或“阴”)极,该电极上析出的气体 b 是
,d
为某种产品的浓溶液,写出该产品的化学式
。
(3)苦卤是海水制盐工业的副产物,其中含有高浓度的镁离子和溴离子。工业上是从苦卤
中获得无水氯化镁,再通过电解法生产金属镁,请写出该电解过程的化学方程式
,工业上从苦卤中提溴的一种工艺是向苦卤中通入氯气获得单质溴,请写出该过
程的离子方程式
。
(4)海水淡化技术已发展成为产业。人们最早使用的海水淡化方法是
(填编号)。
a.电渗析法
b.反渗透法
c.冷冻法
d.蒸馏法
模块[D] 物质结构与性质(选修模块)(共 16 分)
�
21. (16 分)氮及其化合物在生活、生产和科技等方面有重要的应用。请回答下列问题:
(1)氮元素基态原子的价电子排布式为
。
(2)在氮气分子中,氮原子之间存在着
个σ键和
个π键。
(3)氮、氧、氟是同周期相邻的三种元素,比较:
①氮原子的第一电离能
(填“大于”、“小于”或“等于”)氧原子的第一电
离能;
②元素的电负性 F
O(填“大于”、“小于”或“等于”)。
(4)氨气分子中氮原子轨道的杂化类型是
,NH3 是一种易液化的气体,该气体
易液化的主要原因是
。
(5)配合物[Cu(NH3)4]Cl2 中含有
个配位键。
模块[E] 有机化学基础(选修模块)(共 16 分)
21.(16 分)对甲基苯甲酸乙酯(D)是有机化工原料,可作为合成药物的中间体,可以用
下图所示流程进行合成:
请回答下列问题:
(1)A 的结构简式是
,C 中含氧官能团的名称是
。
(2)指出化学反应类型:①
;②
。
(3)写出反应③的化学方程式
。
(4)丁子香酚(
)是一种重要的调味剂,它与 D 的关系是
(填编号)。
a.同系物
b.同分异构体
c.同种物质
(5)下列物质在通常状况下不能与丁子香酚发生反应的是
(填编号);能与对甲基
苯甲酸乙酯反应的是
(填编号)。
a.NaOH 溶液
b.酸性 KMnO4 溶液
c.乙醇
模块[F] 实验化学(选修模块)(共 16 分)
�
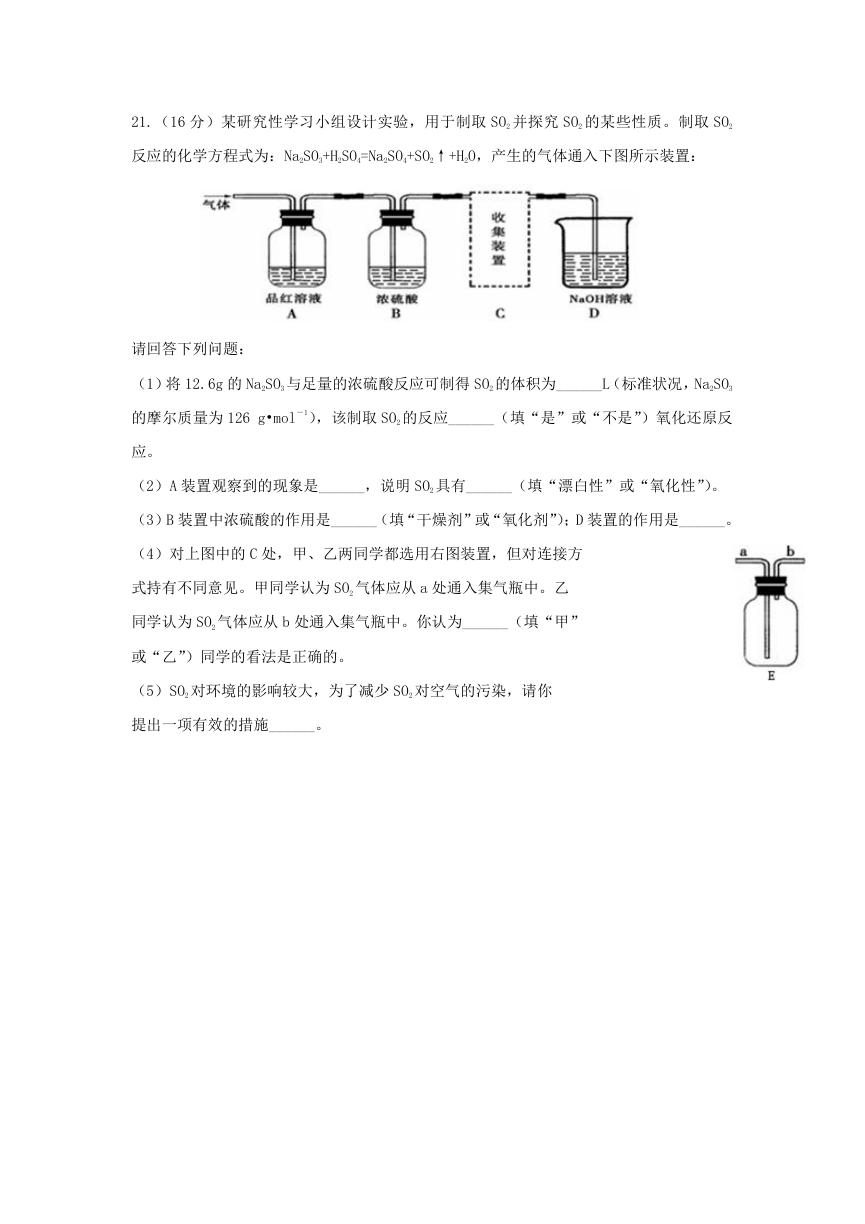
21.(16 分)某研究性学习小组设计实验,用于制取 SO2 并探究 SO2 的某些性质。制取 SO2
反应的化学方程式为:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O,产生的气体通入下图所示装置:
请回答下列问题:
(1)将 12.6g 的 Na2SO3 与足量的浓硫酸反应可制得 SO2 的体积为______L(标准状况,Na2SO3
的摩尔质量为 126 g•mol-1),该制取 SO2 的反应______(填“是”或“不是”)氧化还原反
应。
(2)A 装置观察到的现象是______,说明 SO2 具有______(填“漂白性”或“氧化性”)。
(3)B 装置中浓硫酸的作用是______(填“干燥剂”或“氧化剂”);D 装置的作用是______。
(4)对上图中的 C 处,甲、乙两同学都选用右图装置,但对连接方
式持有不同意见。甲同学认为 SO2 气体应从 a 处通入集气瓶中。乙
同学认为 SO2 气体应从 b 处通入集气瓶中。你认为______(填“甲”
或“乙”)同学的看法是正确的。
(5)SO2 对环境的影响较大,为了减少 SO2 对空气的污染,请你
提出一项有效的措施______。
�














 2023年江西萍乡中考道德与法治真题及答案.doc
2023年江西萍乡中考道德与法治真题及答案.doc 2012年重庆南川中考生物真题及答案.doc
2012年重庆南川中考生物真题及答案.doc 2013年江西师范大学地理学综合及文艺理论基础考研真题.doc
2013年江西师范大学地理学综合及文艺理论基础考研真题.doc 2020年四川甘孜小升初语文真题及答案I卷.doc
2020年四川甘孜小升初语文真题及答案I卷.doc 2020年注册岩土工程师专业基础考试真题及答案.doc
2020年注册岩土工程师专业基础考试真题及答案.doc 2023-2024学年福建省厦门市九年级上学期数学月考试题及答案.doc
2023-2024学年福建省厦门市九年级上学期数学月考试题及答案.doc 2021-2022学年辽宁省沈阳市大东区九年级上学期语文期末试题及答案.doc
2021-2022学年辽宁省沈阳市大东区九年级上学期语文期末试题及答案.doc 2022-2023学年北京东城区初三第一学期物理期末试卷及答案.doc
2022-2023学年北京东城区初三第一学期物理期末试卷及答案.doc 2018上半年江西教师资格初中地理学科知识与教学能力真题及答案.doc
2018上半年江西教师资格初中地理学科知识与教学能力真题及答案.doc 2012年河北国家公务员申论考试真题及答案-省级.doc
2012年河北国家公务员申论考试真题及答案-省级.doc 2020-2021学年江苏省扬州市江都区邵樊片九年级上学期数学第一次质量检测试题及答案.doc
2020-2021学年江苏省扬州市江都区邵樊片九年级上学期数学第一次质量检测试题及答案.doc 2022下半年黑龙江教师资格证中学综合素质真题及答案.doc
2022下半年黑龙江教师资格证中学综合素质真题及答案.doc