2021-2022 年辽宁省朝阳市凌源市高一化学上学期期末试卷
及答案
可能用到的相对原子质量:H1
Zn65
一、选择题:在每小题给出的四个选项中,只有一项是符合题目要求的。
B11 O16
Cl35.5
Na23
S32
Cu64
1. 硫代硫酸钠晶体(
Na S O 5H O
2 2
3
2
A. 属于混合物
C. 属于硫酸盐
【答案】B
2. 下列不属于分散系的是
)可用作定影剂、还原剂。有关其分类的判断正确的是
B. 属于钠盐
D. 属于酸
A. 纯碱
B. 雾
C. 食盐水
D. 豆浆
【答案】A
3. 当光束通过下列物质时,会出现丁达尔效应的是
①CuSO4 溶液 ②Fe(OH)3 胶体 ③蔗糖溶液 ④云、雾 ⑤水
A. ①③
B. ②③
C. ②④
D. ④⑤
【答案】C
4. 催雨剂的主要成分可以是干冰、液氮、碘化银(AgI)等,它们分别属于氧化物、单质、盐,
下列物质与上述三种物质的类别完全不同的是
A.
2I
B.
K SO
2
4
C.
5P O
2
D.
HNO
3
【答案】D
5. 下列物质常用作还原剂的是
A. KI
B.
2Cl
C.
HNO
3
D.
2
Na CO
3
【答案】A
6. 下列叙述中,正确的是
A. NaNO3 固体不导电,所以 NaNO3 不是电解质
B. 铜丝、石墨均能导电,所以它们都是电解质
C. SO2 溶于水能导电,所以 SO2 是电解质
D. 熔融的 KCl 能导电,所以 KCl 是电解质
【答案】D
�
7. 物质分类及反应类型示意图错误的是
A.
C.
B.
D.
【答案】A
8. 下列有关说法正确的是
A. 溶液、胶体和浊液的本质区别是丁达尔效应
B. “冰水混合物”是一种分散系
C. 分散系有的是纯净物,有的是混合物
D. 按分散质和分散剂所处的状态,分散系的组合可能有 9 种方式
【答案】D
9. 下列各组中的离子能在溶液中大量共存的是
A.
C.
+Na 、 +
4NH 、 3NO 、 Cl
+H 、 +Na 、 3NO 、 O H
B.
+H 、 +
4NH 、Cl 、 2
3CO
D.
+K 、 2+Mg 、 2
4SO 、 O H
【答案】A
10. 下列关于酸、碱、盐的各种说法中正确的是(
A. 电离出的阳离子有 H+的化合物叫酸,电离出 OH-的化合物叫碱
B. 氯化钠溶液在电流的作用下电离出 Na+和 Cl-
)
C. 化合物电离时,生成金属阳离子(或铵根离子)和酸根阴离子的是盐
D. NaHSO4 可以电离出 H+,因此 NaHSO4 属于酸
【答案】C
11. 下列各组物质能发生化学反应,且有沉淀生成的是
A. 向澄清石灰水中加入 2
K CO 溶液
3
B. 向 NaCl 溶液中加入
KNO 溶液
3
�
C. 向 2
D. 向
4
H SO 溶液中加入 NaOH 溶液
CaCl 溶液中通入 2CO
2
【答案】A
12. 下列反应不能发生的是
CaCO 2CH COOH= CH COO Ca H O CO
2
3
3
2
2
MgCl
2
2NaOH=Mg OH
2NaCl
3
2
HNO
3
A.
B.
C.
D.
AgNO HCl=AgCl
3
2HCl Cu=CuCl H
2
2
【答案】D
13. 下列各组中物质间的反应,不能..用同一离子方程式来表示的是
A. 盐酸与碳酸钠溶液;稀硫酸与碳酸钾溶液
B. 硫酸铜溶液与氢氧化钠溶液;硫酸铜与氢氧化钡溶液
C. 铁与盐酸;铁与稀硫酸
D. 氢氧化钾溶液与稀硫酸;氢氧化钾溶液与稀硝酸
【答案】B
14. 铁、稀盐酸、澄清石灰水、氯化铜溶液是中学化学中常见物质,四种物质间的反应关系
如图所示。图中两圆相交部分(A、B、C、D)表示物质间的反应,其中对应的离子方程式书
写正确的是
A. OH−+HCl=H2O+Cl−
C. Fe+Cu2+=Cu+Fe2+
【答案】C
15. 某化学兴趣小组欲研究 H2SO4、NaCl、KCl、Na2CO3、FeCl3、NaOH 的性质,对于如何研究,
B. Ca(OH)2+Cu2+=Ca2++Cu(OH)2
D. Fe+2H+=Fe3++H2↑
他们设计了两种实验方案。
方案①:将它们按照酸、碱、盐分类,然后分别溶于水得到溶液,进行实验;
方案②:将它们按照钠盐、钾盐、铁盐和其他化合物分类,然后分别溶于水得到溶液,进行
实验。
下列说法正确的是
A. 常温时,将少量铜粉分别投入上述溶液中,按照方案①的分类,能够完全溶解铜粉的只
�
有酸(稀硫酸)溶液
B. 取某种溶液,在其中加入上述方案②中的钾盐溶液,有白色沉淀产生,再加入稀硝酸,
沉淀不消失,则该溶液中含有 Ag+
C. 按照方案①的分类,属于碱的有 Na2CO3、NaOH
D. 按照方案②的分类,属于钠盐的有 NaCl、Na2CO3、NaOH
【答案】B
16. 下列反应属于氧化还原反应,但水既不作氧化剂也不作还原剂的是
3Fe 4H O(g)
2
高温
Fe O 4H
3
4
2
4Fe(OH)
2H O O =4Fe(OH)
3
2
2
2
2H O=4HF O
2F g
2
2
2
2Na 2H O 2NaOH H
2
2
A.
B.
C.
D.
【答案】B
17. 从海水中提取溴有如下反应:
5NaBr NaBrO 3H SO 3Br
2
=
3
2
4
下列与该反应在氧化还原反应原理上最相似的是
3Na SO 3H O
2
4
2
。
A.
3Cl
2FeBr
2
2Br
2
CO Na CO H O=2NaHCO
3
=
2FeCl
3
2
3
2
2
2H S SO =2H O 3S
2
C.
2
2
2
B.
D.
2FeCl Cl =2FeCl
2
2
3
【答案】C
18. 下列离子方程式书写正确的是
A. 向
Ba OH 溶液中滴加
4
2OH 2H SO BaSO
=
2
4
2
Ba
2
B. 向澄清石灰水中加入过量
NaHSO 溶液至中性:
H
2 O
4
2
NaHCO 溶液:
3
HCO Ca
3
2
OH CaCO
=
H
O
2
3
2Cl H O
2
C. 铜片加入
AgNO 溶液中:
3
Cu Ag A= g Cu
2
D. 氧化亚铁悬浊液中加入稀盐酸:
FeO 2HCl=Fe
2
【答案】A
19. 下列叙述正确的是
A. 含最高价元素的化合物均具有强氧化性
B. 原子失电子数越多还原性越强
C. 失电子能力弱的物质得电子能力一定强
D. 强氧化剂和强还原剂混合不一定发生氧化还原反应
�
【答案】D
20. 图中相连的物质间在一定条件下可以反应,“→”表示丁在一定条件下可以转化为乙。下
面四组选项中,符合图示要求的是(
)
甲
乙
丙
丁
A
B
C
D
H2SO4
Na2SO4
NaOH
NaCl
KCl
K2CO3
O2
Fe
CO
CuCl2
KOH
CuO
Ag
HCl
C
HCl
B. B
C. C
A. A
【答案】C
21. 被称为万能还原剂的 NaBH4(NaBH4 中 H 为﹣1 价)能溶于水并和水反应,有如下反应
NaBH4+2H2O=NaBO2+4H2↑,下列有关该反应的说法中,正确的是( )
A. NaBH4 既是氧化剂又是还原剂
B. NaBH4 是氧化剂,H2O 是还原剂
D. D
C. 硼元素被氧化,氢元素被还原
D. 被氧化的元素与被还原的元素质量比为 1:1
【答案】D
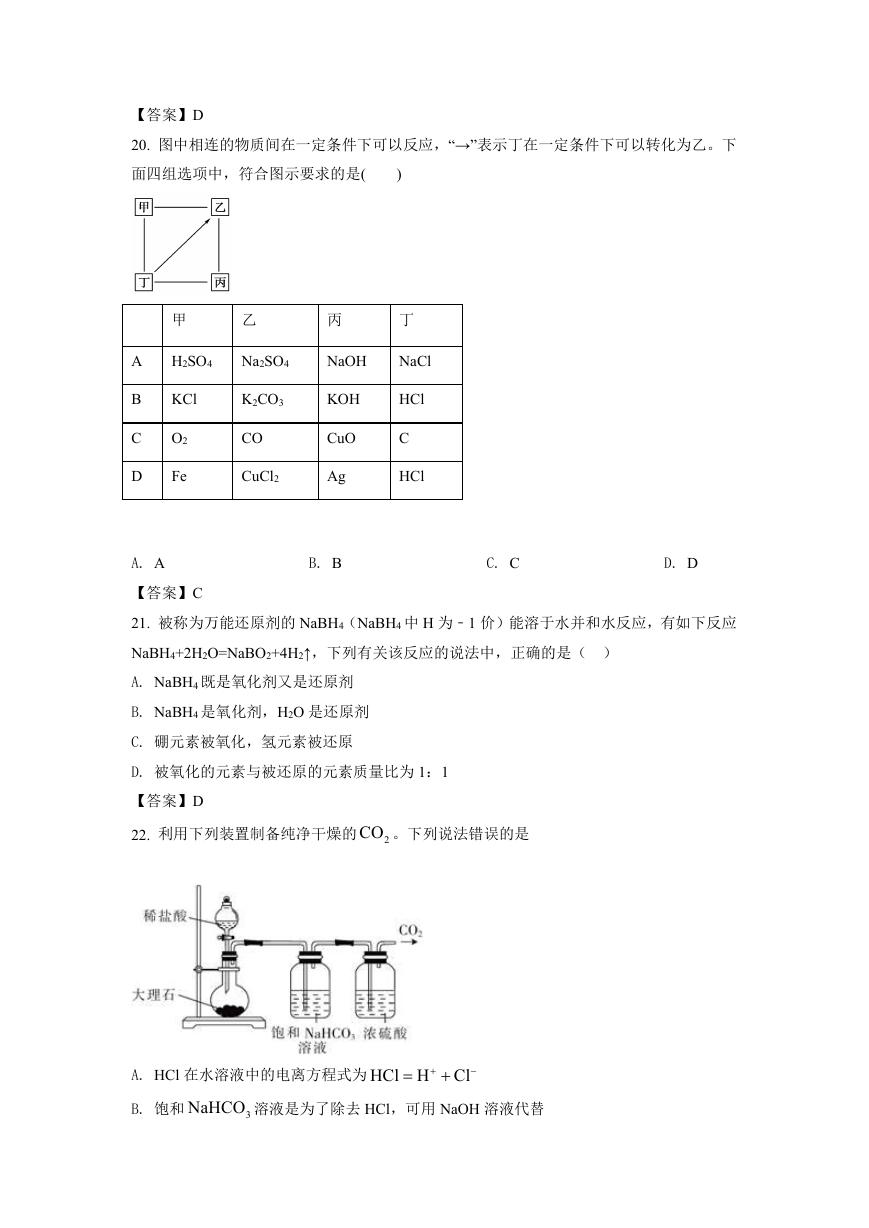
22. 利用下列装置制备纯净干燥的 2CO 。下列说法错误的是
A. HCl 在水溶液中的电离方程式为 HCl H Cl
B. 饱和
NaHCO 溶液是为了除去 HCl,可用 NaOH 溶液代替
3
�
C. 大理石与稀盐酸反应的离子方程式为
CaCO 2H
3
Ca
2
CO
H O
2
2
D.
NaHCO 溶液与盐酸反应的离子方程式为
3
HCO H
3
CO
2
H O
2
【答案】B
23. 航母的船底涂有含 2Cu O 的防污涂料,制备 2Cu O 的一种方法为
Zn 2CuSO 2NaOH=Cu O
ZnSO Na SO H O
4
2
4
2
4
2
。该反应中氧化剂与氧化产物
的质量之比为
C. 320:161
D. 161:
B. 1:2
A. 2:1
320
【答案】C
24. 根据下列反应判断有关物质还原性由强到弱的顺序是
H2SO3+I2+H2O=2HI+H2SO4
2FeCl3+2HI=2FeCl2+2HCl+I2
3FeCl2+4HNO3=2FeCl3+NO↑+2H2O+Fe(NO3)3
A. H2SO3>Iˉ>Fe2+>NO
C. Fe2+>Iˉ>H2SO3>NO
【答案】A
25. 在两份相同的
Ba OH 溶液中,分别滴入 2
H SO 、
2
4
B. Iˉ>Fe2+>H2SO3>NO
D. NO>Fe2+>H2SO3>Iˉ
NaHSO 溶液,其导电能力随滴入
4
溶液的体积变化的曲线如图所示。下列分析正确的是
A. ②代表滴加 2
H SO 溶液的变化曲线
4
B. b 点溶液中大量存在的离子是 2
4SO 、 Na 、 O H
C. a、d 两点对应的溶液均显中性
D. 开始阶段溶液的导电能力下降,说明生成的
BaSO 不是电解质
4
【答案】C
二、非选择题
26. 对牙膏中物质的探究要用到许多化学知识。回答下列问题:
(1)表中列出了三种牙膏中的摩擦剂,在表中填写三种摩擦剂所属的物质类别(填
“酸”“碱”“盐”“酸性氧化物”或“碱性氧化物”)。
�
牙膏
摩擦剂
两面针牙膏 佳洁士牙膏
中华牙膏
氧化镁(MgO) 碳酸钙(
CaCO ) 二氧化硅(
3
2SiO )
摩擦剂的物质类别 _______
_______
_______
(2)根据所学知识推断,牙膏摩擦剂的溶解性是_______(填“易溶”或“难溶”)。
(3)牙膏中的摩擦剂碳酸钙可以用石灰石(碳酸钙的质量分数为 80%)来制备。某学生设计
了一种实验室制备碳酸钙的实验方案,其流程如图:
①高温
石灰石
M
①M 的化学式为_______。
石灰乳
③加碳酸钠溶液 碳酸钙
②加水
②写出步骤③的离子方程式:_______。
【答案】(1)
①. 碱性氧化物
②. 盐
③. 酸性氧化物
=
2
3
2
Ca OH
(2)难溶
(3)
①. CaO
②.
CO CaCO 2OH
3
27. FeCl3 是中学实验室常用的试剂。
(1)写出氯化铁在水中的电离方程式:_________。
(2)利用氯化铁溶液制备氢氧化铁胶体。
①下列制备氢氧化铁胶体的操作方法正确的是_______(填字母)。
A.向饱和氯化铁溶液中滴加适量的氢氧化钠稀溶液
B.加热煮沸氯化铁饱和溶液
C.在氨水中滴加氯化铁浓溶液
D.在沸水中滴加饱和氯化铁溶液,煮沸至出现红褐色液体
②区别氯化铁溶液和氢氧化铁胶体的方法是___________。
(3)为了探究离子反应的本质,设计如下实验:
①写出生成 A 的离子方程式:_________。
②上述流程中,加入足量稀硝酸的目的是________。如何判定无色溶液 B 与稀硝酸发生了
离子反应?________。
【答案】 ①. FeCl3=Fe3++3Cl-
②. D
的是氢氧化铁胶体(或其他合理答案)
③. 做丁达尔效应实验,能产生丁达尔现象
⑤. 中和过量的
④. Fe3++3OH-=Fe(OH)3↓
�
⑥. 溶液 B 由红色变成无色
NaOH
28. 《南村辍耕录》中记载:“杭人削松木为小片,其薄如纸,熔硫黄涂木片顶分许,名曰
发烛,又日粹儿。盖以发火及代灯烛用也。”《资治通鉴》中记载:“陈宣帝太建九年,齐后
K Cr O 是火柴工业用作制造火柴
妃贫苦,至以卖烛为业。”文中的发烛就是原始的火柴。 2
2
7
头的氧化剂。分析反应:
题:
K Cr O +14HCl 浓 =2KCl+2CrCl +3Cl↑+7H O ;回答下列问
2
2 7
3
2
2
(1)反应中_______元素被氧化,_______是氧化剂。
(2)反应中_______是氧化产物,_______发生氧化反应。
(3)在参加反应的盐酸中,起还原剂(被氧化)作用的 HCl 与起酸性作用的 HCl 的质量比为
_______。
(4)用双线桥标出反应中电子转移的方向和数目:_______。
K Cr O
2
2
7
【答案】(1)
①. 氯
②.
(2)
①.
2Cl
②. HCl
(3)3:4
(4)
2
29.
HNO 是一种弱酸,且不稳定,易分解生成 NO 和 2NO 它能被常见的强氧化剂氧化;
AgNO 是一种难溶于水、易
在酸性溶液中它也是一种氧化剂,如能把 2Fe 氧化成 3Fe 。
2
溶于酸的化合物。回答下列问题:
(1)人体正常的血红蛋白中含有 2Fe 。若误食亚硝酸盐(如
的 2Fe 转化为 3Fe 而中毒,服用维生素 C 可解毒。下列叙述错误的是_______(填标号)。
A. 中毒过程中血红蛋白中的 2Fe 被氧化
B. 解毒过程中维生素 C 是还原剂
NaNO ),则导致血红蛋白中
2
C. 中毒过程中亚硝酸盐是还原剂
D. 解毒过程中维生素 C 将 3Fe 还原为 2Fe
(2)下列方法不能用来鉴别
NaNO 溶液(呈弱碱性)和 NaCl 溶液的是_______(填标号)。
2
A. 测定这两种溶液的 pH
B. 用 AgNO3 溶液和稀硝酸来鉴别
C. 用稀硫酸酸化的 KI-淀粉溶液来鉴别
D. 用甲基橙溶液(pH 变色范围:3.1~4.4)来鉴别
(3)某同学把新制的氯水加到
NaNO 溶液中,观察到氯水褪色,反应的离子方程式为
2
�















 2023年江西萍乡中考道德与法治真题及答案.doc
2023年江西萍乡中考道德与法治真题及答案.doc 2012年重庆南川中考生物真题及答案.doc
2012年重庆南川中考生物真题及答案.doc 2013年江西师范大学地理学综合及文艺理论基础考研真题.doc
2013年江西师范大学地理学综合及文艺理论基础考研真题.doc 2020年四川甘孜小升初语文真题及答案I卷.doc
2020年四川甘孜小升初语文真题及答案I卷.doc 2020年注册岩土工程师专业基础考试真题及答案.doc
2020年注册岩土工程师专业基础考试真题及答案.doc 2023-2024学年福建省厦门市九年级上学期数学月考试题及答案.doc
2023-2024学年福建省厦门市九年级上学期数学月考试题及答案.doc 2021-2022学年辽宁省沈阳市大东区九年级上学期语文期末试题及答案.doc
2021-2022学年辽宁省沈阳市大东区九年级上学期语文期末试题及答案.doc 2022-2023学年北京东城区初三第一学期物理期末试卷及答案.doc
2022-2023学年北京东城区初三第一学期物理期末试卷及答案.doc 2018上半年江西教师资格初中地理学科知识与教学能力真题及答案.doc
2018上半年江西教师资格初中地理学科知识与教学能力真题及答案.doc 2012年河北国家公务员申论考试真题及答案-省级.doc
2012年河北国家公务员申论考试真题及答案-省级.doc 2020-2021学年江苏省扬州市江都区邵樊片九年级上学期数学第一次质量检测试题及答案.doc
2020-2021学年江苏省扬州市江都区邵樊片九年级上学期数学第一次质量检测试题及答案.doc 2022下半年黑龙江教师资格证中学综合素质真题及答案.doc
2022下半年黑龙江教师资格证中学综合素质真题及答案.doc