2010 年福建省南平市中考化学真题及答案
(满分:100 分;考试时间:60 分钟)
★友情提示:1、所有答案都必须填在答题卡相应的位置上,答在本试卷上一律无效。
2、可能用到的相对原子质量: H—1
O—16
C—12
Zn—65
一.选择与判断(本题 10 小题,共 30 分,每题仅一个正确选项,请在答题卡选择题栏内用 2B
铅笔将正确答案选项涂黑)
1.“东方之冠”的主体结构为四根巨型钢筋混凝土制成的核心筒。
其中钢属于
A.金属材料
C.无机非金属材料
B.合成材料
D.复合材料
2.钾肥能增强植物抗病虫害和抗倒伏能力,下列属于钾肥的是
A.(NH4)2SO4
B.Ca3(PO4)2
C.K2CO3
D.NH4H2PO4
3.下列诗句能用分子运动观点解释的是
A.清明时节雨.纷纷
C.平沙.莽莽黄入天
B.踏花归去马蹄香.
D.纷纷暮雪.下辕门
4.中国航天馆使用的聚氯乙烯膜表面涂有一层二氧化钛(TiO2)光触媒涂层,具有抗污、吸收
紫外光和净化空气的作用。TiO2 中 Ti 的化合价为
A.-2
B.+ 1
C.+ 2
D.+ 4
5.下列对应关系错误..的是
A.干冰——用于人工降雨
B.氮气——供给呼吸
C.铜丝——作导线
6.下列说法正确的是
D.生石灰——作干燥剂
A.新鲜的水果富含维生素
B.凡是盐都能作调味品
C.碘是“智慧元素”摄入越多越好
D.霉变的大米洗净煮熟后可食用
7.正确的操作是实验成功的保证。下列操作正确的是
A
B
C
D
8.下列化学用语书写错误..的是
A.五氧化二磷—— 5O2P
C.钠离子—— Na+
9.从右图获得的信息中错误..的是
A.空气是一种混合物
B.氢原子—— H
D.一氧化碳分子—— CO
�
B.该过程发生物理变化
C.分子大小发生了改变
D.氧气由氧分子构成
10.适量补充 DHA(化学式为 C22H32O2)有助于防止婴幼儿脑发育不正常。下列有关 DHA 的说法
9
F
氟
19.00
中正确的是
A.DHA 属于氧化物
B.DHA 由碳、氢、氧三种元素组成
C.DHA 中碳、氢、氧三种元素的质量比为 22∶32∶2
D.一个 DHA 分子由 22 个碳原子、32 个氢原子和 1 个氧分子构成
二.填空与简答(本题 6 小题,共 41 分)
11.(4 分)火山灰中含有高浓度的氟。右图是元素周期表中氟元素的信息示意图。
(1)氟原子的质子数是
。
(2)氟元素属于
(填“金属”或“非金属”)元素。
12.(6 分)回答下列有关野炊的问题。
(1)生火方法如右图所示,先将纸张点燃,再用燃着的纸张
引燃枯柴,说明纸张的着火点
(填“高于”或
“低于”)枯柴的着火点。
(2)枯柴架空燃烧旺,紧密堆放燃烧不旺,甚至会熄灭,说明
燃烧需要
。
(3)野炊结束后,为防止死灰复燃发生火灾,可采用的灭火
方法是
。
13.(6 分)2010 年“世界水日”的主题是“清洁用水、健康世界”。
(1)右图显示了自然界中水的循环,下列说法中不正确...的
是
(填序号,下同)。
A.水循环是通过水的三态变化实现的
B.太阳为水循环提供了能量
C.垃圾随意丢弃不会造成水污染
(2)某干旱地区打井取水,用井水洗衣服时发现产生泡沫少,且有白色垢状物,则该
井水是
(填“硬水”或“软水”)。
(3)洪涝灾区为防止疾病传染,河水需处理后方可饮用。净水的常见方法有:①过滤
②自然沉降 ③消毒 ④加热煮沸。合理的净水顺序是
。
14.(12 分)(1)右图是布鲁塞尔世博会标志建筑——原子球馆,它是
由 9 个铝质大圆球组成,至今保存完好。铝不易锈蚀的主要原因
�
是
(填序号)。
A.铝不会与酸反应
B.铝不会与空气中的氧气反应
C.铝表面的氧化膜具有保护作用
(2)工业炼镁的原理:氯化镁(MgCl2)在通电条件下生成镁和氯气(Cl2),反应的化学方
程式为
;基本反应类型是
反应。
(3)泡沫铁粉可用于食品保鲜的原理是:铁生锈时能吸收
和
,使食
品保持干燥并防止氧化变质。颗粒大小达到纳米级的单质铁在空气中受撞击时,燃烧
生成四氧化三铁,反应的化学方程式为
。
15.(8 分)(1)检测工业废水的酸碱度,可采用的试剂是
(填序号)。
A.PH 试纸
B.无色酚酞试液
C. 紫色石蕊试液
(2)氢氧化钠固体不仅易潮解,还会吸收空气中的
而变质,应密封保存。
(3)金属 R 与氯化铜溶液反应的化学方程式为:R+ CuCl2 = RClx + Cu,则 x值为
;
R 在金属活动性顺序表中排在铜的
(填“前面”或“后面”)。
16.(5 分)下表是硝酸钾在不同温度时的溶解度。
温度/℃
0
20
40
溶解度/g
13.3
31.6
63.9
60
110
80
169
(1)根据上表数据,在右图中绘制硝酸钾的溶解度曲线。
(2)20℃时将 40g 硝酸钾放入 100 g 水中,充分搅拌,所得溶液
是
(填“饱和”或“不饱和”)溶液。
(3)现有 60℃时接近饱和的硝酸钾溶液,要使它变成饱和溶液,
可采用的方法是
(写出一种即可)。
三.实验与探究(本题 1 小题,共 19 分)
17.(19 分)实验探究是化学的灵魂,请你参与实验室制取氧气和二氧化碳的探究活动。
Ⅰ.制取氧气方法的分析
A
(1)写出 A、B 装置中标号仪器名称:①
(2)写出一个用 A 或 B 装置制取氧气的化学方程式
(3)若用 B 装置制取一瓶氧气,验满的方法是
B
;②
。
。
。
(4)上述两种方法中,更符合“低碳”理念的是
(填“A”或“B”)。
Ⅱ.制取二氧化碳原料的选择
(1)实验室常用大理石或石灰石(主要成分 CaCO3)与稀盐酸反应制取二氧化碳,反应的
�
化学方程式为
。
(2)实验过程中,同学们提出了下列问题并在老师指导下进行实验。
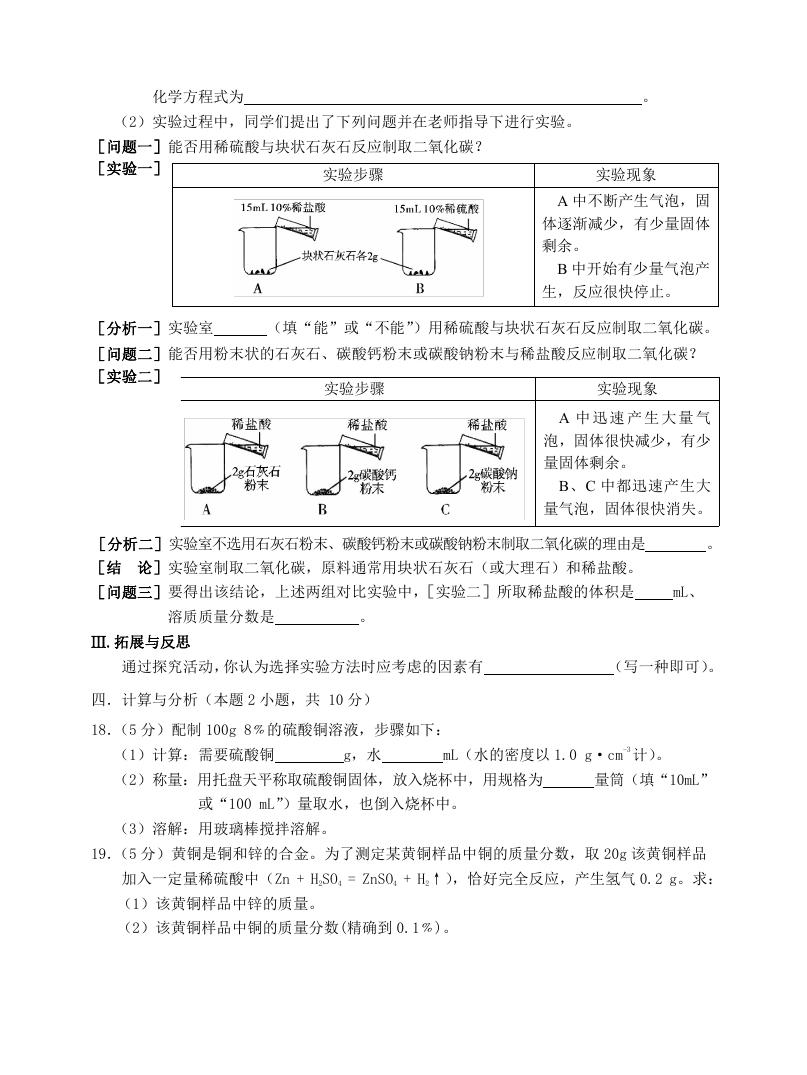
[问题一]能否用稀硫酸与块状石灰石反应制取二氧化碳?
[实验一]
实验步骤
实验现象
A 中不断产生气泡,固
体逐渐减少,有少量固体
剩余。
B 中开始有少量气泡产
生,反应很快停止。
[分析一]实验室
(填“能”或“不能”)用稀硫酸与块状石灰石反应制取二氧化碳。
[问题二]能否用粉末状的石灰石、碳酸钙粉末或碳酸钠粉末与稀盐酸反应制取二氧化碳?
[实验二]
实验步骤
实验现象
A 中 迅 速 产 生 大 量 气
泡,固体很快减少,有少
量固体剩余。
B、C 中都迅速产生大
量气泡,固体很快消失。
[分析二]实验室不选用石灰石粉末、碳酸钙粉末或碳酸钠粉末制取二氧化碳的理由是
。
[结 论]实验室制取二氧化碳,原料通常用块状石灰石(或大理石)和稀盐酸。
[问题三]要得出该结论,上述两组对比实验中,[实验二]所取稀盐酸的体积是
mL、
溶质质量分数是
。
Ⅲ.拓展与反思
通过探究活动,你认为选择实验方法时应考虑的因素有
(写一种即可)。
四.计算与分析(本题 2 小题,共 10 分)
18.(5 分)配制 100g 8﹪的硫酸铜溶液,步骤如下:
(1)计算:需要硫酸铜
g,水
mL(水的密度以 1.0 g·cm-3 计)。
(2)称量:用托盘天平称取硫酸铜固体,放入烧杯中,用规格为
量筒(填“10mL”
或“100 mL”)量取水,也倒入烧杯中。
(3)溶解:用玻璃棒搅拌溶解。
19.(5 分)黄铜是铜和锌的合金。为了测定某黄铜样品中铜的质量分数,取 20g 该黄铜样品
加入一定量稀硫酸中(Zn + H2SO4 = ZnSO4 + H2↑),恰好完全反应,产生氢气 0.2 g。求:
(1)该黄铜样品中锌的质量。
(2)该黄铜样品中铜的质量分数(精确到 0.1﹪)。
�
参考答案
评分说明:
1.只要考生的答案合理,就可参照评分说明给分。
2.化学方程式中,化学式错不给分,没配平或没注明反应条件扣 1 分,没气标或没沉淀符号不
扣分。化学专用名词写错别字或元素符号出现错误不给分。
3.试题中未明确要写化学式或名称的,正确写出其一者即可得分。
一、选择与判断(本题共有 10 小题,每小题 3 分,共 30 分)
1
A
2
C
3
B
4
D
5
B
6
A
7
D
8
A
9
C
10
B
二、填空与简答(本题 6 小题,共 41 分,无特别说明的每空均为 2 分,下同。)
11.(4 分)
(1)9
12.(6 分)
(2)非金属
(1)低于
(2)氧气(或空气;充足的氧气;充足的空气)
(3)用沙土盖灭(或用水浇灭等)
13.(6 分)
(1)C
14.(12 分)
(1)C
(2)硬水
(3)②①③④
(2)
MgCl2 ==== Mg + Cl2↑
通电
分解
(3)水(或 H2O)
氧气(或 O2)
3Fe + 2O2 ==== Fe3O4
撞击
(条件写点燃不扣分)
15.(8 分)
(1)A
16.(5 分)
(1)见右图(1 分)
(2)饱和
(2)二氧化碳(或 CO2 )
(3)2
前面
(3)加硝酸钾固体 (或恒温蒸发溶剂;降温)
三.实验与探究(本题 1 小题,共 19 分。)
�
17.(19 分)
Ⅰ.(1)①试管
②集气瓶
(2)
2KMnO4====K2MnO4 + MnO2 + O2↑
△
(或 2H2O2==== 2H2O + O2↑)
MnO2
(3)将带火星的木条放在集气瓶口,木条复燃,说明氧气已收集满
(4)B (1 分)
Ⅱ.(1)CaCO3 + 2HCl = CaCl2 + H2O + CO2↑
(2)[分析一]不能
[分析二]反应速率太快,不便于气体收集 (1 分)
[问题三]15
10%
Ⅲ.科学性(或安全性;可行性;简约性等) (若学生答到操作简便;安全;节能;环保;
反应速率等合理答案均给分)(1 分)
四.计算与分析(本题 2 小题,共 10 分)
18.(5 分)
(1)8
92 (每空 2 分)
(2)100 mL (1 分)
19.(5 分)
(1) 解:设样品中锌的质量为 X
Zn + H2SO4 = ZnSO4 + H2↑
65
X
2
0.2g ……………………(2 分)
…………………………… (1 分)
65
X
2
g2.0
X= 6.5g …………………………… (1 分)
(2)铜的质量分数=
g5.6g20
g20
%5.67%100
……………(1 分)
答: 样品中锌的质量为 6.5g ;铜的质量分数是 67.5%。
�











 2023年江西萍乡中考道德与法治真题及答案.doc
2023年江西萍乡中考道德与法治真题及答案.doc 2012年重庆南川中考生物真题及答案.doc
2012年重庆南川中考生物真题及答案.doc 2013年江西师范大学地理学综合及文艺理论基础考研真题.doc
2013年江西师范大学地理学综合及文艺理论基础考研真题.doc 2020年四川甘孜小升初语文真题及答案I卷.doc
2020年四川甘孜小升初语文真题及答案I卷.doc 2020年注册岩土工程师专业基础考试真题及答案.doc
2020年注册岩土工程师专业基础考试真题及答案.doc 2023-2024学年福建省厦门市九年级上学期数学月考试题及答案.doc
2023-2024学年福建省厦门市九年级上学期数学月考试题及答案.doc 2021-2022学年辽宁省沈阳市大东区九年级上学期语文期末试题及答案.doc
2021-2022学年辽宁省沈阳市大东区九年级上学期语文期末试题及答案.doc 2022-2023学年北京东城区初三第一学期物理期末试卷及答案.doc
2022-2023学年北京东城区初三第一学期物理期末试卷及答案.doc 2018上半年江西教师资格初中地理学科知识与教学能力真题及答案.doc
2018上半年江西教师资格初中地理学科知识与教学能力真题及答案.doc 2012年河北国家公务员申论考试真题及答案-省级.doc
2012年河北国家公务员申论考试真题及答案-省级.doc 2020-2021学年江苏省扬州市江都区邵樊片九年级上学期数学第一次质量检测试题及答案.doc
2020-2021学年江苏省扬州市江都区邵樊片九年级上学期数学第一次质量检测试题及答案.doc 2022下半年黑龙江教师资格证中学综合素质真题及答案.doc
2022下半年黑龙江教师资格证中学综合素质真题及答案.doc