2011 年四川省资阳市中考化学真题及答案
一、选择题
3.下列有关物质性质与用途的对应关系错误..的是
A.稀有气体的惰性——制成电光源
B.活性炭的吸附性——用于防毒面具
C.氢气的可燃性——作火箭的燃料
D.氢氧化钠易潮解——作某些气体干燥剂
4.我市安岳县是“中国柠檬之乡”。柠檬中含有相当丰富的柠檬酸,柠檬酸是一种广泛用
于食品、医疗、日化等行业的重要有机酸。柠檬酸的结构如图所示,下列说法中错误..的是
A.柠檬酸溶液能使紫色石蕊试液变红
B.柠檬酸中碳、氢元素的质量比为 9∶1
C.三种元素中质量分数最大的是氧元素
D.柠檬酸的相对分子质量是 192 g
5.下列有关实验操作正确的是
A.称量氢氧化钠固体时,将氢氧化钠固体直接放在纸上进行称量
B.蒸发食盐水后,将蒸发皿立即直接放于实验桌上
C.用 10mL 量筒量取 7.5mL 的蒸馏水
D.稀释浓硫酸时将蒸馏水沿烧杯壁慢慢注入浓硫酸中,并用玻璃棒不断搅拌
6.日本大地震造成福岛第一核电站发生严重的核辐射泄漏,日本政府为降低放射性碘(碘
131)对人体的伤害向福岛核电站附近居民发放碘片(含碘 127,碘 127 是指核电荷数为 53,中
子数为 74 的一种碘原子)。则下列说法中错误..的是
A.碘元素是一种非金属元素
B.碘 127 原子和碘 131 原子的相对原子质量相同
C.碘 131 原子的质子数为 53
D.核能的利用证实了原子的可分性,但安全利用核能应引起人们的高度重视
7.下列有关溶液的说法中正确的是
A.饱和溶液不一定是浓溶液,不饱和溶液一定是稀溶液
B.36gNaCl 溶解在 100g 水中刚好形成饱和溶液,故 NaCl 的溶解度为 36g
C.将 1 g 某物质加入到 9 g 水中,所得溶液的溶质质量分数不一定是 10%
�
D.饱和澄清石灰水中加入少量生石灰后,则石灰水溶液的质量增大
8.有 X、Y、Z 三种金属,将 X、Y、Z 分别加入到相同的稀盐酸溶液中,只有 Y 表面产生气
泡;另将 X 加入到 Z 的硝酸盐溶液中,无明显现象产生。由此判断金属活动性顺序正确的是
A.X>Y>Z
B.Y>Z>X
C.Y> Cu>Z>X
D.Y>X>Z
9.将甲、乙、丙、丁四种物质放入一密闭容器中,在一定条件下发生反应,测得反应前后
有关数据如下表所示,下列有关此反应的说法中正确的是
物质
反应前质量(g)
反应后质量(g)
甲
20
0
乙
50
100
丙
80
20
丁
30
x
A.反应后丁的质量 x为 30 g
B.参加反应的甲、丙的质量比为 1∶4
C.若乙为单质,丁为化合物,则该反应一定是置换反应
D.若该反应为 复分解反应且甲、乙、丙分别为酸、盐、碱,则丁一定是水
二、填空与图示题
25.( 4 分)在 C、H、O、S、Na、Ca 中选择适当的元素组成符合要求的物质,并将其化学
式填在对应的横线上。
(1)形成酸雨的氧化物______________; (2)治疗胃酸过多的一种盐______________;
(3)硫为-2 价的酸__________ ______;
(4)土壤酸化后需要加入的物质__________。
26.(4 分)水是生命之源,政府为了解决我市人民用水难的问题,于 2010 年末举行了毗
河供水一期工程开工动员誓师大会。
(1)河水中含有许多杂质,可利用吸附、沉淀、过滤和蒸馏等方法净化,其中净化程度最
高的方法是___________;
(2)硬水给生活和生产带来很多麻烦,生活中常用______________ ________来区分硬水和
软水,并常用煮沸的方法来降低水的硬度;
(3)常用洗洁精洗涤油污,是因洗洁精具有___________功能;
(4)“84 消毒液”可用于对水源的消毒杀菌,其制备的主 要反应为:
2NaOH + Cl2 = NaClO +NaCl+H2O。证明“84 消毒液”中是否含有 NaCl 的方法是:取少量“84
消毒液”,加入少量______________________溶液(填名称),观察是否产生不溶于稀硝酸的白
色沉淀。
27.(3 分)2010 年 11 月 15 日 14 时,上海静安区高层住宅发生大火,造成严重的经济损
失,可燃物为施工所使用的保温材料聚氨酯(PU)塑料。
(1)聚氨酯(PU)塑料燃烧的条件为____________________________________________;
(2)可燃物聚氨酯塑料为_________________________________(填“无机”或“有机”)
材料;
(3)研究表明,氢氧化镁可作阻燃剂,是因为氢氧化镁在达到 380℃以上时就会发生分解,
生成耐高温的氧化镁而起阻燃作用,则氢氧化镁受热分解的化学方程式为
_______ ________________。
28.(3 分)氮化硅陶瓷是一种新型陶瓷材料,能承受高温,可用于制造业、航天工业等领域。
(1)氮元素与硅元素最本质的区别是_________________________________;
�
(2)由结构示意图
可知,氮原子最外层电子数目为___________;
(3)工业上生产氮化硅陶瓷的方法之一是利用硅与氮气在一定条件下发生反应而制得,原
料硅主要是由石英砂(主要成分是二氧化硅)与碳在一定条件下反应制得,生成物除硅外,还有
一 种有毒的氧化物。试写出该反应的化学方程式
_________________________________________。
29.(4 分)化学与生活息息相关,我们要正确认识和使用化学给我们带来的丰富的物质。
(1)人们常用铁锅炒菜,是因为人体血液中需要铁元素,人体缺乏它就 会患___________
病;
(2)近期在我国某一地区查获 “毒豆芽”,经检测,该豆芽中含有亚硝酸钠、尿素、恩诺
沙星。其中尿素属于农业中广泛使用的___________(选填“氮肥”、“磷肥”、“钾肥”或“复
合肥”),而亚硝酸钠、恩诺沙星则对人体有害;
(3)馒头为我们生活中的一种食品。但不法商贩为了美观和降低成本,一是添加了柠檬黄
(PbCrO4)使馒头着色而美观,二是添加甜味素代替蔗糖而降低成本,二者均会对人体造成危害。
上述中蔗糖属于人体所需六大营养素中的________________;柠檬黄中 Pb 的化合价为+2 价,则
Cr 的化合价为_________价。
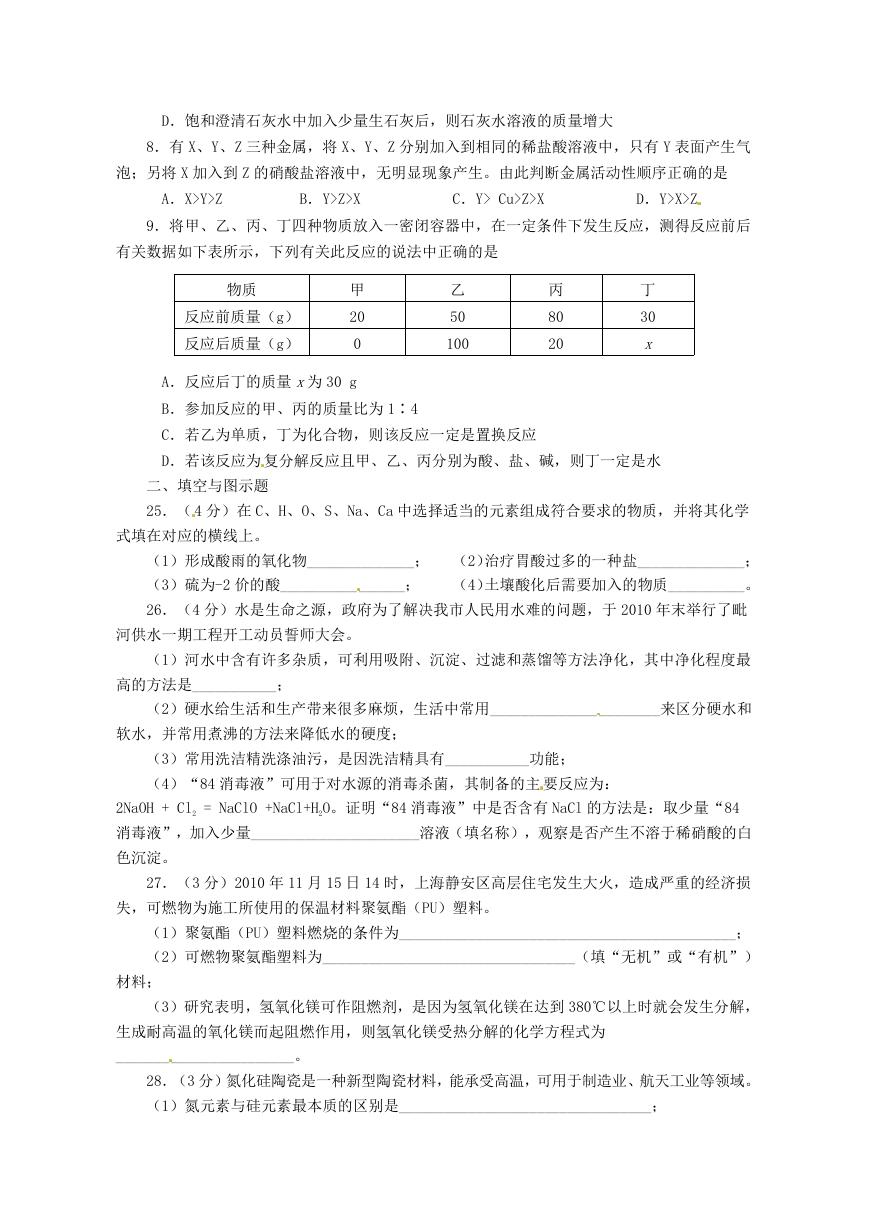
30.(6 分)下图为某些物质间的转化关系,其中 A 是白色固体,甲是黑色固体,B 为气体
单质、C 和乙在常温下均为无色液体,E 为最常用的金属单质之一,H 是一种红褐色沉淀。(部
分反应物、生成物、反应条件已略去)
(1)物质 D 的化学式___________;
(2)甲在反应①中所起的作用是______________________;
(3)举 出防止 E 的制品锈蚀的一种方法____________________________________________;
(4)写出下列反应的化学方程式
①__________________________________________________________________;
⑤__________________________________________________________________;
⑦___________ ___________________________ ____________________________。
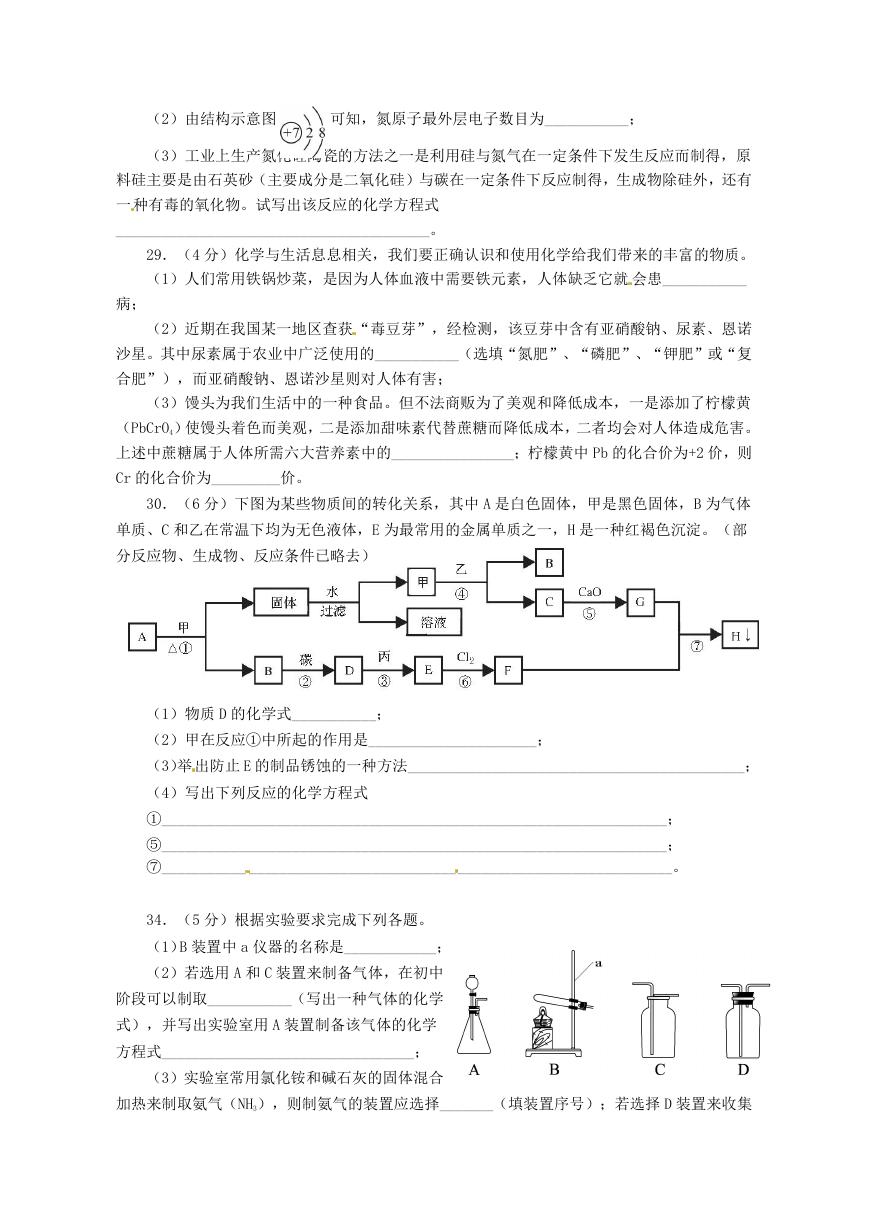
34.(5 分)根据实验要求完成下列各题。
(1)B 装置中 a 仪器的名称是____________;
(2)若选用 A 和 C 装置来制备气体,在初中
阶段可以制取___________(写出一种气体的化学
式),并写出实验室用 A 装置制备该气体的化学
方程式_________________________________;
(3)实验室常用氯化铵和碱石灰的固体混合
加热来制取氨气(NH3),则制氨气的装置应选择_______(填装置序号);若选择 D 装置来收集
�
氨气,则气体应从_____(填“左”或“右”)端通入。
35.(5 分)甲、乙两同学为了探究实验室中久置的氢氧化钠固体是否变质,进行了如下实
验。请与他们一起完成探究活动。
【提出问题】氢氧化钠固体是否变质。
【实验探究】甲、乙两同学分别设计了不同的方案并加以实验。
甲同学的方案及实验:
实验步骤
①取少量白色固体于试管中,加水振荡至全部溶解
实验现象与结论
无色溶液
②用 pH 试纸测①溶液的 pH 值
溶液的 pH>7,说明氢氧化钠固体没有变质
乙同学的方案及实验:
实验步骤
①取少量白色固体于试管中,加水进行振荡至全部溶解
实验现象与结论
无色溶液
②向①溶液中加入适量氯化钡溶液
现象 A,说明氢氧化钠固体已变质
(1)乙同学认为甲同学的结论不科学,其理由是___________________________________;
(2)乙同学的实验中,观察到的现象 A 应为________________________________________,
该反应的化学方程式为________________________________________________________,氢氧化
钠固体变质的原因是(用化学方程式表示)____________________________________;
【拓展应用】
(3)氢氧化钠固体应当密封保存;
(4)若要除去上述变质的氢氧化钠溶液中的杂质,应加入适量的____________(填化学式)
溶液而除去。
38.(5 分)过氧化钠(Na2O2)与水发生反应,生成对应的碱和氧气,化学方程式为:
2Na2O2+2 H2O=4NaOH+O2↑。现将 78 g 过氧化钠放入 338 g 水中,充分反应。试计算:
(1)生成的氧气在标准状况的体积是多少?(已知标准状况下氧气的密度是 1.43g/L)
(2)所得溶液中溶质质量分数是多少?
�
参考答案
3
A
4
D
5
C
6
B
7
C
8
B
9
D
25.(1)SO2(或 SO3) (2)NaHCO3
26.(1)蒸馏 (2)肥皂水 (3)乳化 (4)硝酸银溶液和稀硝酸(或硝酸酸化
(4)Ca(OH)2
(3)H2S
的硝酸银溶液或硝酸银溶液)
27.(1)温度达到(聚氨酯(PU)塑料的)着火点、有空气(或氧气)存在(二者答
380℃
完才能得分,答出可燃物不扣分)(2)有机 (3)Mg(OH)2 = MgO + H2O↑(条件写成
加热或△或高温均可,未注明条件得一半的分)
28.(1)它们的核电荷数(或质子数)不同 (2)5
高温
(3)SiO2 +2 C = Si +2 CO↑(未注明条件不扣分)
29.(1)缺铁性贫血(或贫血)(2)氮肥 (3)糖类 +6
30.(1)CO
(2)催化作用(3)在铁制品表面涂油;刷漆;镀耐磨和耐腐蚀的铬;
制造耐腐蚀的合金(任填一种即可得分或其它合理答案也给分)
(4)①2KClO3 = 3O2 ↑+ 2KCl
⑦ 2FeCl3 + 3Ca(OH)2= 2Fe(OH)3 ↓+3CaCl2
MnO2
△
⑤CaO + H2O =Ca(OH)2
34.(1)铁架台(有错字、别字不给分)
MnO2
(2)O2 或 CO2;2H2O2=2H2O+O2↑或 CaCO3+2HCl= CaCl2+H2O +CO2↑ (3)B;右
35.(1)碳酸钠溶液也显碱性 (碳酸钠溶液的 pH>7)
(2)有白色沉淀产生;Na2CO3 +BaCl2=BaCO3↓+2NaCl;CO2+2NaOH=Na2CO3 +H2O
(4)Ca(OH)2
38.解:设生成 O2 和 NaOH 的质量分别为 x和 y
2H2O = 4NaOH
160
y
+
O2↑
32
x
32
x
2Na2O2 +
156
78g
160
156
78g
y
x=16 g
y=80 g
故 O2 在标准状况下的体积为: 16g
1.43g/L
= 11.2 L
NaOH 溶液中 NaOH 的质量分数为:
80g
78g+338g-16g
×100% =20%
学科 网(北 京)股 份有限 公司
�








 2023年江西萍乡中考道德与法治真题及答案.doc
2023年江西萍乡中考道德与法治真题及答案.doc 2012年重庆南川中考生物真题及答案.doc
2012年重庆南川中考生物真题及答案.doc 2013年江西师范大学地理学综合及文艺理论基础考研真题.doc
2013年江西师范大学地理学综合及文艺理论基础考研真题.doc 2020年四川甘孜小升初语文真题及答案I卷.doc
2020年四川甘孜小升初语文真题及答案I卷.doc 2020年注册岩土工程师专业基础考试真题及答案.doc
2020年注册岩土工程师专业基础考试真题及答案.doc 2023-2024学年福建省厦门市九年级上学期数学月考试题及答案.doc
2023-2024学年福建省厦门市九年级上学期数学月考试题及答案.doc 2021-2022学年辽宁省沈阳市大东区九年级上学期语文期末试题及答案.doc
2021-2022学年辽宁省沈阳市大东区九年级上学期语文期末试题及答案.doc 2022-2023学年北京东城区初三第一学期物理期末试卷及答案.doc
2022-2023学年北京东城区初三第一学期物理期末试卷及答案.doc 2018上半年江西教师资格初中地理学科知识与教学能力真题及答案.doc
2018上半年江西教师资格初中地理学科知识与教学能力真题及答案.doc 2012年河北国家公务员申论考试真题及答案-省级.doc
2012年河北国家公务员申论考试真题及答案-省级.doc 2020-2021学年江苏省扬州市江都区邵樊片九年级上学期数学第一次质量检测试题及答案.doc
2020-2021学年江苏省扬州市江都区邵樊片九年级上学期数学第一次质量检测试题及答案.doc 2022下半年黑龙江教师资格证中学综合素质真题及答案.doc
2022下半年黑龙江教师资格证中学综合素质真题及答案.doc