2022 年湖北省黄石市中考化学真题及答案
可能用到的相对原子质量:H-1
C-12
O-16
S-32
Cl-35.5
Na-23
一、选择题
1. 空气中含很多成分,其中含量较少,常用作保护气的是
A. 氮气
B. 氧气
C. 二氧化碳
D. 稀有气体
2. 冰雪埋忠骨,历史有温度。青山犹在,致敬先辈!电影《长津湖》场景中所示变化属于化学变化的是
A. 长津湖湖水结冰
B. 棉衣裁制成单衣
C. 战场上战火熊熊
D. 铅笔书写绝笔信
3. 醋拍黄瓜酸甜爽口,其用料如表。为了使营养更均衡,搭配的食物中应富含的营养素是
用料表
黄瓜、蒜
醋、白糖
香油、食盐
A. 蛋白质
B. 糖类
C. 维生素
D. 油脂
4. 下列分类不正确的是
A. 氢气------单质
C. 氢氧化钙------碱
B. NaHCO3------酸
D. C6H12O6------有机物
5. 如图是磷酸二氢钾(KH2PO4)化肥包装上的部分信息,对该化肥叙述不正确的是
磷酸二氢钾
净重 50kg
KH2PO4≥98%
高纯度,全水溶,易吸收
A. 属于复合肥料
B. 易溶于水
C. 是纯净物
D. 主要含有四种元素
6. “垃圾是放错位置的资源”,垃圾分类有利于环保,易拉罐、塑料瓶应放在
A.
B.
C.
D.
�
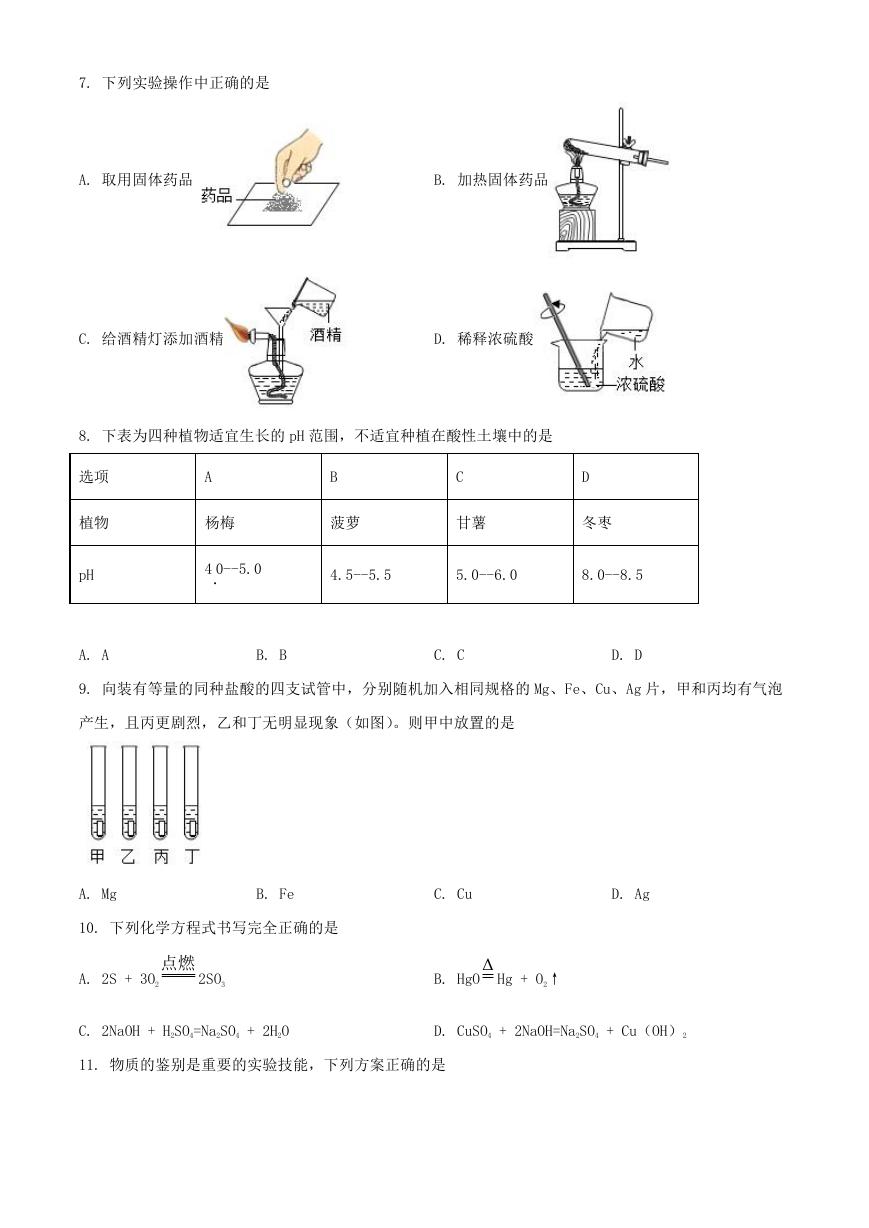
7. 下列实验操作中正确的是
A. 取用固体药品
B. 加热固体药品
C. 给酒精灯添加酒精
D. 稀释浓硫酸
8. 下表为四种植物适宜生长的 pH 范围,不适宜种植在酸性土壤中的是
选项
植物
pH
A. A
A
杨梅
4.0--5.0
B
菠萝
C
甘薯
D
冬枣
4.5--5.5
5.0--6.0
8.0--8.5
B. B
C. C
D. D
9. 向装有等量的同种盐酸的四支试管中,分别随机加入相同规格的 Mg、Fe、Cu、Ag 片,甲和丙均有气泡
产生,且丙更剧烈,乙和丁无明显现象(如图)。则甲中放置的是
A. Mg
B. Fe
C. Cu
D. Ag
10. 下列化学方程式书写完全正确的是
A. 2S + 3O2
点燃
2SO3
Δ
B. HgO
Hg + O2↑
C. 2NaOH + H2SO4=Na2SO4 + 2H2O
D. CuSO4 + 2NaOH=Na2SO4 + Cu(OH)2
11. 物质的鉴别是重要的实验技能,下列方案正确的是
�
选项 实验目的
实验方案
A
B
C
D
鉴别 CO2 和 N2
用燃着的木条,观察火焰是否熄灭
鉴别 AgNO3 与 Na2SO4 溶液
取样,滴加 BaCl2 溶液,观察是否有白色沉淀
鉴别 NH4Cl 固体和(NH4)2SO4 固体
取样,加入 NaOH 固体,研磨,闻气味
鉴别白色 CuSO4 固体和 NaCl 固体
取样,加水溶解,观察颜色
A. A
B. B
C. C
D. D
12. “证据推理与模型认知”是化学学科核心素养的重要组成部分。下列推断合理的是
A. 合金的硬度一般比组成他们的纯金属更高,因此黄铜的硬度高于铜和锌
B. 活泼金属与酸反应生成氢气是置换反应,所以有单质气体生成的反应都是置换反应
C. Na2O、CaO 均能与水反应生成碱,因此所有金属氧化物都能与水反应生成碱
D. 化学变化常常伴随能量的变化,所以有能量变化的一定属于化学变化
二、非选择题
13. 阅读材料,回答下列问题。
宇航服材料揭秘
2022 年 6 月 5 日 10 时 44 分,神州 14 经过约 577 秒顺利到达预定轨道,再次告知世人,中国已是当今世界
太空强国之一。探索太空很大程度上取决于宇航服研究和航天技术的融合。宇航服是保障航天员的生命活
动和工作能力的个人密闭装备。
中国科学家们研发出了三种类型的宇航服,即舱内宇航服(IVA)、舱外宇航服(EVA)、舱内/舱外宇航服
(IEVA)。
整套舱外宇航服的编制层数多达十数层,每层基本都是不同的材料,每层执行不同的功能。最内层由尼龙
经编材料制成,另一层由弹性可穿戴聚合物氨纶组成,还有一层尼龙聚氨酯涂层,这层编织物会参与宇航
服的加压。在压力抑制层中,编织结构由涤纶、聚酯化合物组成。其他合成编织物还有氯丁橡胶、镀铝聚
酯薄膜、凯夫拉纤维、Gortex(一种防风、防水、透气薄膜材料)、Nomex(耐热性能在 250℃内,有过滤和
绝缘效果)等。
除了合成纤维以外,其他混合原料也必不可少。如上躯干的玻璃纤维是主要材料;太空行走期间还有氢氧
化锂作为去除二氧化碳和水蒸气的过滤器;宇航服的电池结构有一部分来自于银锌混合物;头盔部分主要
由聚碳酸酯材料组成……
(1)尼龙、涤纶属于______。
�
A. 天然纤维
B. 合成纤维
(2)氯丁橡胶属于合成橡胶,与天然橡胶相比,它具有高弹性、绝缘性,这两种性质都属于______。
A. 物理性质
B. 化学性质
(3)锂和铝的利用要比铜和铁晚的多,其实质原因主要是锂和铝的金属活动性比铜和铁______。
A. 弱
B. 强
(4)宇航服中,生命维持系统可以看作一个独立的背包装置,这里面备有电源、通风风扇和通讯设备、二
氧化碳去除过滤器、______。
A. 氧气
B. 氮气
(5)氢氧化锂(LiOH)的性质与 NaOH 相似,可以与 CO2 反应,写出氢氧化锂与 CO2 反应的化学方程式______。
14. 水被誉为万物之源,在生活、生产中应用非常广泛。请回答问题。
(1)自来水厂利用明矾溶于水后生成的胶状物对杂质的______,使杂质沉降来达到净水的目的。
A. 吸附
B. 氧化
C. 乳化
(2)电解水时,装置甲端产生 O2,乙端产生 H2,若甲端同时产生少量 O3,则会使甲乙两端产生气体体积之
比______1:2。
A. 大于
B. 等于
C. 小于
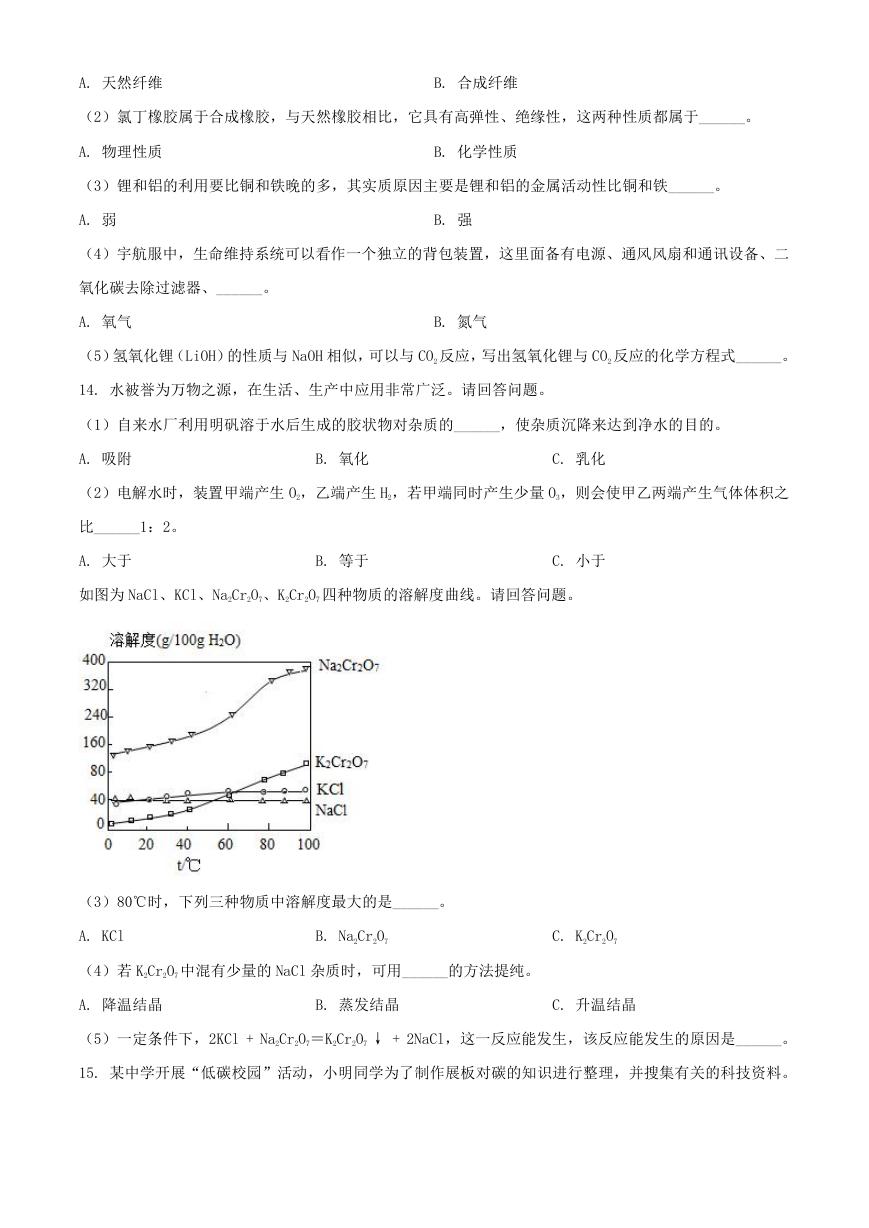
如图为 NaCl、KCl、Na2Cr2O7、K2Cr2O7 四种物质的溶解度曲线。请回答问题。
(3)80℃时,下列三种物质中溶解度最大的是______。
A. KCl
B. Na2Cr2O7
C. K2Cr2O7
(4)若 K2Cr2O7 中混有少量的 NaCl 杂质时,可用______的方法提纯。
A. 降温结晶
B. 蒸发结晶
C. 升温结晶
(5)一定条件下,2KCl + Na2Cr2O7=K2Cr2O7 ↓ + 2NaCl,这一反应能发生,该反应能发生的原因是______。
15. 某中学开展“低碳校园”活动,小明同学为了制作展板对碳的知识进行整理,并搜集有关的科技资料。
�
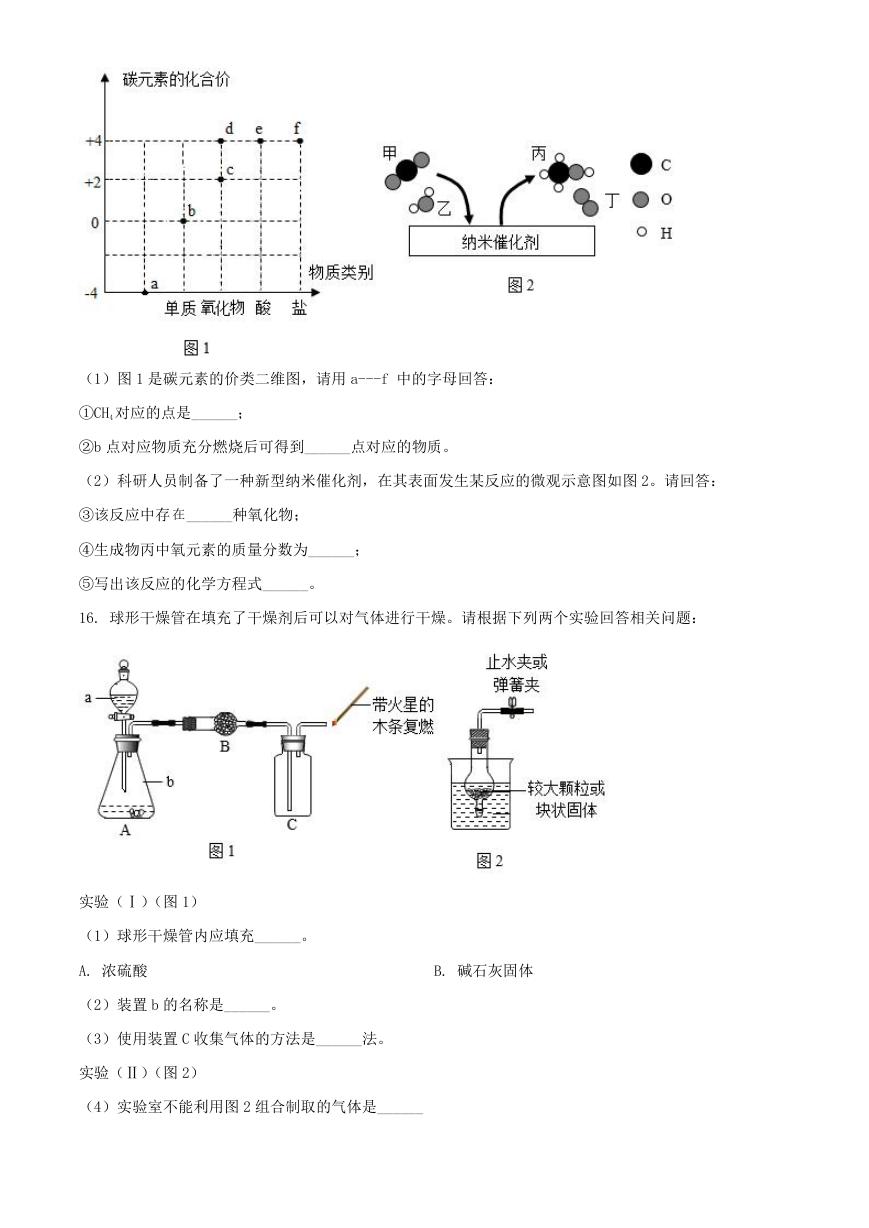
(1)图 1 是碳元素的价类二维图,请用 a---f 中的字母回答:
①CH4 对应的点是______;
②b 点对应物质充分燃烧后可得到______点对应的物质。
(2)科研人员制备了一种新型纳米催化剂,在其表面发生某反应的微观示意图如图 2。请回答:
③该反应中存 在______种氧化物;
④生成物丙中氧元素的质量分数为______;
⑤写出该反应的化学方程式______。
16. 球形干燥管在填充了干燥剂后可以对气体进行干燥。请根据下列两个实验回答相关问题:
实验(Ⅰ)(图 1)
(1)球形干燥管内应填充______。
A. 浓硫酸
B. 碱石灰固体
(2)装置 b 的名称是______。
(3)使用装置 C 收集气体的方法是______法。
实验(Ⅱ)(图 2)
(4)实验室不能利用图 2 组合制取的气体是______
�
A. H2
B. O2
C. CO2
(5)图 2 组合装置的优点是______。
17. 某化学兴趣小组在学习 O2 制备时,对 MnO2 做催化剂加快双氧水分解产生了兴趣,他们提出疑问:其他
物质能否对双氧水分解速率产生影响?
【查阅资料】影响化学反应速率的因素有很多,如:使用催化剂、改变温度、改变反应物的浓度等。
【实验探究】小组的同学们按图组装,在室温下分别进行了四组实验,并用 O2 传感器测定实验过程中 O2 含
量的变化情况,得到如下图所示曲线。
组别
试剂
第 1 组
2mL 5% H2O2
第 2 组
2mL 5% H2O2 + 3 滴 FeCl3 溶液
第 3 组
2mL 5% H2O2 + 3 滴 CuSO4 溶液
第 4 组
2mL 5% H2O2 +少量 MnO2 粉末
【实验结论】对比四条曲线,进行分析:
(1)FeCl3 溶液、CuSO4 溶液对 H2O2 的分解______(填“有”或“无”)催化作用;
(2)写出实验中催化效果最优的使 H2O2 分解的化学方程式______;
(3)第 1 组实验的目的是______;
(4)小组的同学们不加催化剂,在不同温度下,用不同浓度的 H2O2 进行实验,记录实验现象如下表。据此
可得出:升高温度或______(填“增大”或“减小”)反应物浓度可加快 H2O2 的分解。
温度
H2O2%
5%
50℃
60℃
70℃
无明显气泡
无明显气泡
极少量气泡
�
10%
15%
无明显气泡
无明显气泡
少量气泡
无明显气泡
少量气泡
较多气泡
(5)实验需要 30g10%的双氧水溶液,可用 15%的双氧水溶液加______g 蒸馏水配置。
18. 二氧化铈(CeO2)是一种重要的稀土氧化物。平板电视显示屏生产过程中产生大量的废玻璃粉末(含
SiO2、Fe2O3、CeO2、FeO 等物质)。某学习组以此粉末为原料,设计以下工艺流程对资源进行回收,得到纯净
的 CeO2 和硫酸铁铵晶体[NH4Fe(SO4)2·xH2O]。
已知:①CeO2 不溶于稀硫酸,也不溶于 NaOH 溶液;②SiO2 不溶于酸(氢氟酸除外)。
回答下列问题:
(1)稀酸 A 是______;
(2)操作①的名称为______;
(3)滤渣 2 是______(填化学式);
(4)滤液 2 中发生反应的化学方程式为:2Ce2(SO4)3+12NaOH+O2+2 甲=4Ce(OH)4↓+6Na2SO4,甲的化学式
是______;
(5)硫酸铁铵[NH4Fe(SO4)2]中 Fe 元素的化合价为______价。
19. 某氢氧化钠固体因保存不当部分变质生成了 Na2CO 3,取该样品 12.5g 逐滴加入一定量的稀盐酸,恰好
完全反应时,得到 75g 溶液。反应中产生的气体的质量与稀盐酸的用量关系如图所示。试计算:
(1)x=______g;
�
(2)样品中 NaOH的质量百分数。
�













 2023年江西萍乡中考道德与法治真题及答案.doc
2023年江西萍乡中考道德与法治真题及答案.doc 2012年重庆南川中考生物真题及答案.doc
2012年重庆南川中考生物真题及答案.doc 2013年江西师范大学地理学综合及文艺理论基础考研真题.doc
2013年江西师范大学地理学综合及文艺理论基础考研真题.doc 2020年四川甘孜小升初语文真题及答案I卷.doc
2020年四川甘孜小升初语文真题及答案I卷.doc 2020年注册岩土工程师专业基础考试真题及答案.doc
2020年注册岩土工程师专业基础考试真题及答案.doc 2023-2024学年福建省厦门市九年级上学期数学月考试题及答案.doc
2023-2024学年福建省厦门市九年级上学期数学月考试题及答案.doc 2021-2022学年辽宁省沈阳市大东区九年级上学期语文期末试题及答案.doc
2021-2022学年辽宁省沈阳市大东区九年级上学期语文期末试题及答案.doc 2022-2023学年北京东城区初三第一学期物理期末试卷及答案.doc
2022-2023学年北京东城区初三第一学期物理期末试卷及答案.doc 2018上半年江西教师资格初中地理学科知识与教学能力真题及答案.doc
2018上半年江西教师资格初中地理学科知识与教学能力真题及答案.doc 2012年河北国家公务员申论考试真题及答案-省级.doc
2012年河北国家公务员申论考试真题及答案-省级.doc 2020-2021学年江苏省扬州市江都区邵樊片九年级上学期数学第一次质量检测试题及答案.doc
2020-2021学年江苏省扬州市江都区邵樊片九年级上学期数学第一次质量检测试题及答案.doc 2022下半年黑龙江教师资格证中学综合素质真题及答案.doc
2022下半年黑龙江教师资格证中学综合素质真题及答案.doc