2016 年云南昆明理工大学冶金物理化学考研真题 A 卷
一、选择题。在题后括号内,填上正确答案代号。(共 15 小题, 每小题 2 分,合计 30 分)
1、对封闭系统来说,当过程的始态和终态确定后,下列各项中没有确定的值的是:(
( 1 ) Q;
( 2 ) Q+W;
( 3 ) W( Q = 0 );
)。
( 4 ) Q( W = 0 )。
2、某坚固容器容积 100 dm3,于 25℃,101.3 kPa 下发生剧烈化学反应,容器内压力、温
度分别升至 5066 kPa 和 1000℃。数日后,温度、压力降至初态(25℃和 101.3 kPa),则
下列说法中正确的为:(
)。
( 1 )该过程U = 0,H = 0
( 2 )该过程H = 0,W0
( 3 )该过程U = 0,Q0
( 4 )该过程 W = 0,Q0
3、如图,把隔板抽走后,左右两侧的两种气体(可视为理想气体)发生混合,则混合过程
的熵变为(
)。
25℃
02mol
O2
100kPa
25℃
08mol
N2
100kPa
(选填 (1)0416 J·K-1; (2)416 J·K-1;(3)416 J·K-1; (4)-416 J·K-1)
4、1 mol 理想气体经一等温可逆压缩过程,则:(
(1) G > A; (2) G < A; (3) G = A; (4) G与A无法比较。
)。
5、已知在 298 K 时有下列热化学方程:
(1)
(2)
Zn(s ) + 1
2
Hg(l) + 1
2
O2 (g)
== ZnO(s),rH ,1 = -351.4 kJ·mol-1;
O2 (g) == HgO (s),rH ,2 = -181.6 kJ·mol-1;
则 Zn(s ) + HgO (s) == ZnO(s) + Hg(l)反应的标准摩尔焓变rH 为( )。
(1)260.8 kJ·mol-1;
(2)-169.8 kJ·mol-1;
(3)169.8 kJ·mol-1;
(4)-260.6 kJ·mol-1。
6、物质的量为 n的理想气体等温压缩,当压力由 p1 变到 p2 时,其G是:(
(选填 (1) nRT
p
ln 1
p
2
; (2)
p
2
p
1
n
RT
d
p p
(
; (3) V p
2
1 ; (4) nRT
p
)
)。
)
p
ln 2
p
1
7、1000 K 时 ,CO (g) +
1 O2 (g) == CO2(g ) 其 K1 = 5.246×1012;
2
C(s) + CO2(g) == 2CO(g) 其 K2 = 1.719×10 -5
�
则反应 C(s) +
1 O2(g) == CO (g) 的 K3 为:( )。
2
(1) 1.109×10-6
(2)1.036×10-10
(3) 9.018×107
(4)4.731×1020
8、在温度为 T时,纯液体组分 A 和 B 的饱和蒸气压分别为 *
Ap 和 *
Bp ,且 *
Bp =3 *
Ap ,若组分
A 和 B 形成理想液态混合物,当气液两相平衡时,气相中组分 A 和 B 的物质的量相等。则组
分 A 在液相中的摩尔分数应是:( )。
(1)xA=0.5 ;(2)xA=3/4 ;(3)xA=1/4 。
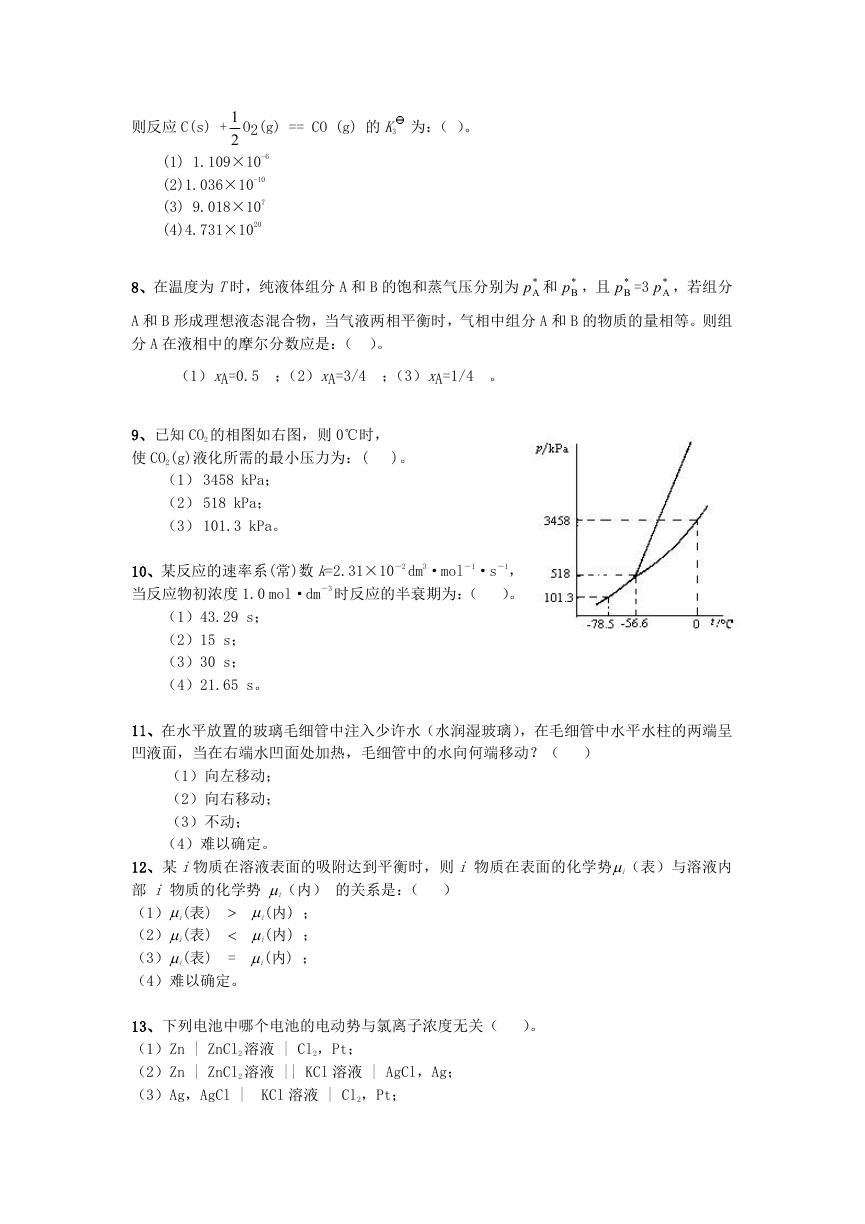
9、已知 CO2 的相图如右图,则 0℃时,
使 CO2(g)液化所需的最小压力为:(
)。
(1) 3458 kPa;
(2) 518 kPa;
(3) 101.3 kPa。
10、某反应的速率系(常)数 k=2.31×10-2 dm3·mol-1·s-1,
当反应物初浓度 1.0 mol·dm-3 时反应的半衰期为:( )。
(1)43.29 s;
(2)15 s;
(3)30 s;
(4)21.65 s。
11、在水平放置的玻璃毛细管中注入少许水(水润湿玻璃),在毛细管中水平水柱的两端呈
凹液面,当在右端水凹面处加热,毛细管中的水向何端移动?( )
(1)向左移动;
(2)向右移动;
(3)不动;
(4)难以确定。
12、某 i物质在溶液表面的吸附达到平衡时,则 i 物质在表面的化学势i(表)与溶液内
部 i 物质的化学势 i(内) 的关系是:( )
(1)i(表) i(内) ;
(2)i(表) i(内) ;
(3)i(表)
= i(内) ;
(4)难以确定。
13、下列电池中哪个电池的电动势与氯离子浓度无关( )。
(1)Zn | ZnCl2 溶液 | Cl2,Pt;
(2)Zn | ZnCl2 溶液 || KCl 溶液 | AgCl,Ag;
(3)Ag,AgCl |
KCl 溶液 | Cl2,Pt;
�
(4)Pt,H2 | HCl 溶液 | Cl2,Pt。
14、298K 时,电池反应 H2(g) +
1 O2(g) ===H2O(l) 所对应的电池标准电动势 E1 ,反应
2
2 H2O(l) === 2 H2(g) + O2(g) 所对应的电池标准电动势 E2 ,E1 和 E2 的关系
为:( )。
(1)E2 = 2 E1 ;
(2)E2 =2 E1 ;
(3)E2 = E1 ;
(4)E2 = E1 。
15、影响任意一个化学反应的标准平衡常数值的因素为:( )。
(1) 催化剂 ;
(2) 温度 ;
(3) 压力 。
二、填空题。在题中“____”处填上答案。(本大题总计 15 分)
1、(3 分)已知:Cp m(Al s)=(2067 1238 10-3 T / K)J·mol-1·K-1,则 1 mol 金属
铝在等压下由 27315 K 升温至 87315 K,过程的S =
。
2、(2 分)已知等温等压下化学反应:aA+bB == yY+zZ 则该反应的平衡条件若用化学势表
示应为。
3、(5 分)反应 C (s) + H2O (g) == CO (g) + H2(g),在 400 ℃时达到平衡,rH = 133.5
kJ · mol-1 , 为 使 平 衡 向 右 移 动 , 可 采 取 的 措 施 有 (1) ;
(2) ; (3) ; (4) ;
(5)。
4、(2 分)微小颗粒物质的化学势比大块物质的化学势要。微小颗粒物质的蒸气
压比大块物质的蒸气压要。
5、(3 分)过渡状态理论认为反应物必须经过
的反应速率由
三、问答题。请回答下列各题。(本大题共 2 小题, 共 30 分)
方能变成产物,且整个反应
所控制。
1、(15 分)电极电势 E(电极)、标准电极电势 E (电极)是否与电极反应书写中的计量系数
有关?举例说明。
2、(15 分)今有 A ,B 两个吸热反应,其标准平衡常数分别为 K (A)和 K (B),反应的标
准摩尔焓变rH (A) rH (B),则温度升高 10 K 时, 哪一个的标准平衡常数变化较大,
为什么?
�
四、计算题(本大题共 75 分)
1、(15 分)电池 Pb | PbSO4(s) | H2SO4(1 mol·kg-1) | PbSO4(s) | PbO2 在 298K 时的
E =2.041 V,并已知 E=(1.902+5.61×10-5T/K)V。
(1)写出电极反应和电池反应;
(2)计算 298K 时电池反应的 rGm ,rSm 及rHm;
(3)计算 298K 时,b=1 mol·kg-1 的 H2SO4 水溶液中 a(H2SO4),a及。
2、(15 分)现有 2 mol 的理想气体,开始处于 100℃,25 dm3。试计算分别经历下面三个
不同过程膨胀至终态 100℃,100 dm3 时的 Q,W,U,H。
( 1 )恒温可逆膨胀;
( 2 )向真空膨胀;
( 3 )在外压力恒定为终态气体的压力下膨胀。
3、(10 分)硅热法炼镁是用 Si(l)还原 MgO(s),已知
2Mg(g) + O2== 2MgO(s)
rG 1 / J·mol-1=-1 428.8×103+3887.4
(1)
T K
Si(l) + O2(g)== SiO2(s)
(2)
rG 2 / J·mol-1=-905.80×103+175.7
T K
计算总压力为 1.01 kPa 时,Si(l)还原 MgO(s)的最低温度。[忽略 Si(l)的蒸气压]
kPa)
(p =100
Y+Z 为一级反应。400 K 时将气体 A 引入一抽空的密闭容器中。
4、(10 分)气相反应 A
开始反应 15 min 后,测得系统总压力为 34.7 kPa。反应终了时,测得系统总压力为 65.6 kPa。
又 500 K 时测得该反应的半衰期为 0.44 min。试求:
(1)反应速率常数及半衰期;
(2)反应经历 1h 后的总压力;
(3)反应的活化能。
5、(10 分)水蒸气迅速冷却至 25℃时,发生过饱和。已知 25℃水的表面张力为 71.97×10
-3N·m -1 ,当过饱和水蒸气为平面水的饱和蒸气压的 4 倍时,请计算开始形成水滴的半径。
已知 25℃时水的体积质量(密度)为 997.0 kg·m -3,H2O 的摩尔质量为 18.02 g·mol - 1 。
6、(15 分)二组分凝聚系统相图如下:
�
(1)指出图中①,②,③,④,⑤各区的相态及成分;
(2)分别绘出系统 a,b,c 的冷却曲线(绘于右图相应位置,注意温度对应关系);
(3)点 F,E,G 的组成(wB 分别为 0.50,0.80,0.90),由 1 kg 的系统 c (wB=0.70)
冷至温度刚接近 FEG 线时,系统中存在哪些相?其数量各为若干千克?
�









 2023年江西萍乡中考道德与法治真题及答案.doc
2023年江西萍乡中考道德与法治真题及答案.doc 2012年重庆南川中考生物真题及答案.doc
2012年重庆南川中考生物真题及答案.doc 2013年江西师范大学地理学综合及文艺理论基础考研真题.doc
2013年江西师范大学地理学综合及文艺理论基础考研真题.doc 2020年四川甘孜小升初语文真题及答案I卷.doc
2020年四川甘孜小升初语文真题及答案I卷.doc 2020年注册岩土工程师专业基础考试真题及答案.doc
2020年注册岩土工程师专业基础考试真题及答案.doc 2023-2024学年福建省厦门市九年级上学期数学月考试题及答案.doc
2023-2024学年福建省厦门市九年级上学期数学月考试题及答案.doc 2021-2022学年辽宁省沈阳市大东区九年级上学期语文期末试题及答案.doc
2021-2022学年辽宁省沈阳市大东区九年级上学期语文期末试题及答案.doc 2022-2023学年北京东城区初三第一学期物理期末试卷及答案.doc
2022-2023学年北京东城区初三第一学期物理期末试卷及答案.doc 2018上半年江西教师资格初中地理学科知识与教学能力真题及答案.doc
2018上半年江西教师资格初中地理学科知识与教学能力真题及答案.doc 2012年河北国家公务员申论考试真题及答案-省级.doc
2012年河北国家公务员申论考试真题及答案-省级.doc 2020-2021学年江苏省扬州市江都区邵樊片九年级上学期数学第一次质量检测试题及答案.doc
2020-2021学年江苏省扬州市江都区邵樊片九年级上学期数学第一次质量检测试题及答案.doc 2022下半年黑龙江教师资格证中学综合素质真题及答案.doc
2022下半年黑龙江教师资格证中学综合素质真题及答案.doc