2013 年新疆普通高中会考化学真题及答案
注意事项:
1.本试题卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,第Ⅱ卷(非选择题)分必
修模块和选修模块两部分,考试时间 90 分钟。
2.答题前,考生须将自己的姓名、准考证号、考场号、座位号填写在本试题卷指定的位置
上。
3.选择题的每小题选出答案后,用 2B 铅笔将答题卡上对应题目的答案标号涂黑。如需改动,
用橡皮擦干净后,再选涂其它答案标号。
4.非选择题的答案必须使用 0.5 毫米黑色字迹的签字笔在答题卡上书写,字体工整、笔迹
清楚。
5.非选择题必须按照题号顺序在答题卡上各题目的答题区域内作答。超出答题区域或在其
它题的答题区域内书写的答案无效。在草稿纸上,本试题卷上答题无效。
6.选修模块的内容请考生按说明作答。
7.考试结束后,将本试题卷和答题卡一并交回。
本试卷可能用到的相对原子质量:H---1 O-16 N-14 Cl-35.5 Na-23
第Ⅰ卷(选择题,共 50 分)
一、单项选择题(本题共 25 小题,每小题 2 分,共 50 分;将答题卡上对应题目的答案标号
涂黑,答在试卷上无效。)
1.空气是人类生存所必需的重要资源。为了改善空气质量而启动的“蓝天工程”得到全民
支持。下列措施不利于“蓝天工程”建设的是 (
)
A.推广使用燃煤脱硫技术,防止 SO2 污染
B.实施绿化工程,防止扬尘污染
C.研制开发燃料电池汽车,消除机动车尾气污染
D.加大石油、煤炭的开采速度,增加化石燃料的供应量
2.下列气体中,只能用排水法收集的是 (
)
A.NO
B.NO2
C.HCl
D.NH3
3.下列物质中属于盐类的是 (
)
A.MgO
B.H2SO4
C.Ca(OH)2
D.Na2CO3
4.下列反应中,水作还原剂的是 (
)
�
A.2Na + 2H2O ==2NaOH + H2↑ B.3NO2 + H2O==2HNO3 + NO
C.2F2 + 2H2O == 4HF + O2
D.SO2 + H2O==H2SO3
5.许多国家十分重视海水资源综合利用。下列不需要化学变化就能够从海水中获得的物质
是 (
)
A.食盐、淡水
B.氯、溴、碘
C.钠、镁、铝
D.烧碱、氢气
6.下列化学用语正确的是 (
)
A.氯化钙的化学式:CaCl
B.NaCl 的电子式:Na+[:Cl:]-
:
:
C.乙烯的分子式:CH2==CH2
D.乙醇的结构简式:C2H6O
7.下列各组物质互为同位素的是 (
)
A.O2 和 O3
B.CH4 和 CH3CH3
C. H12
6 和 H14
6
D.H2O 和 H2O2
8.下列分散系能产生丁达尔效应的是 (
)
A.硫酸铜溶液 B.稀硫酸 C.溴水 D.氢氧化铁胶体
9.下列离子在溶液中可以大量共存的一组是 (
)
A.H+、Na+、OH-
B.Na+、NO3
-、Cl-
C.K+、H+、HCO3
-
D.Ca2+、SO2-、CO3
2-
10.下列说法正确的是 (
)
A. N2 的摩尔质量为 28g
B.17gNH3 的物质的量是 1mol
C.18gH2O 在标准状态下体积是 22.4l
D.将 40gNaOH 溶于 1L 水中,所得溶液中 NaOH 的物质的量浓度为 1mlol/L
11.某反应物 A 浓度是 1.0mol/L,,2s 后 A 的浓度变为 0.8mol/L,在这 2s 内 A 的化学反应
速率是 (
)
A.0.1mol/(L·s)
B.0.2mol/(L·s)
C.0.3mol/(L·s)
D.0.4mol/(L·s)
12.关于反应速率、反应限度的下列说法错误的是 (
)
A.其它条件不变时,升高温度化学反应速率加快
B.其它条件不变时,增大浓度化学反应速率加快
C.化学反应达到反应限度时,正反应速率和逆反应速率相等
D.化学反应达到反应限度时,反应物的浓度和生成物的浓度相同
�
13.下列物质中加入金属钠不产生氢气的是 (
)
A.乙醇 B.乙酸
C.水
D.苯
14.下列物质中,既有离子键,又有共价键的是 (
)
A.NaCl
B.Ca(OH)2
C.H2O
D.CH4
15.关于化学反应与能量的说法正确的是 (
)
A.燃烧属于放热反应
B.中和反应是吸热反应
C.化学键断裂放出能量 D.反应物总能量与生成物总能量一定相等
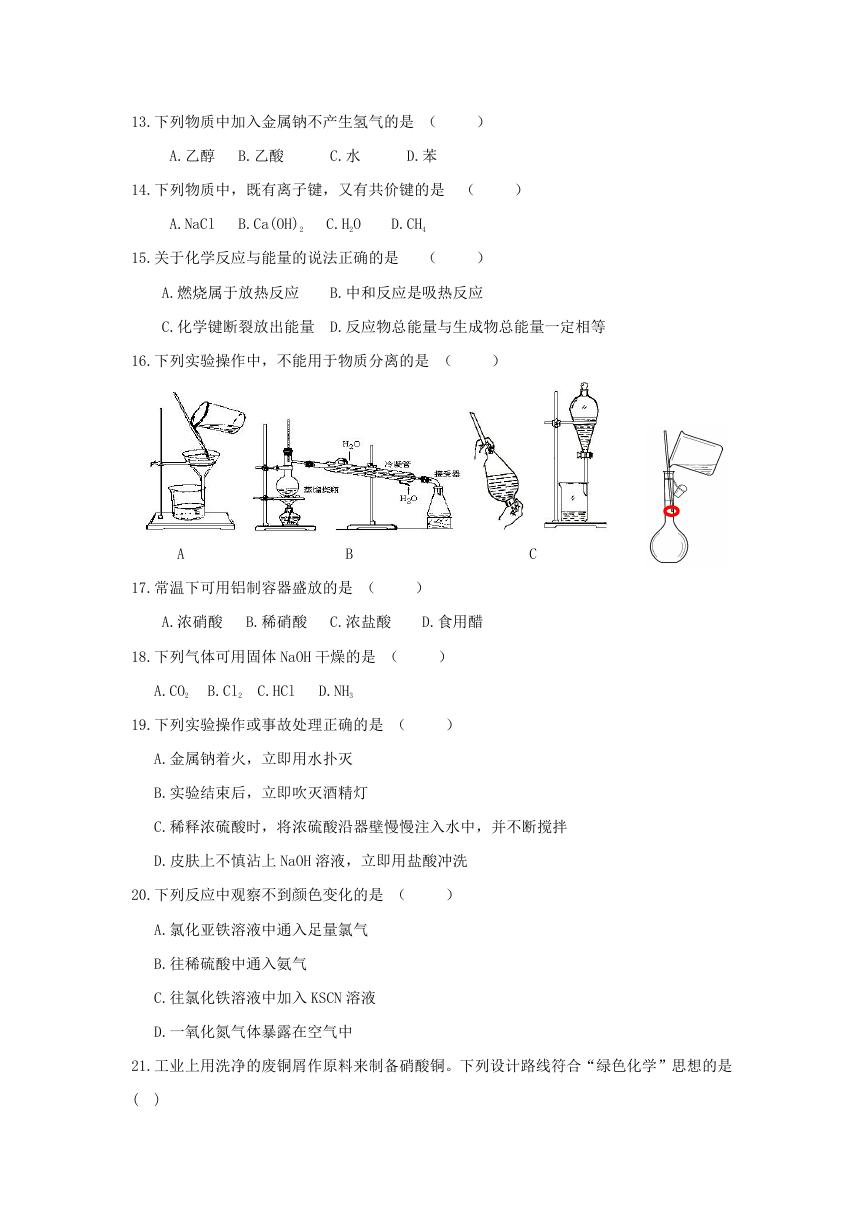
16.下列实验操作中,不能用于物质分离的是 (
)
A
B
C
D
17.常温下可用铝制容器盛放的是 (
)
A.浓硝酸 B.稀硝酸 C.浓盐酸
D.食用醋
18.下列气体可用固体 NaOH 干燥的是 (
)
A.CO2
B.Cl2
C.HCl
D.NH3
19.下列实验操作或事故处理正确的是 (
)
A.金属钠着火,立即用水扑灭
B.实验结束后,立即吹灭酒精灯
C.稀释浓硫酸时,将浓硫酸沿器壁慢慢注入水中,并不断搅拌
D.皮肤上不慎沾上 NaOH 溶液,立即用盐酸冲洗
20.下列反应中观察不到颜色变化的是 (
)
A.氯化亚铁溶液中通入足量氯气
B.往稀硫酸中通入氨气
C.往氯化铁溶液中加入 KSCN 溶液
D.一氧化氮气体暴露在空气中
21.工业上用洗净的废铜屑作原料来制备硝酸铜。下列设计路线符合“绿色化学”思想的是
(
)
�
A.Cu + HNO3(浓)
Cu(NO3)2 B.Cu + HNO3(稀)
C.Cu
空气
Δ
CuO
HNO3
Cu(NO3)2 D.Cu
浓硫酸
CuSO4
Δ
Cu(NO3)2
Ba(NO3)2
Cu(NO3)2
22.“3G”手机出现后,以光导纤维为基础的高速信息通道尤为重要。下列物质中用于制造
管道纤维的是 (
)
A.铜合金 B.聚乙烯 C. 陶瓷 D.二氧化硅
23.随着科学技术的发展,新材料层出不穷。下列属于金属材料的是 (
)
A.生物陶瓷 B.钢化玻璃 C. 钛合金 D.聚四氟乙烯
24.下列反应属于取代反应的是 (
)
A.CH4 + Cl2
CH3Cl
+ HCl
B.Br2 + CH2==CH2
CH2BrCH2Br
C. CH2==CH2 + H2O
一定条件
CH3CH2OH
D.CH4 + 2O2
点燃
CO2 + 2H2O
25.下列说法正确的是 (
)
A.苯分子中含有三个碳碳双键
B.将乙酸和乙醇混合加热制取乙酸乙酯
C.葡萄糖能发生银镜反应
D.糖类、油脂、蛋白质均能发生水解
第Ⅱ卷(非选择题,共 50 分)
必修模块(30 分)
二、填空题(本题共两小题,共 13 分)
26.(7 分)
X、Y、Z 均为短周期元素,且原子序数依次递增,其中 X 元素的单质是自然界
最轻的气体,Y 元素的氧化物 YO2 是形成酸雨的主要气体,Z 元素原子的最外层电子数比次
外层电子数少 1。回答下列问题:
(1)写出 X 元素的符号________;
(2)画出 Z 的原子结构示意图________;
(3)Y 元素在元素周期表中的位置______________;
(4)Y 与 Z 两种元素的最高价氧化物对应的水化物的酸性较强的是_______(写化学式)。
27.(6 分)现有 A、B、C、D 四种金属片,把 A、B 用导线连接起来后同时侵入稀硫酸溶
液中,A 上有气泡产生;把 C、D 用导线连接起来后同时侵入稀硫酸溶液中,D 发生还原
反应;把 A、C 用导线连接起来后同时侵入稀硫酸溶液中,电子流动方向为 A
导线 C。
根据上述情况,回答下列问题:
(1)在中,金属片______发生氧化反应;
�
(2)在中,金属片______作负极;
(3)如果把 B、D 用导线连接后同时侵入稀硫酸溶液,则金属片_____上有气泡产生;
(4)上述四种金属的活动顺序是_______。
三、实验题(本题共 1 小题,共 12 分)
28.下图是有关氨的制取和性质的实验装置。
C
B
A
图一
图二
(1)仪器 C 的名称是________;
(2)写出 A 中所发生化学反应的化学方程式_____________________________________;
(3)收集氨时,试管口棉花的作用_______________________________;
(4)收集氨时,试管 B 验满的方法是_______________________________;
(5)图 1 装置还可以制备______气体;
(6)图 2 装置进行喷泉实验,上部 C 充满氨气,引发水上喷的操作是______;所得溶液
呈________性(填酸性、碱性或中性),解释原因(用化学方程式表示)_________________。
四、计算题(本题共 1 小题,共 5 分,写出计算过程)
29.(5 分)已知 20g NaOH 与 100ml 稀盐酸恰好完全反应,请回答:
(1)写出 NaOH 与盐酸反应的化学方程式;
(2)20gNaOH 的物质的量是多少?
(3)稀盐酸中 HCl 的物质的量浓度是多少?
五、选做题(考生只可选做一个模块试题,若选答了两个模块的试题,只以答在前面的一个
选修模块(共 20 分)
模块成绩计分)
选修 1《化学与生活》
�
30.(6 分)合理膳食,保持营养均衡,是青少年健康成长的重要保证。
(1)维生素 C 能增强人体对疾病的抵抗能力,促进人体生长发育,中学生每天补充 60mg
的维生素 C。下列物质中含有丰富维生素 C 的是______(填字母);
A.牛肉
B.辣椒
C.鸡蛋
D.植物油
(2)青少年及成人缺乏某种微量元素将导致甲状腺肿大,而且会造成智力损害,该微量
元素是______(填字母);
A.碘
B.铁
C.钙
D.锌
(3)蛋白质是人体必需营养物质,它在人体内最终水解为_______(填字母)
A.葡萄糖
B.氨基酸
C.脂肪酸
D.维生素
31.(8 分)材料是人类生存和发展的物质基础,合理使用材料可以改善我们的生活。
(1)居室装修所用的人造板材会释放出一种挥发性物质,长期接触会引起过敏性皮炎,
免疫功能异常,该物质是_________;
( 2 ) 玻 璃 是 重 要 的 硅 酸 盐 产 品 。 生 产 玻 璃 时 , 石 灰 石 与 石 英 反 应 的 化 学 方 程 式
___________;
(3)铁是人们生活中常见的金属材料,请列举两种防止铁制品被腐蚀的方法__________、
______________。
32.(6 分)保持洁净安全的生存环境已成为全人类的共识,人与自然要和谐共处。
(1)pH<______的雨水成为酸雨;向煤中加入适量的________,可以大大减少燃煤产物中
SO2 的量。
(2)对汽车加尾气催化净化装置,可以使其中的 NO、CO 相互反应转化成无毒气体,其原
理用化学方程表示为____________________。
选修 2《化学与技术》
30.(10 分)硫酸工业在国民经济中占有重要地位。工业制硫酸主要的生产流程如图:
SO2
空气
↓
造气
制 SO2
净化
干燥
400—500℃
常压、催化剂
SO3
吸收塔
(1)工业制硫酸通常以______为原料,经造气、_____、吸收三个主要生产阶段;
(2)硫酸生产的尾气中含有少量的 SO2,通常用_______来吸收处理;
(3)在工业生产中,反应条件有重要的作用。请回答:
�
除去原料气中的有毒物质是为了防止____________;
使用催化剂是为了提高_____________。
31.(8 分)下图是海水资源综合利用的示意图。请回答:
(1)海水制盐的方法是_______,过程 a 中主要的操作方法是_________;
精制
饱和食盐水
粗盐
电解
C
烧碱、氢气、氯气
海水
结晶
石灰乳 HCl
盐卤
MgCl2 晶体
脱水
a
无水 MgCl2
电解
b
Mg
(2)过程 b 中电解熔融 MgCl2 的化学方程式为_____________________________________;
(3)过程 c 中电解饱和食盐水的化学方程式_______________________________________。
32.(2 分)有人认为使用杀虫剂已经进入恶性循环,应完全禁止使用化学农药。你是如何
看待这种观点的,并说明理由:_______________。
选择 1B 2A 3B 4C 5D 6D 7B 8B 9A 10D 11C 12A 13B 14B 15D 16D 17D 18C 19C 20A 21A 22C
23A 24B 25D
答案
�












 2023年江西萍乡中考道德与法治真题及答案.doc
2023年江西萍乡中考道德与法治真题及答案.doc 2012年重庆南川中考生物真题及答案.doc
2012年重庆南川中考生物真题及答案.doc 2013年江西师范大学地理学综合及文艺理论基础考研真题.doc
2013年江西师范大学地理学综合及文艺理论基础考研真题.doc 2020年四川甘孜小升初语文真题及答案I卷.doc
2020年四川甘孜小升初语文真题及答案I卷.doc 2020年注册岩土工程师专业基础考试真题及答案.doc
2020年注册岩土工程师专业基础考试真题及答案.doc 2023-2024学年福建省厦门市九年级上学期数学月考试题及答案.doc
2023-2024学年福建省厦门市九年级上学期数学月考试题及答案.doc 2021-2022学年辽宁省沈阳市大东区九年级上学期语文期末试题及答案.doc
2021-2022学年辽宁省沈阳市大东区九年级上学期语文期末试题及答案.doc 2022-2023学年北京东城区初三第一学期物理期末试卷及答案.doc
2022-2023学年北京东城区初三第一学期物理期末试卷及答案.doc 2018上半年江西教师资格初中地理学科知识与教学能力真题及答案.doc
2018上半年江西教师资格初中地理学科知识与教学能力真题及答案.doc 2012年河北国家公务员申论考试真题及答案-省级.doc
2012年河北国家公务员申论考试真题及答案-省级.doc 2020-2021学年江苏省扬州市江都区邵樊片九年级上学期数学第一次质量检测试题及答案.doc
2020-2021学年江苏省扬州市江都区邵樊片九年级上学期数学第一次质量检测试题及答案.doc 2022下半年黑龙江教师资格证中学综合素质真题及答案.doc
2022下半年黑龙江教师资格证中学综合素质真题及答案.doc