2016 浙江省绍兴市中考化学真题及答案
一、选择题
1.下列利用空气某成分物理性质的是(
)
A.氧气可以供给呼吸 B.氮气可以制造化肥
C.干冰用于人工降雨 D.稀有气体用作保护气
【答案】C
【解析】
试题分析:A、氧气可以供给呼吸,需要通过化学变化才表现出,是利用了其化学性质,故
选项错误。B、氮气可以制造化肥,需要通过化学变化才表现出,是利用了其化学性质,故
选项错误。C、干冰用于人工降雨,是利用了干冰升华吸热的性质,不需要发生化学变化就
能表现出,是利用了其物理性质,故选项正确。D、稀有气体用作保护气,是利用了稀有气
体化学性质稳定的性质,需要通过化学变化才表现出,是利用了其化学性质,故选项错误。
故选 C。
考点:化学性质与物理性质的差别及应用
2.如图实验说明,燃烧需要的条件是(
)
A.有可燃物 B.有助燃剂
C.温度达到可燃物的着火点 D.可燃物与火焰直接接触
【答案】C
【解析】物质燃烧需要三个条件:可燃物、达到着火点、与氧气接触,所以装置中火柴头
燃烧,是因为与空气接触,并达到着火点;火柴梗是可燃物,与空气接触,没有燃烧,是
因为没有达到着火点,所以说明燃烧的条件之一是温度达到着火点,故选 C。
考点:燃烧与燃烧的条件
3.现有 10 克 CuO 和 nO 的混合物,下列实验方案,不能确定 CuO 质量分数的是(
)
A.将混合物与足量 H2 充分反应,冷却后测出剩余固体质量
B.将混合物与足量 CO 充分反应,反应后的气体通入足量的 NaOH 溶液中,测出 NaOH 溶液
质量的增加值
�
C.将混合物完全溶于稀 H2SO4,加入足量铁粉,充分反应后,过滤、洗涤、干燥,测出剩
余固体质量
D.将混合物完全溶于稀 H2SO4,加入足量 NaOH 溶液,过滤、洗涤、干燥,测出剩余固体质
量
【答案】C
【解析】
试题分析:A、设 CuO 和 FeO 的物质的量分别为 mol、ymol,则有 80+72y=10g,64+65y=剩
余固体质量,可以计算出 CuO 质量分数,故选项错误。B、混合物在高温下通入足量 CO 气
体,反应后的气体通入足量的 NaOH 溶液中,测出 NaOH 溶液质量的增加值(即为生成二氧
化碳的质量),设 CuO 和 FeO 的物质的量分别为 mol、ymol,则有 80+72y=10g,( + )mol
×44g/mol=二氧化碳的质量,可以计算出 CuO 质量分数,故选项错误。C、氧化铜、氧化锌
与稀硫酸反应分别生成硫酸铜、硫酸锌溶液,加入足量铁粉,铁能与硫酸铜溶液反应生成
硫酸亚铁溶液和铜,铁不与硫酸锌溶液反应,但铁粉足量,反应后有剩余,无法确定生成
铜的质量,不能计算出 CuO 质量分数,故选项正确。D、氧化铜、氧化锌与稀硫酸反应分别
生成硫酸铜、硫酸锌溶液,加入足量 NaOH 溶液,分别生成氢氧化铜、氢氧化锌沉淀,与 A、
B 选项同理,可以计算出 CuO 质量分数,故选项错误。故选:C。
考点:化学实验方案设计与评价;一氧化碳的化学性质;酸的化学性质;氢气的化学性质
与燃烧实验
二、填空题
4.在一定条件下,甲和乙发生化学反应生成丙和丁,其反应的微观变化如图所示。
(1)物质甲中氮元素的化合价是。
(2)甲、乙、丙与丁中属于氧化物的是。
(3)该化学反应属于基本类型中的反应。
【答案】(1)﹣3
(2)丁(3)置换
�
考点:微粒观点及模型图的应用;从组成上识别氧化物;有关元素化合价的计算;反应类
型的判定
5.20℃时,向 3 个盛有 50 克水的烧杯中,分别加入一定质量的氯化钠,并充分溶解。
根据下表实验数据回答。
实验编号
加入氯化钠的质量(克)
溶液质量(克)
A
9
59
B
18
68
C
27
68
(1)实验所得 3 杯溶液中,属于不饱和溶液的是(选填编号)。
(2)若将 A 杯中的溶液稀释成溶质的质量分数为 0.9%的生理盐水,需加水克。
【答案】(1)A
(2)941
【解析】
考点:饱和溶液和不饱和溶液;用水稀释改变浓度的方法
三、实验题
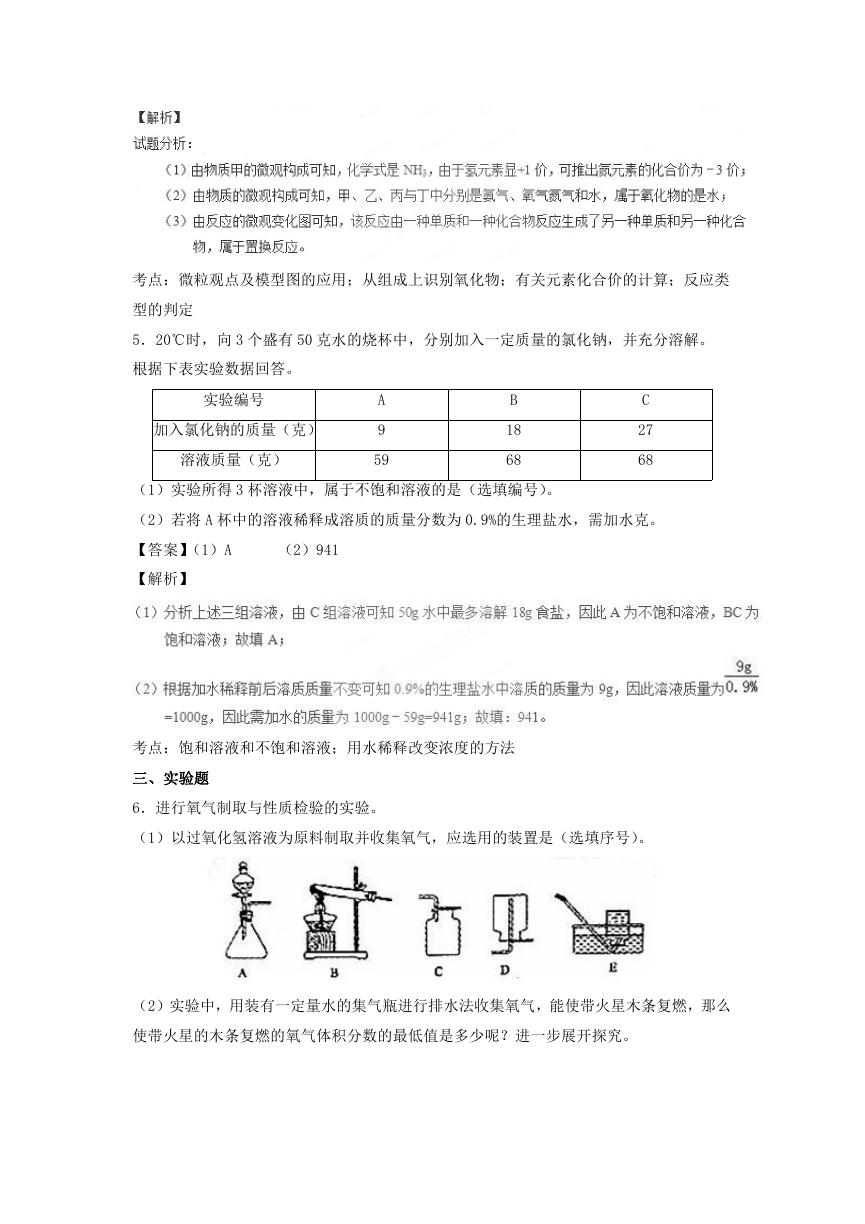
6.进行氧气制取与性质检验的实验。
(1)以过氧化氢溶液为原料制取并收集氧气,应选用的装置是(选填序号)。
(2)实验中,用装有一定量水的集气瓶进行排水法收集氧气,能使带火星木条复燃,那么
使带火星的木条复燃的氧气体积分数的最低值是多少呢?进一步展开探究。
�
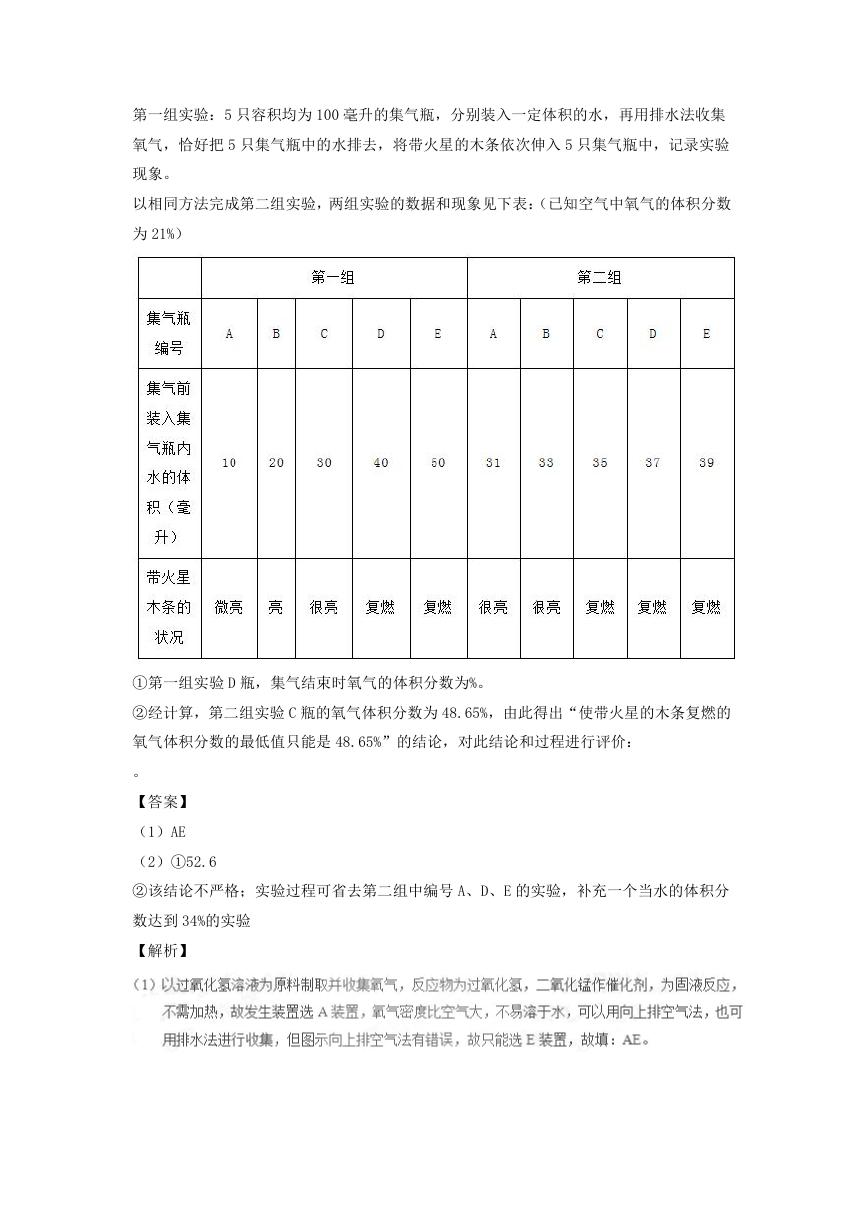
第一组实验:5 只容积均为 100 毫升的集气瓶,分别装入一定体积的水,再用排水法收集
氧气,恰好把 5 只集气瓶中的水排去,将带火星的木条依次伸入 5 只集气瓶中,记录实验
现象。
以相同方法完成第二组实验,两组实验的数据和现象见下表:(已知空气中氧气的体积分数
为 21%)
①第一组实验 D 瓶,集气结束时氧气的体积分数为%。
②经计算,第二组实验 C 瓶的氧气体积分数为 48.65%,由此得出“使带火星的木条复燃的
氧气体积分数的最低值只能是 48.65%”的结论,对此结论和过程进行评价:
。
【答案】
(1)AE
(2)①52.6
②该结论不严格;实验过程可省去第二组中编号 A、D、E 的实验,补充一个当水的体积分
数达到 34%的实验
【解析】
�
考点:氧气的制取装置;探究氧气的性质
7.兴趣小组实验中,将 NaOH 溶液滴入 CuSO4 溶液中,结果溶液中生成了浅绿色的固体。
于是,他们对该浅绿色固体的成分进行探究。
【查阅资料】
①NaOH 与 CuSO4 反应会生产 Cu(OH)2,也会生成 Cu4(OH)4S04(碱式硫酸铜)
②Cu(OH)2 在 80℃会分解生成 CuO
③Cu4(OH)4S04 不溶于水,能与酸反应,分解温度需 300℃
【猜想与假设】
猜想一:浅绿色固体为 Cu(OH)2
猜想二:浅绿色固体为
猜想三:浅绿色固体为 Cu(OH)2 和 Cu4(OH)4S04
【获取事实与证据】
①取少量浅绿色固体放入试管中,加热至 100℃,观察到黑色固体物质,说明浅绿色固体
中存在。
②另取少量浅绿色固体放入试管中,加入足量稀硝酸,再滴加 Ba(NO3)2 溶液,出现白色
沉淀,该白色沉淀是。
【结论】整个实验证明猜想正确。
【答案】
【猜想与假设】Cu4(OH)4S04
【获取事实与证据】①氢氧化铜
②硫酸钡
�
【结论】三
考点:实验探究物质的组成成分以及含量;碱的化学性质;盐的化学性质
四、解答题
8.我国科学家屠呦呦因为“发现青蒿素(化学式为 C15H22O5)﹣一种用于治疗疟疾的药物,
挽救了全球特别是发展中国家的数百万人的生命”而获得 2015 年诺贝尔生理学或医学
奖.磺胺(化学式为 C6H8N2O2S)是青蒿素之前最热门的抗疟药物之一。
回答下列问题:
(1)一个青蒿素分子中含有个原子。
(2)青蒿素中的氢元素与氧元素的质量比是。
(3)14.1 克青蒿素中含有碳元素的质量和多少克磺胺中含有碳元素的质量相等?
【答案】(1)42 (2)11:40 (3)21.5g
考点:元素质量比的计算;化合物中某元素的质量计算
9.某兴趣小组为了研究露置于空气中的纯净生石灰(CaO)变质情况,进行了如下实验:
①称取生石灰 25 克,将其露置于空气中。
②一段时间后,称量发现质量增加了 4 克。
�
③将变质的“生石灰”溶于足量的稀盐酸,产生的气体全部通过足量的浓硫酸后,再通入
足量的氢氧化钠溶液中,充分反应后称得氢氧化钠溶液的质量增加 2.2 克。
回答下列问题:
(1)变质的“生石灰”与稀盐酸反应生成二氧化碳的质量为克。
(2)组成变质的“生石灰”各成分质量为多少?
(3)生石灰露置于空气中质量增加的原因是,故实验室中的生石灰应保存。
【答案】
(1) 2.2
(2)氧化钙:16.6g;碳酸钙:5g;氢氧化钙:7.4g
(3)氧化钙能和空气中的水反应生成氢氧化钙,氢氧化钙能和空气中的二氧化碳反应生成
碳酸钙和水密封
【解析】
试题分析:
(1)氢氧化钠溶液质量增加的质量即为二氧化碳的质量,为 2.2g;
(2)设碳酸钙的质量为
CaCO3+2HCl═CaCl2+H2O+CO2↑
44
2.2g
100
=5g
设这些 CaCO3 是由质量为 y 的 CaO 转化而,
由 CaO+H2 O═Ca(OH)2,Ca(OH)2+CO2═CaCO3↓+H2O 可知,CaO~CaCO3,
CaO~CaCO3,
56
y
100
5g
y=2.8g
2.8g 氧化钙转化成 5g 碳酸钙后,固体质量增加:5g﹣2.8g=2.2g,因此氧化钙除部分转化
成碳酸钙外,还有一部分转化成氢氧化钙,
设转化成氢氧化钙的质量为,转化成氢氧化钙的氧化钙的质量为 m
CaO+H2 O═Ca(OH)2 固体质量增加
56
m
74
74﹣56=18
4g﹣2.2g=1.8g
�
,
=7.4g,m=5.6g
未变质的生石灰的质量为:25g﹣2.8g﹣5.6g=16.6g;
答:组成变质的“生石灰”各成分质量分别为:氧化钙:16.6g;碳酸钙:5g;氢氧化钙:
7.4g;
(3)生石灰露置于空气中质量增加的原因是:氧化钙能和空气中的水反应生成氢氧化钙,
氢氧化钙能和空气中的二氧化碳反应生成碳酸钙和水;因此,实验室中的生石灰应密封保
存
考点:根据化学反应方程式的计算;生石灰的性质与用途
10.绍兴市获得 2015 年度全省“五水共治”工作优秀市并被授予大禹鼎,“五水共治”是
指治污水、防洪水、排涝水、保供水、抓节水,还社会一个蓝天碧水,为百姓创造美好的
生活环境。
某化工厂流程会产生澄清废水,其中可能含有的离子是 Ag+、Cu2+、Cl﹣、NO3
﹣,已知:白色
的沉淀 Fe(OH)2 在空气中会迅速转化为红褐色的 Fe(OH)3。
(1)取少量废水,加入过量稀盐酸,产生白色沉淀;再加入过量氢氧化钠溶液,产生蓝色
沉淀。该废水中含有的金属离子是。
(2)兴趣小组设计了一个除去该废水中原有金属离子的实验方案,部分流程如图所示。
操作 I 的名称是,单质 A 是。
【答案】
(1)Ag+、Cu2+、NO3
﹣
(2)过滤
Fe
考点:常见离子的检验方法及现象;过滤的原理、方法及其应用;金属的化学性质
�














 2023年江西萍乡中考道德与法治真题及答案.doc
2023年江西萍乡中考道德与法治真题及答案.doc 2012年重庆南川中考生物真题及答案.doc
2012年重庆南川中考生物真题及答案.doc 2013年江西师范大学地理学综合及文艺理论基础考研真题.doc
2013年江西师范大学地理学综合及文艺理论基础考研真题.doc 2020年四川甘孜小升初语文真题及答案I卷.doc
2020年四川甘孜小升初语文真题及答案I卷.doc 2020年注册岩土工程师专业基础考试真题及答案.doc
2020年注册岩土工程师专业基础考试真题及答案.doc 2023-2024学年福建省厦门市九年级上学期数学月考试题及答案.doc
2023-2024学年福建省厦门市九年级上学期数学月考试题及答案.doc 2021-2022学年辽宁省沈阳市大东区九年级上学期语文期末试题及答案.doc
2021-2022学年辽宁省沈阳市大东区九年级上学期语文期末试题及答案.doc 2022-2023学年北京东城区初三第一学期物理期末试卷及答案.doc
2022-2023学年北京东城区初三第一学期物理期末试卷及答案.doc 2018上半年江西教师资格初中地理学科知识与教学能力真题及答案.doc
2018上半年江西教师资格初中地理学科知识与教学能力真题及答案.doc 2012年河北国家公务员申论考试真题及答案-省级.doc
2012年河北国家公务员申论考试真题及答案-省级.doc 2020-2021学年江苏省扬州市江都区邵樊片九年级上学期数学第一次质量检测试题及答案.doc
2020-2021学年江苏省扬州市江都区邵樊片九年级上学期数学第一次质量检测试题及答案.doc 2022下半年黑龙江教师资格证中学综合素质真题及答案.doc
2022下半年黑龙江教师资格证中学综合素质真题及答案.doc