中国科技论文在线
http://www.paper.edu.cn
棉花对盐分不同分布响应#
赵远伟1,李存东1,谢志霞2,3**
(1. 河北农业大学农学院,河北省保定市 071000;
2. 中国科学院农业水资源重点实验室,石家庄 050001;
3. 中国科学院遗传与发育生物学研究所农业资源研究中心,石家庄 050001)
摘要: 以冀棉 958 为试验材料,利用 MS 双层培养基模拟田间盐分在垂直方向的不均衡分
布条件,研究根区盐分不同分布对棉花生长的影响及其抗氧化系统的生理机制。结果表明:
在培养体系内高盐浓度条件下,盐分集中分布在下层的处理棉花幼苗的株高、根长、鲜重等
生物量显著高于盐分均衡分布整个培养体系,其叶片中的 SOD、POD 和 CAT 活性均显著高
-含量显著减少,膜质过氧化程度(MDA)显著降低,保
于盐分均衡分布体系,H2O2 和 O2
护细胞膜的完整性并减少了根尖细胞死亡率明显。本研究结果对于重盐碱地治理及棉花的耕
作栽培具有重要的指导意义。
关键词:棉花;耐盐;盐分不均衡分布
中图分类号:Q945.78
The Response of Cotton to Salt in Different Distribution
ZHAO Yuanwei1, LI Cundong1, XIE Zhixia2,3
(1. College of Agronomy, Agricultural University of Hebei,Hebei Baoding 071000;
2. Key Laboratory of Agricultural Water Resources, Chinese Academy of Sciences;
3. Center for Agricultural Resources Research, Institute of Genetics and Developmental
Biology,Shijiazhuang 050001 )
Abstract: The aim of this research was to reveal the physiological mechanism of cotton response
to salinity, through investigating the growth, physiological indexes and root morphology, by using
J958 as experiment material, grown in double layer MS medium mimicing nonuinform salt
distribution in the vertical direction of soil.Results show that under the condition of the cultivation
system in high salt concentration, salt concentration distribution in the processing of cotton
seedling plant height, root length, fresh weight of biomass salt is significantly higher than the
equilibrium distribution of the whole culture system, the leaves of SOD, POD and CAT activity
-
were significantly higher than that of salt equilibrium distribution system, contents of H2O2 and O2
significantly reduced, membranous peroxide level (MDA), significantly reduced, protect the
integrity of the cell membrane and mortality significantly reduced the root tip cells.The results for
heavy saline-alkali land management and cotton farming culture has important guiding
significance.
Key words: cotton; salt tolerance;nonuinform salt distribution
0 引言
棉花是耐盐性较强的作物之一,是盐碱地的先锋作物。较低浓度的盐分对棉花的生长发
育不但没有不利影响,还有促进作用。但是当盐分大于 0.4%时,对棉花的生长起抑制作用。
同其它非生物因子胁迫一样,盐分胁迫所致伤害的大致过程是:盐胁迫导致生理干旱、离子
毒害和营养失调,然后进一步影响棉花正常的生理生化代谢,最终影响棉花的生长发育,导
致棉花的生物学产量和经济产量下降[1]。
基金项目:国家自然科学基金(31101096)
作者简介:赵远伟(1988—),女,硕士研究生,主要研究方向:作物高产优质的生态生理研究
通信联系人:李存东(1964-),男,教授,主要研究方向:作物栽培生理. E-mail: nxylcd@hebau.edu.cn
- 1 -
5
10
15
20
25
30
35
40
45
�
50
55
60
65
70
75
80
中国科技论文在线
http://www.paper.edu.cn
植物在正常新陈代谢活动中和不利的环境条件下均会产生破坏植物膜系统的活性氧自
由基,同时生物体经过长期进化形成了完善和复杂的酶类和非酶类抗氧化保护系统来清除活
性氧[2]。研究表明在盐胁迫下,棉花可通过提高保护酶活性而表现出一定的耐盐伤害能力。
棉花体内 SOD 等保护酶活性的变化对于保持细胞质膜的相对稳定性具有重要作用,它们既
是盐害程度的反映,又是耐盐性强弱的标志[3]。SOD、CAT 和 POD 等活性越高,越能有效
地清除活性氧,抑制膜质中丙二醛的积累,维持细胞膜的稳定性和完整性。众所周知,盐碱
地盐分在土壤耕层的分布是不均匀的,很容易造成棉花根系处在不同盐浓度的环境中。董合
忠等研究发现,在根区盐分总量相等的情况下,盐分差异分布较均匀分布可明显减少Na+
在棉花体内的积累,而增加对K+的吸收,可明显减轻盐害的发生。但在根区盐分不均衡分
布条件下研究棉花耐盐机理报道较少。本试验利用 MS 双层培养体系,研究根区盐分不均衡
分布下棉花耐盐机理的影响。
1 材料和方法
1.1 供试材料
冀棉 958 用 20%过氧化氢溶液消毒 4 小时,无菌水清洗五次至无大量气泡,用无菌水
将种子浸泡在小烧杯中封口。将封好口的烧杯置于培养箱中,温度控制在 25℃~28℃,遮
光。选择露白一致的种子,将种皮去除,播种于四分之一 MS 双层培养基中,每瓶大概 12
粒。置于培养箱中,温度控制在 28℃±1,萌发期对种子进行遮光处理,每日观察长势,至
子叶展开。试验设三个处理:对照组 CK/CK,1/4 MS 培养基;盐分不均衡分布 CK/S,下
层含 0.6M/L NaCl;盐分均衡分布 S/S。苗龄为 7 天时进行生物量测定和观察根尖死细胞,
叶片和根用液氮速冻后置于-80℃冰箱保存。
1.2 生理指标测定
生物量测定:取苗龄 7 天的幼苗,测定其株高、主根长及根、茎、叶鲜重,将测过鲜重
的根、茎、叶放入烘箱进行杀青处理。即把样品放入 105℃的鼓风烘箱内烘 30min。在将温
度调至 80℃,烘干。测定其干重。
抗氧化酶活性测定:称取0.5g叶片置研钵中,加入5ml 4℃下预冷的浓度为50mmol pH 7.0
的磷酸缓冲液(内含1%聚乙烯比咯烷酮)和少量石英砂研磨成匀浆后,转入10ml试管中,
在4℃冰箱中静置10min,在15000rpm下冷冻离心25min,上清液即为酶提取液,每个处理做
三个重复。4℃保存备用。SOD 活性的测定采用NBT( 氮蓝四唑) 光化还原法[4];以抑制NBT
光化还原50% 的酶量为1个酶活力单位;CAT 活性的测定采用愈伤木酚比色法[5]; 过氧化
氢酶活性的测定采用紫外分光光度法[6]。
丙二醛(MDA)含量的测定:参考 Qing and Bing (2004)方法[7],取 0.5 g 鲜叶,加入 2 ml
10% 的三氯乙酸,研磨至匀浆,5,000 g 离心 10 min,吸取 2 ml 上清液(对照加 2 ml 蒸馏
水),加入 2 ml 0.6% 硫代巴比妥酸,混匀后于沸水浴上加热 15 min,迅速冷却后再次离心,
取上清液于 520 nm、600 nm 和 450 nm 波长时测吸光值。含量的计算如下:
MDA (µ mol/L) = 6.45 ×(A532-A600) -0.56× A450
活性氧含量的测定:氧负离子测定(O2
-)方法:根据 Verma and Mishra (2005)方法[8]:
取 0.5g 经液氮处理过的叶片,冰浴条件下用 50 mM 的磷酸缓冲液(pH =7.8)4 ml 提取,
-产生速率。H2O2 含量的测定方法参考
4 ºC 条件下 12,000 g 离心 15 min,取上清测定 O2
Verma and Mishra (2005)方法[8],冰浴条件下研磨,加入 100mM 磷酸缓冲液(pH=7.8,含
- 2 -
�
中国科技论文在线
http://www.paper.edu.cn
85
1% PVP)提取,4 ºC 条件下 12,000 g 离心 20 min,上清液即为提取液。
根尖细胞凋亡观察:碘化丙啶(PI)碧云天公司的 ST511。购买到的 PI 为红色粉末状,用
50mM pH 7.4 的 PBS 溶解定容至 5mg/ml 的母液, 4℃遮光保存,每次使用时用蒸馏水稀释
至所需浓度。将根尖浸没在 5μg/ml 的 PI 染液中,室温遮光染 5min。之后用蒸馏水洗去外面
残留的染液,在紫外荧光显微镜的 546nm 波长下观察。每个处理至少做 10 重复。
90
1.3 数据分析
结果建立在至少 3 组独立试验基础之上,所有试验数据均采用 SPSS 软件进行误差和显
著性分析(P<0.05)。
2 结果与分析
2.1 盐分分布对棉花生物量的影响
95
从表 1 可知,受盐胁迫条件下棉苗的生长量受到明显抑制,盐分不均衡分布比均衡分布
的受抑制程度轻,且差异显著。受盐胁迫下棉苗的含水率下降,CK/S 比 S/S 下降的少,且
根与叶中的含水率要高于对照组。
100
Tab.1 Effects of different salt distribution on biomass and moisture content in cotton seedlings
表 1 盐分不同分布对棉花幼苗生长量和含水率的影响
处理
Conduct
CK/CK
CK/S
S/S
株高
Stem
根长
Root
length/cm
length/cm
3.08a
2.71a
1.94b
7.58a
6.17b
3.33c
鲜重 Fresh weight/g
叶
Leaf
0.26a
0.24b
0.17c
茎
Stem
0.13 a
0.13a
0.10b
根
Root
0.06 a
0.05 b
0.03 c
含水率 Moisture content/%
根
Root
93.95
94.07
93.29
茎
Stem
93.26
91.29
90.18
叶
Leaf
89.03
91.30
85.57
注:同一列内不同字母表示在 5%水平差异显著(P<0.05)。
Note: Different letters in every column indicate significant differences at 5% level (P<0.05).
2.2 活性氧含量
盐分不均衡分布和均衡分布的叶片氧自由基含量和过氧化氢含量都高于对照组,其中
105
CK/S和S/S在氧自由基含量差别不大,但S比CK/S的过氧化氢含量高(图1)。
Fig.1 Effects of different salt distribution on reactive oxygen species content in cotton seedlings
图 1 盐分不同分布对棉花幼苗活性氧含量的影响
- 3 -
�
中国科技论文在线
http://www.paper.edu.cn
2.3 盐分不同分布对棉花幼苗叶片抗氧化酶活性的影响
盐胁迫对不同的抗氧化酶活性有不同的影响。植株在生长到第7天时,CK/S的棉花幼苗
叶片中的超氧化物歧化酶(SOD)活性显著低于对照组。S/S的棉花幼苗叶片中的SOD活性
保持较高水平,分别高于对照组及CK/S 15%和47%(图2A)。过氧化物酶(POD)在盐胁迫
下活性显著升高。CK/S高于对照组34%,S/S高于对照组58%(图2B)。过氧化氢酶(CAT)
活性在盐胁迫下有一定程度的升高,CK/S高于对照组25%,S/S高于对照组10%(图2C)。
110
115
Fig.2 Effects of different salt distribution on antioxidant enzyme activity in cotton seedlings
图 2 盐分不同分布对棉花幼苗抗氧化酶活性的影响
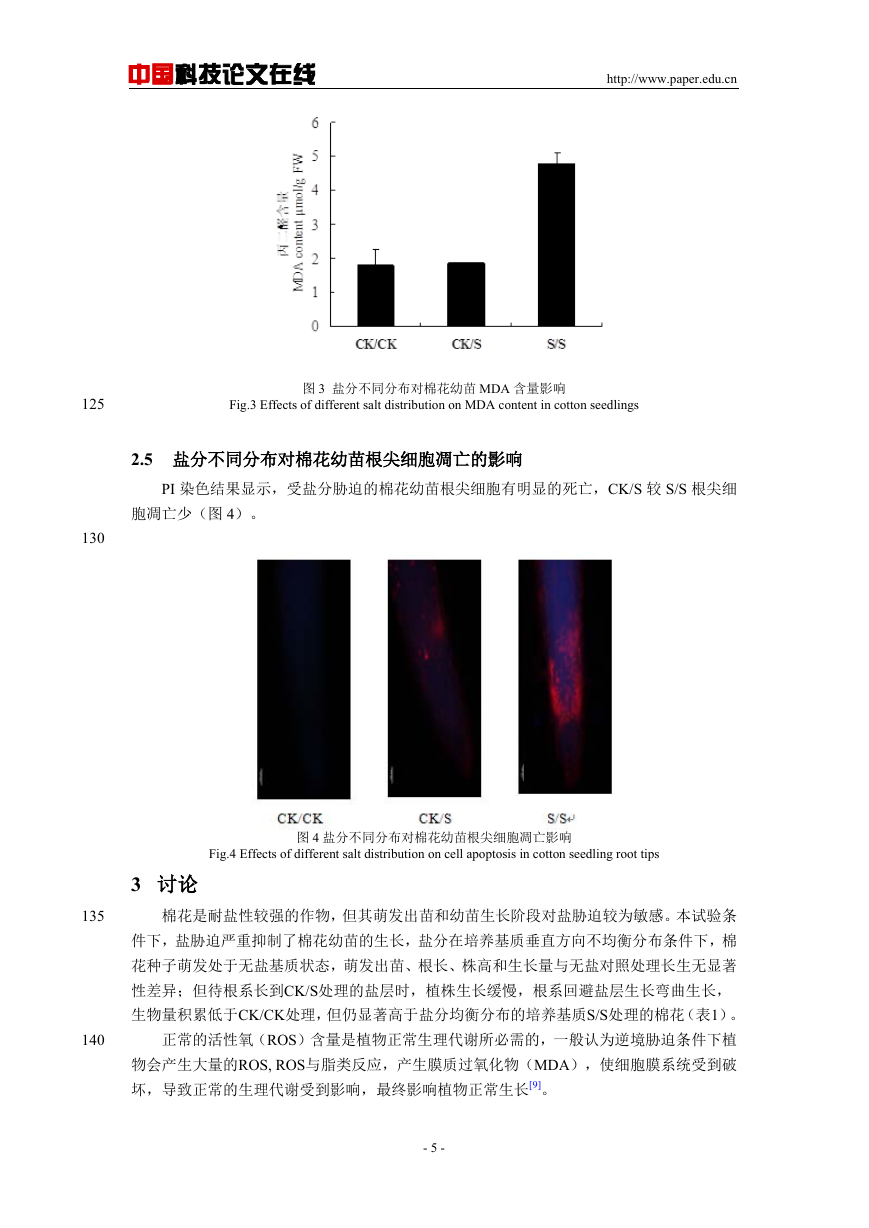
2.4 盐分不同分布对棉花幼苗叶片 MDA 含量的影响
120
与对照相比,在盐分均衡分布条件下棉花幼苗叶片中的MDA含量显著升高,是对照组
的2.7倍。而盐分不均衡分布条件下的MDA含量与正常生长叶片的水平几乎相等(图3)。
- 4 -
�
中国科技论文在线
http://www.paper.edu.cn
125
图 3 盐分不同分布对棉花幼苗 MDA 含量影响
Fig.3 Effects of different salt distribution on MDA content in cotton seedlings
2.5 盐分不同分布对棉花幼苗根尖细胞凋亡的影响
PI 染色结果显示,受盐分胁迫的棉花幼苗根尖细胞有明显的死亡,CK/S 较 S/S 根尖细
胞凋亡少(图 4)。
130
图 4 盐分不同分布对棉花幼苗根尖细胞凋亡影响
Fig.4 Effects of different salt distribution on cell apoptosis in cotton seedling root tips
3 讨论
135
140
棉花是耐盐性较强的作物,但其萌发出苗和幼苗生长阶段对盐胁迫较为敏感。本试验条
件下,盐胁迫严重抑制了棉花幼苗的生长,盐分在培养基质垂直方向不均衡分布条件下,棉
花种子萌发处于无盐基质状态,萌发出苗、根长、株高和生长量与无盐对照处理长生无显著
性差异;但待根系长到CK/S处理的盐层时,植株生长缓慢,根系回避盐层生长弯曲生长,
生物量积累低于CK/CK处理,但仍显著高于盐分均衡分布的培养基质S/S处理的棉花(表1)。
正常的活性氧(ROS)含量是植物正常生理代谢所必需的,一般认为逆境胁迫条件下植
物会产生大量的ROS, ROS与脂类反应,产生膜质过氧化物(MDA),使细胞膜系统受到破
坏,导致正常的生理代谢受到影响,最终影响植物正常生长[9]。
- 5 -
�
145
150
155
160
165
170
175
180
185
中国科技论文在线
http://www.paper.edu.cn
抗氧化酶活性的提高是活性氧自由基增加和胁迫条件下减少氧伤害保护系统建立的标
志[10],其中酶系统主要SOD、CAT 和POD等。不同的抗氧化酶协同作用共同抵抗盐分胁迫
所诱导的氧化伤害,单一的抗氧化酶不足以防御这种氧化胁迫。SOD是植物抗氧化系统的关
- 生成破坏力
键酶,它能催化超氧阴离子自由基发生歧化反应,生成O2和H2O2,避免由·O2
更强大的羟自由基。由SOD催化生成的过H2O2可以在体内进一步被过氧化氢酶(CAT)通
[11]。CAT 主要存在于过氧化物
过催化双电子转移的氧化还原分解为无毒害作用的H2O2和O2
酶体、乙醛酸循环体和线粒体中。CAT只能专一性的清除H2O2,且为包括棉花在内的C3植物
在逆境条件下清除H2O2所必需的关键酶[12]。过氧化物酶(POD)能够反应植物的代谢状况和
对环境的适应性。POD的作用具有双重性,表现为在逆境或衰老初期可清除H2O2,起到保护
植物细胞的作用;而在逆境或衰老后期,则参与活性氧的生成,引发膜脂过氧化,起到加速
植物细胞衰老死亡的作用[13]。MDA 是植物脂质过氧化的产物,可与细胞膜上的蛋白质和酶
结合, 引起蛋白质分子内和分子间的交联从而使酶失活, 破坏生物膜的结构和功能。是检验
植物生物膜伤害的一个重要的指标, 其含量可以表示脂膜过氧化的程度[14]。
本试验发现,S/S中棉花叶片中的H2O2含量显著高于CK/S中的棉花叶片,而O2
-含量差异
不显著;相应的SOD高于CK/S中的棉花。说明S/S处理中棉花体内可能产生了大量的ROS,
-在较低的水平;虽然S/S处理棉
诱导SOD保持较高的活性,分解O2
花中的POD活性显著高于CK/S,而专一性清除H2O2的酶CAT在S/S处理的棉花叶片中活性低
于CK/S,这可能是S/S处理中棉花体内H2O2高于CK/S的原因之一;此外,由于POD酶作用的
双重性,其一方面清除H2O2,另一方面引发膜脂过氧化,因此S/S处理棉花叶片中较高的POD
活性可能是导致叶片膜质过氧化程度(MDA含量)较重的原因之一。膜质过氧化程度加剧,
导致正常的新陈代谢失调,根尖细胞死亡率增加。
-产生大量的H2O2,维持O2
总之,培养基质中高浓度盐均衡分布对棉花萌发和幼苗生长具有显著的抑制作用,在总
盐量相同的情况下,使盐分集中分布在培养基质下层,有利于棉花的萌发和幼苗生长。棉花
根系主动避盐生长使根系处于含盐量较低的基质中生长,与盐在生长基质中均衡分布相比,
不均衡分布处理减少了活性氧的生成,降低了活性氧对棉花幼苗的胁迫,膜质过氧化程度降
低,维护了细胞膜的稳定性,减少了根尖细胞的死亡率,从而缓解了盐害,提高了棉花幼苗
的生物量积累。本结果对于重盐碱地棉花栽培具有重要的理论指导意义。
[参考文献] (References)
[1] 辛承松,董合忠,唐薇,等. 棉花盐害与耐盐性的生理和分子机理研究进展[J]. 棉花学报,2005,17(5):
309-313.
[2] SAIRAM PK,Tyagi A. Physiology and molecular biology of salinity stress tolerance in plants [J].Current Sci,
2004,86(3):407-421.
[3] 马丽,侯振安,梁永超,等.NaCl 胁迫对棉花幼苗生理特性的影响[J] .石河子大学学报(自然科学版),
2008,26(2);180-184.
[4] 李合生. 植物生理生化实验原理和技术[M] . 北京:高等教育出版社,2000.
[5] 张宪政. 植物生理学实验指导[M]. 沈阳:辽宁科学技术出版社,1994.
[6] 邹 奇. 植物生理学指导[M]. 北京:中国农业出版社,2000.
[7] Qing ZX, Bing RH. Antioxidant metabolism associated with summer leaf senescence and turf quality decline
for creeping bentgrass [J].Crop Sci 2004, 44: 553-560.
[8] Verma S, Mishra SN. Putrescine alleviation of growth in salt stressed Brassica juncea by inducing antioxidative
defense system[J]. J Plant Physiol 2005; 162: 669-77.
[9] Xie ZX, Duan LS, Tian XL, Wang BM, Eneji AE, Li ZH. Coronatine alleviates salinity stress in cotton by
improving
radical-scavenging activity[J]. J Plant Physiology,
2008;165:375-384.
[10] Meloni D A, Oliva M A, Martinez C A, et al. Photosynthesisand activity of superoxide dismutase, peroxidase
the antioxidative defense system and
- 6 -
�
中国科技论文在线
http://www.paper.edu.cn
190
195
and glutathionereductase in cotton under salt stress[ J] . Environ ExpBot, 2003, 49: 69- 76.
[11] 王伟,孙谧,刘万顺.单功能过氧化氢酶的高级结构[J].中国生物化学与分子生物,2008,24(3):197-202.
[12] Willekens H, Langebartels C, Tiré C, et al. Differential expression of catalase genes in Nicotiana
plumbaginifolia (L.) [J]. Proceedingsof the national academy of sciences of the United States of America,1994,
91(22):10450-10454.
[13] 陶丽华,周青.农业环境保护中的酸雨监测技术[J].中国农业生态学报,2006,14(4):34-37.
[14] 王邦锡,黄久常,王 辉.不同植物在不同水分条件胁迫下脯氨酸的积累与抗性的关系[J].植物生理学报,
1992,15(1):46-51.
- 7 -
�













 2023年江西萍乡中考道德与法治真题及答案.doc
2023年江西萍乡中考道德与法治真题及答案.doc 2012年重庆南川中考生物真题及答案.doc
2012年重庆南川中考生物真题及答案.doc 2013年江西师范大学地理学综合及文艺理论基础考研真题.doc
2013年江西师范大学地理学综合及文艺理论基础考研真题.doc 2020年四川甘孜小升初语文真题及答案I卷.doc
2020年四川甘孜小升初语文真题及答案I卷.doc 2020年注册岩土工程师专业基础考试真题及答案.doc
2020年注册岩土工程师专业基础考试真题及答案.doc 2023-2024学年福建省厦门市九年级上学期数学月考试题及答案.doc
2023-2024学年福建省厦门市九年级上学期数学月考试题及答案.doc 2021-2022学年辽宁省沈阳市大东区九年级上学期语文期末试题及答案.doc
2021-2022学年辽宁省沈阳市大东区九年级上学期语文期末试题及答案.doc 2022-2023学年北京东城区初三第一学期物理期末试卷及答案.doc
2022-2023学年北京东城区初三第一学期物理期末试卷及答案.doc 2018上半年江西教师资格初中地理学科知识与教学能力真题及答案.doc
2018上半年江西教师资格初中地理学科知识与教学能力真题及答案.doc 2012年河北国家公务员申论考试真题及答案-省级.doc
2012年河北国家公务员申论考试真题及答案-省级.doc 2020-2021学年江苏省扬州市江都区邵樊片九年级上学期数学第一次质量检测试题及答案.doc
2020-2021学年江苏省扬州市江都区邵樊片九年级上学期数学第一次质量检测试题及答案.doc 2022下半年黑龙江教师资格证中学综合素质真题及答案.doc
2022下半年黑龙江教师资格证中学综合素质真题及答案.doc