2015 浙江省温州市中考化学真题及答案
姓名:
准考证号:
亲爱的同学:
欢迎参加考试!请你认真审题,积极思考,细心答题,发挥最佳水平。答题时,请注意以下
几点:
1.全卷共 8 页,有四大题,34 小题。全卷满分 180 分。考试时间 120 分钟。
2.答案必须写在答题纸相应的位置上,写在试题卷、草稿纸上均无效。
3.答题前,认真阅读答题纸上的《注意事项》,按规定答题。
4.本卷可能用到的相对原子质量:H-1
C-12
O-16
Ca-40
祝你成功!
卷 I
一、选择题(本题有 15 小题,每小题 4 分,共 60 分。每小题只有一个选项是正确的,不选、多选、
错选均不给分)
3.氚是氢的一种同位素,氚原子含有 1 个质子和 2 个中子。下列示意图能正确表示氚原子结
构的是
6.钛(Ti)是一种广泛应用于航空、航天等领域的重要金属。工业上制钛的化学方程式为:
TiCl4 + 2Mg
A.化合反应
高温
Ti + 2MgCl2 ,该反应属于
B.分解反应
C.置换反应
D.复分解反应
11.在研究空气成分的历史上,许多科学家做了大量的研究。下列是普利斯特利在研究中收集到的
各种气体及当时的名称,这些气体中氮元素化合价为零的是
A.“亚硝蒸气”(NO2)
C.“减缩的亚硝空气”(N2O)
B.“亚硝空气”(NO)
D.“燃素化空气”(N2)
二、填空题(本题有 9 小题,每空 2 分,共 40 分)
卷 Ⅱ
20.用如图所示的玻璃管进行碳还原氧化铜实验。
(1)当 A 处的黑色固体变红时,可观察到 B 处的现象是 ▲ 。
(2)查阅资料发现:反应生成的红色固体除了铜以外还可能含有氧
氧化铜与碳
A
化亚铜(Cu2O),氧化亚铜可以与硫酸发生如下反应:
Cu2O+H2SO4
△
Cu+CuSO4+X,该反应中 X 的化学式为 ▲ 。
21.苯甲酸钠(C7H5O2Na)是一种常用的食品防腐剂,常温下为白色固体,
易溶于水,水溶液呈弱碱性。
(1)根据上述信息,写出苯甲酸钠的一种物理性质: ▲ 。
B
澄清石灰水
(第 20 题图)
�
(2)苯甲酸钠中碳、氢元素的质量比为 ▲ 。
(3)我国批准了 32 种允许使用的食品防腐剂,同时规定了这些食品防腐剂的安全使用量与
使用范围。但少数厂家违规使用食品防腐剂,影响了食品安全。下列是四位同学对待
食品的一些观点,其中合理的有 ▲ 。(可多选)
22.运用酸、碱、盐的性质可以解决工业生产中的许多问题。
(1)工业上常选用 ▲ 来除去铁锈。(写出一种具体物质)
(2)某工厂向含有 AgNO 3、Cu(NO 3) 2 的废水中加入一定量的锌粉(Zn)以回收金属,充分
反应后,得到的金属组成可能有哪几种情况? ▲ 。
三、实验探究题(本题有 4 小题,每空 3 分,共 36 分)[来源:学科网]
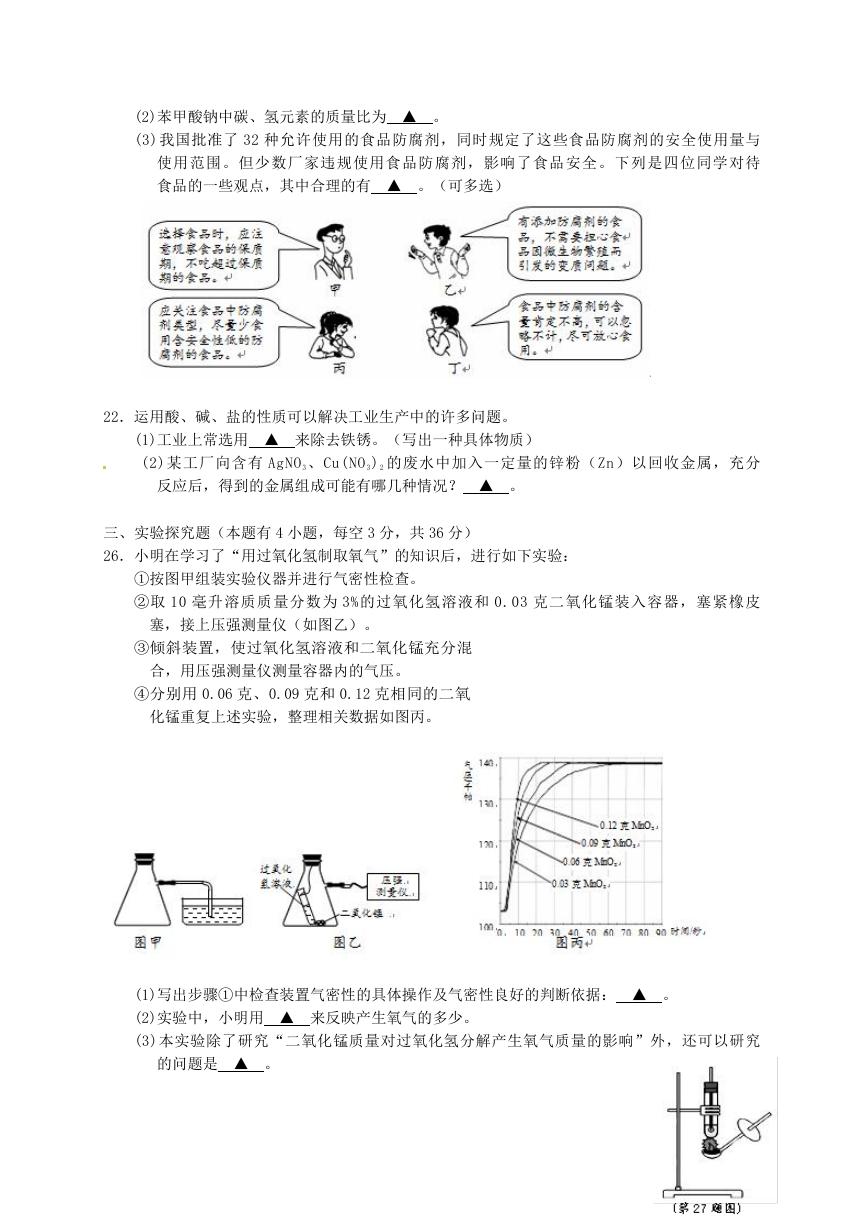
26.小明在学习了“用过氧化氢制取氧气”的知识后,进行如下实验:
①按图甲组装实验仪器并进行气密性检查。
②取 10 毫升溶质质量分数为 3%的过氧化氢溶液和 0.03 克二氧化锰装入容器,塞紧橡皮
塞,接上压强测量仪(如图乙)。
③倾斜装置,使过氧化氢溶液和二氧化锰充分混
合,用压强测量仪测量容器内的气压。
④分别用 0.06 克、0.09 克和 0.12 克相同的二氧
化锰重复上述实验,整理相关数据如图丙。
(1)写出步骤①中检查装置气密性的具体操作及气密性良好的判断依据: ▲ 。
(2)实验中,小明用 ▲ 来反映产生氧气的多少。
(3)本实验除了研究“二氧化锰质量对过氧化氢分解产生氧气质量的影响”外,还可以研究
的问题是 ▲ 。
[来源:Z_xx_k.Com]
�
四、解答题(本题有 6 小题,第 29 题 5 分,第 30 题 6 分,第 31 题 7 分,第 32 题 7 分,第 33 题
10 分,第 34 题 9 分,共 44 分)
31.温州产盐历史悠久,盐产品在日常生活、工业生产中有广泛用途。
(1)用下图方法可进行粗盐提纯,其中操作②的名称为 ▲ 。
粗盐
①溶解
②
悬浊液
泥沙
滤液
③蒸发
精盐
(2)海水晒盐过程中,还能得到氯化镁(MgCl2)。工业上利用氯化镁在通电条件下分解,获
得镁和氯气(Cl2)。写出这一反应的化学方程式: ▲ 。
(3)腌制咸鸭蛋需要合适溶质质量分数的食盐水。现有 10 千克溶质质量分数为 25%的食
盐水,若将其稀释到 20%,需加水多少千克?
33.小明为了测定某钙片中碳酸钙的质量分数,用如图装置进行如下实验:
①取研碎后的钙片 4 克,倒入气密性良好的锥形瓶中,然后在分液漏斗中加入适量的稀盐
酸,置于电子天平上测出装置总质量。
②打开活塞,滴入足量稀盐酸后关闭活塞,待气泡不再冒出时,测出反应后装置总质量。
③整理相关数据如下表,计算出钙片中碳酸钙的质量分数。
稀盐酸
干燥剂
钙片粉末
电子天平
反应前总质量(克)
反应后总质量(克)
反应前后质量差(克)
容器内气体质量差(克)
275.58
274.92
0.66
m
(1)该实验中,对装置中的固态干燥剂的性质有何要求? ▲ 。
(2)反应前容器内是空气(密度为ρ1),反应后全部是 CO2(密度为ρ2)。则反应前后容
器(容积为 V)内的气体质量差 m为 ▲ 。(用字母表示,反应物的体积忽略不计)
(3)小明查阅有关数据后,计算出反应前后容器内的气体质量差 m为 0.22 克,结合表中数
据,计算该钙片中碳酸钙的质量分数。(CaCO3 + 2HCl = CaCl2 + H2O + CO2↑,钙片
中的其它成分不与盐酸反应)
�
�
�
�











 2023年江西萍乡中考道德与法治真题及答案.doc
2023年江西萍乡中考道德与法治真题及答案.doc 2012年重庆南川中考生物真题及答案.doc
2012年重庆南川中考生物真题及答案.doc 2013年江西师范大学地理学综合及文艺理论基础考研真题.doc
2013年江西师范大学地理学综合及文艺理论基础考研真题.doc 2020年四川甘孜小升初语文真题及答案I卷.doc
2020年四川甘孜小升初语文真题及答案I卷.doc 2020年注册岩土工程师专业基础考试真题及答案.doc
2020年注册岩土工程师专业基础考试真题及答案.doc 2023-2024学年福建省厦门市九年级上学期数学月考试题及答案.doc
2023-2024学年福建省厦门市九年级上学期数学月考试题及答案.doc 2021-2022学年辽宁省沈阳市大东区九年级上学期语文期末试题及答案.doc
2021-2022学年辽宁省沈阳市大东区九年级上学期语文期末试题及答案.doc 2022-2023学年北京东城区初三第一学期物理期末试卷及答案.doc
2022-2023学年北京东城区初三第一学期物理期末试卷及答案.doc 2018上半年江西教师资格初中地理学科知识与教学能力真题及答案.doc
2018上半年江西教师资格初中地理学科知识与教学能力真题及答案.doc 2012年河北国家公务员申论考试真题及答案-省级.doc
2012年河北国家公务员申论考试真题及答案-省级.doc 2020-2021学年江苏省扬州市江都区邵樊片九年级上学期数学第一次质量检测试题及答案.doc
2020-2021学年江苏省扬州市江都区邵樊片九年级上学期数学第一次质量检测试题及答案.doc 2022下半年黑龙江教师资格证中学综合素质真题及答案.doc
2022下半年黑龙江教师资格证中学综合素质真题及答案.doc