2020 年上海普通高中会考化学真题及答案
一、选择题
1. 以下处理废塑料不符合环保理念的是(
)
A. 制备垃圾袋等产品
C. 催化热解形成小分子有机物
【答案】D
2. 关于锂电池的叙述正确的是(
)
A. 电能转化 为 化学能
C. 不可循环充电使用
【答案】B
B. 用于发电
D. 直接填埋
B. 电容量大,质量轻
D. 废旧锂电池是干垃圾
3. 下列元素中,在自然界只能以化合态形式存在的是(
)
B. 氮元素 C. 硫元素
D. 氯元素
A. 碳元素
【答案】D
4. 下列微粒中电子数大于质子数的是(
)
A. H3O+
B. O2﹣
C. 18
8 O
D.
【答案】B
5. 通过甲烷分子的球棍模型不能得出的信息是(
)
A. C﹣H 的共用电子对偏向 C 原子
B. 正四面体结构
C. 非极性分子
【答案】A
D. 二氯取代物只有一种
6. 常温下,将铁片放到浓硫酸中,下列叙述正确的是(
)
A. 溶液呈黄色
B. 铁片变轻
C. 铁片表面产生大量气泡
�
D. 铁片表面产生致密的氧化膜
【答案】D
7. 将 SO2 通入含有 I2 的淀粉溶液中,体现 SO2 的(
)
B. 还原性
C. 氧化性
D. 酸性
A. 漂白性
氧化物
【答案】B
8. 某种植物适合在碱性土壤中生长,若将其种植在酸性土壤中,则应该添加的化肥是
(
)
A. KCl
(NH4)2CO3
【答案】B
B. K2CO3
C. NH4Cl
D.
9. 关于 75%酒精的叙述正确的是(
)
A. 能够消毒、杀菌
B. 必须避光保存
C. 在空气中易氧化变质
D. 可直接用于制乙烯
【答案】A
10. 如图所示,下列叙述正确的是(
)
A. 生成物能量总和大于反应物能量总和
B. 生成 2mol H2O(l)要吸收 571.6kJ
C. 2H2O(g)=2H2(g)+O2(g)﹣571.6kJ
D. 2H2(g)+O2(g)=2H2O(l)+Q
Q<571.6kJ
【答案】C
11. 下列化工生产中,能产生 H2 的是(
)
A. 氯碱工业
B. 合成氨工业
C. 硫酸工业
D. 纯碱
�
工业
【答案】A
12. 下列关于实验室制取乙炔的描述错误的是(
)
A. 不能用启普发生器
B. 反应的化学方程式是 CaC2+2H2O=Ca(OH)2+C2H2↑
C. 可以用酸性高锰酸钾溶液除去 H2S 杂质
D. 可以用排水法收集
【答案】C
13. 下列对于判断溶液是否部分变质所选用的试剂正确的是(
)
A
B
C
D
目标溶液 Na2SO3
FeSO4
KI
NaOH
选用试剂 BaCl2
KSCN
AgNO3 广泛 pH 试纸
A. A
【答案】B
B. B
C. C
D. D
14. 已知:8NH3+3Cl2═N2+6NH4Cl,该反应可以检查管道少量的氯气泄漏,下列叙述正确的
是(
)
A. 可以检验氯气泄漏的现象是产生无色气体
B. NH4Cl 既是氧化产物又是还原产物
C. 被氧化的 NH3 占全部 NH3 的 25%
D. 转移 0.3mol 电子,生成气体 6.72L 氮气(标准状况下)
【答案】C
15. 丙烯二聚体 CH2=CHCH2CH (CH3)2 是合成“人工肺”(ECMO)设备膜丝的原料重要原料,
下列关于丙烯二聚体说法正确的是(
)
A. 加聚产物可以使溴水褪色
B. 与
互为同分异构体
C. 催化加氢生成产物的一氯代物有 4 种
D. 完全燃烧与等质量丙烯耗氧量相同
【答案】D
�
16. 实验室提供的玻璃仪器有试管、导管、烧杯、酒精灯、玻璃棒等,选用上述仪器(其它
非玻璃仪器及必要试剂任选)能完成的实验是(
)
A. 粗盐提纯
C. 海带提碘
【答案】B
B. 乙酸乙酯制取
D. 硫酸铜晶体中结晶水含量测定
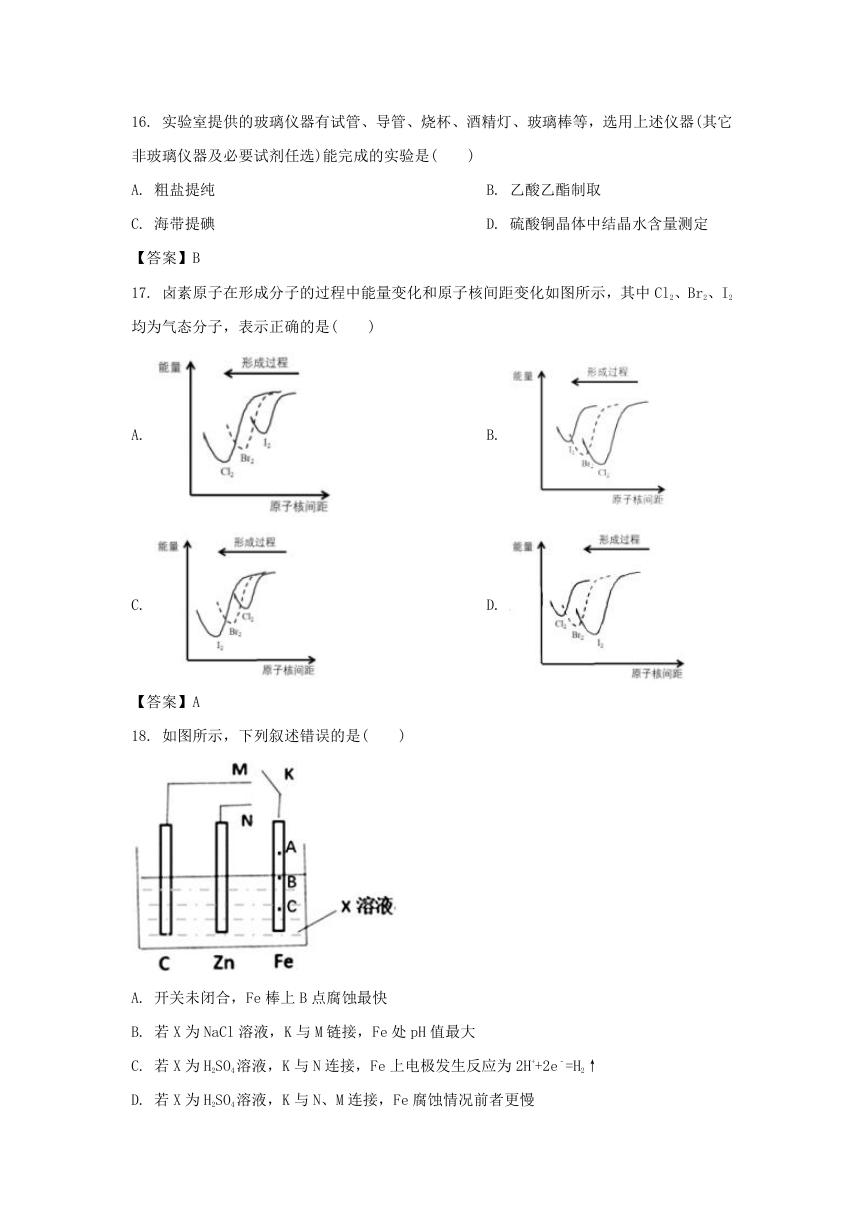
17. 卤素原子在形成分子的过程中能量变化和原子核间距变化如图所示,其中 Cl2、Br2、I2
均为气态分子,表示正确的是(
)
A.
C.
B.
D.
【答案】A
18. 如图所示,下列叙述错误的是(
)
A. 开关未闭合,Fe 棒上 B 点腐蚀最快
B. 若 X 为 NaCl 溶液,K 与 M 链接,Fe 处 pH 值最大
C. 若 X 为 H2SO4 溶液,K 与 N 连接,Fe 上电极发生反应为 2H++2e﹣=H2↑
D. 若 X 为 H2SO4 溶液,K 与 N、M 连接,Fe 腐蚀情况前者更慢
�
【答案】B
19. 25℃向 10.0mL 0.1mol/L 的 NaOH 溶液中滴入 VmL 0.1mol/L 的一元酸 HA。下列选项一
定正确的是(
)
A. V<10 时,[Na+]>[A﹣]>[OH﹣]>[H+]
B. V=10 时,[HA]>[OH﹣]
C. 10<V<20,水的电离度随 V 的增大而增大
D. V=20 时,[A﹣]﹣[HA]=2[H+]﹣2[OH﹣]
【答案】D
20. 下列关于可逆反应 A(?)+2B(s)⇌ C(g)﹣Q 叙述正确的是(
)
A. 当反应达到平衡之后,气体摩尔质量不变,则反应达到平衡状态
B. 平衡后,恒温下扩大容器体积,再次平衡后气体密度一定减小
C. 平衡后,恒容下升高温度,再次平衡后气体中 C 的体积分数可能减少
D. 平衡后,恒温恒容下,通入气体 C,气体 C 的浓度可能不变
【答案】D
二、综合分析题
21. 长征五号 B 运载火箭中使用了耐热性佳,导热性好的氮化铝陶瓷。已知:
Al4C3+4NH3=4AlN+3CH4。回答下列问题:
(1)碳原子核外电子中未成对电子数是_____,氨气的电子式是_____。
(2)AlN 是由共价键直接形成的晶体,硬度大、熔点高,它是_____晶体。上述反应中形成相
同电子层结构离子的元素,其简单离子半径由大到小的顺序是_____。
(3)比较非金属性 N>C 正确的是_____
a.HNO3 酸性大于 H2CO3
b.N 最高价为+5,C 最高价为+4
c.HNO3 氧化性大于 H2CO3
d.H3C﹣NH2 中 C﹣N 共用电子对偏向 N
(4)AlN 遇水会发生水解,反应的化学方程式为:_____,AlN 在 80℃和 90℃水中完全水解,
测得水解后溶液的 pH(80℃)>pH(90℃),试从平衡移动角度解释其原因:_____。 (不考虑
水的离子积变化和 Al(OH)3 电离)。
(5)向 Al(OH)3悬浊液中加入 NaOH 溶液至沉淀恰好完全溶解,写出反应的离子方程式:_____。
�
溶液中 c(Na+)_____c(AlO 2
) (填“>”或“<”),欲使 c(Na+):c(AlO 2
)=1:1,可加入
_____。
【答案】
(1). 2
(2).
(3). 原子
(4). N3﹣>Al3+
(5). ad
(6). AlN+4H2O⇌ Al(OH)3+NH3•H2O
(7). 上述水溶液中存在 NH3+H2O⇌ NH3•H2O⇌ NH4
++OH﹣,
溶液温度升高,会使 NH3•H2O 分解生成氨气,从水中逸出,导致平衡向左移动,使 c(OH﹣)
减小,溶液的 pH 减小,故 pH(80℃)>pH(90℃)
(8). Al(OH)3+OH﹣=AlO2
﹣+2H2O
(9). >
(10). KAlO2 或 KOH
22. 乙烯氯氧化法是当今世界上制备聚氯乙烯单体的最先进的方法。已知:2CH2=
CH2(g)+4HCl(g)+O2(g)→2ClCH2CH2Cl(g)+2H2O(g)。
(1)容器体积为 2L,起始气体总物质的量为 1mol,10min 后,气体总物质的量仅为 70%,则
CH2=CH2 反应速率为_____。
(2)ClCH2CH2Cl(g)⇌ CH2=CHCl(g)+HCl(g),如图为 ClCH2CH2Cl 的转化率α与温度和压强的关
系。则平衡常数表示为 K=_____,根据图象判断 P1_____P2(填“>”、“<”或“=”),该
反应为_____反应(填“吸热或放热”)。
(3)工业上,可用氯气与碱反应制取消毒剂:
Cl2+2NaOH=NaCl+NaClO+H2O
3Cl2+6NaOH(热)=5NaCl+NaClO3+3H2O
①上述两个反应都是放热反应,工业上欲制备高纯度的次氯酸钠型消毒剂,需要控制温度,
采取的措施可以是_____(请设计一个方案)。
②消毒剂的消毒效率常用有效氯的含量来表示,有效氯含量的实质就是指单位质量的含氯
化合物中所含氧化态氯的氧化能力相当于多少纯净氯气的氧化能力。具体分析中,也可以
采用消毒液在酸性条件下所放出的游离氯(Cl2)的质量与原消毒剂质量之比来表示有效氯。
则上述过程中制得的高纯度次氯酸钠型消毒剂,其有效氯为_____。
(4)配平下列化学方程式方程式:
�
__NH 4
+__ClO﹣=__N2+__Cl﹣+__H2O+__H+,_____
(5)溶液中 NH 4
检验的方法是_____。
【 答 案 】
(1). 0.01mol/(L• min)
(2).
c CH =CHCl c(HCl)
2
c ClCH CH Cl
2
(3). <
2
(4). 吸热
失
(6).
(5). 采用冰水冷却,或在设备中增加冷却装置,使反应产生的热量及时散
71
133
(8). 取少量待测液试样于试
++3ClO-=N2+3Cl-+3H2O+2H+
(7). 2NH4
管中,滴加浓氢氧化钠溶液,加热,若产生的气体能使湿润的红色试纸变蓝色,则说明原
溶液中含有 NH 4
离子
23. 广谱抗菌药泰能的中间体 M(
)的合成路线如图:
已知:2
强 碱
(1)反应①试剂和条件是_____,反应②试剂和条件是_____。
(2)反应②的类型是_____,反应⑤的类型是_____。
(3)写出满足下列条件的 B 物质的同分异构体的结构简式_____。
①能发生银镜反应;②有碳碳双键;③有 6 个化学环境相同的氢原子。
检验该同分异构体中含有碳碳双键的试剂是_____。
(4)从最终产物推断反应④的目的是_____。
(5)结合题目中的相关信息,设计一条由 CH3CHO 制备 CH3CH=CHCOOH 的合成路线图_____(无
机试剂任选)。(合成路线常用的表示方式为:A
B……
反应试剂
反应条件
目
反应试剂
反应条件
�
标产物)
【答案】 (1). H2O、催化剂、加热
(2). O2、Cu 或 Ag、加热
(3). 氧化反应
(4).
取 代 反 应
(5).
、
、
、
、
(6). Br2 的
CCl4 溶 液
(7). 保 护 羧 基
(8).
24. 为探究碳酸氢钠溶液作为植物光合作用的碳源,进行如下实验
①配制 250mL 0.5mol/L NaHCO3 溶液;
②量取 100mL 0.5mol/L NaHCO3 溶液放入 B 瓶中;
③向装置 A 中通入空气,充分反应后,将 C 瓶中的沉淀经洗涤、干燥,称的质量为 0.197g
(1)配制 250mL 0.5mol/L NaHCO3 溶液需要的玻璃仪器为玻璃棒、胶头滴管、_____。A 瓶中
氢氧化钠溶液的作用是_____。
(2)反应结束后,B 瓶溶液 pH_____(填“增大”、“减小”或“不变”),原因是_____。
(3)用题目中数据,求 NaHCO3 的分解率是_____。实验结果偏低的原因是_____。
a.B 瓶中有残留的 CO2
b.过滤时间偏长
c.沉淀未洗涤
d.沉淀烘干不完全
�














 2023年江西萍乡中考道德与法治真题及答案.doc
2023年江西萍乡中考道德与法治真题及答案.doc 2012年重庆南川中考生物真题及答案.doc
2012年重庆南川中考生物真题及答案.doc 2013年江西师范大学地理学综合及文艺理论基础考研真题.doc
2013年江西师范大学地理学综合及文艺理论基础考研真题.doc 2020年四川甘孜小升初语文真题及答案I卷.doc
2020年四川甘孜小升初语文真题及答案I卷.doc 2020年注册岩土工程师专业基础考试真题及答案.doc
2020年注册岩土工程师专业基础考试真题及答案.doc 2023-2024学年福建省厦门市九年级上学期数学月考试题及答案.doc
2023-2024学年福建省厦门市九年级上学期数学月考试题及答案.doc 2021-2022学年辽宁省沈阳市大东区九年级上学期语文期末试题及答案.doc
2021-2022学年辽宁省沈阳市大东区九年级上学期语文期末试题及答案.doc 2022-2023学年北京东城区初三第一学期物理期末试卷及答案.doc
2022-2023学年北京东城区初三第一学期物理期末试卷及答案.doc 2018上半年江西教师资格初中地理学科知识与教学能力真题及答案.doc
2018上半年江西教师资格初中地理学科知识与教学能力真题及答案.doc 2012年河北国家公务员申论考试真题及答案-省级.doc
2012年河北国家公务员申论考试真题及答案-省级.doc 2020-2021学年江苏省扬州市江都区邵樊片九年级上学期数学第一次质量检测试题及答案.doc
2020-2021学年江苏省扬州市江都区邵樊片九年级上学期数学第一次质量检测试题及答案.doc 2022下半年黑龙江教师资格证中学综合素质真题及答案.doc
2022下半年黑龙江教师资格证中学综合素质真题及答案.doc