2011 年广东省广州市中考化学真题及答案
可能用到的相对原子质量:H-l
C-l2
O-16 Mg- 24
S- 32
C1- 35. 5 Cu-64
一、选择置(本题包括 20 小题,每小题 2 分,共 40 分)
第一部分选择题(共 40 分)
注意:每道选择题有四个选项,其中只有一项符合题意。请用铅笔在答题卡上作答。选
错、不选、多选或涂改不清的.均不给分。
1.根据《广州市城市生活垃圾分类管理暂行规定》第十一条,我市居民生活垃圾分为可回
收物、餐厨垃圾、有害垃圾、其他垃圾四类。可回收物主要有以下四种,其成分属于有机合
成材料的是(
)
A.塑料
B.纸类
C.金属
D.玻璃
2.下列变化属于化学变化的是(
)
A.浓盐酸挥发,形成白雾
B.冰升华,形成白雾
C.镁条在空气中燃烧.产生自烟
D.水加热到沸腾.产生蒸汽
3.下列图示实验操作中,正确的是(
)
4.下列物质中属于盐的是(
)
A.NaOH
B.Na2O
C.Na2SO4
D.Na
5.下列过程不是通过化学变化获得能量的是(
)
A.利用炸药爆炸开山炸石
B.利用煤燃烧发电
C.利用汽油燃烧驱动汽车
D.利用水力发电
6.下列关于空气中各组成成分说法正确的是(
)
A.空气中的 O2 只有点燃时才能发生化学反应
B.空气中的 CO2 是导致酸雨的主要原因
C.空气中的 N2 可作为生产氮肥的原料
�
D.空气中的稀有气体没有任何使用价值
7 核电站中可用硼酸(H3BO3)吸收中子,阻断核辐射。硼酸中硼元素的化合价是(
)
A.+1
B.+2
C.+3
D+4
8.小烧杯中盛有含石蕊的氢氧化钠溶液.逐滴加入稀盐酸至过量,烧杯中溶液颜色变化的
顺序是(
)
A.紫色——红色——蓝色
B.蓝色——紫色——红色
C.蓝色——红色——紫色
D.紫色——蓝色——红色
9.下列方法可使海水转化为饮用水的是(
)
A.过滤
B.静置沉淀
C.活性炭吸附
D.蒸馏
10.下列关于 O2 和 CO2 的说法正确的是(
)
A.都含有氧元素
B.都是氧化物
C.都含有氧气分子
D.都能使带有火星的木条复燃
11.下列溶液 pH 最大的是(
)
A.10%KOH
B.20%KOH
C.10%HCI
D.20%HCl
12.下列说法正确的是(
)
A.CO2 能与血液中血红蛋白结合导致中毒
B.CO 能溶于水生成酸
C.用闻气味的方法能够区别 CO2 和 CO
D.CO 可以在 O2 中燃烧
13.下图是元素 x 的原子结构示意圈.下列说法正确的是(
)
A.该原子的核外电子数为 l2
B.该原子最外电子层达到了稳定结构
C.X 属于非金属元素
�
D.x 与 Cl 形成的化台物为 XCl
14.下列关于化肥的说法正确的是(
)
A.过磷酸钙[Ca(H2PO4)2 和 CaSO4 的混合物]属于氮肥
B.凡施用过化肥的蔬菜都会危害健康
C.硫酸钾与熟石灰混合、研磨,能闻到刺激性的气味
D.合理施用化肥能提高农作物的产量
15 下列物质能够反应,且没有明显现象的是(
)
A. Na2CO3 溶液加入澄清石灰水中
B. Fe2O3 加入 NaOH 溶液中
C.稀 HCl 滴入 Ba(OH)2 溶液中
D.CO2 通入澄清石灰水中
16.实验室用下图所示装置制取和收集 O2,下列操作不正确的是(
)
A.将 KClO3,和 MnO2 混合.用纸槽装入试管中
B.将导管口伸入盛满水的集气瓶里,然后加热,立即收集 O2
C.待集气瓶充满 O2,盖好玻璃片后,再移出水面
D.收集完成后,松开橡皮塞,再熄灭酒精灯
17.向 l00g10%NaOH 溶液中加入 12.5gNaOH 固体,完全溶解后.所得溶液中溶质质量分
数为(
)
A. 12. 5%
B.200%
C.22.5%D.25%
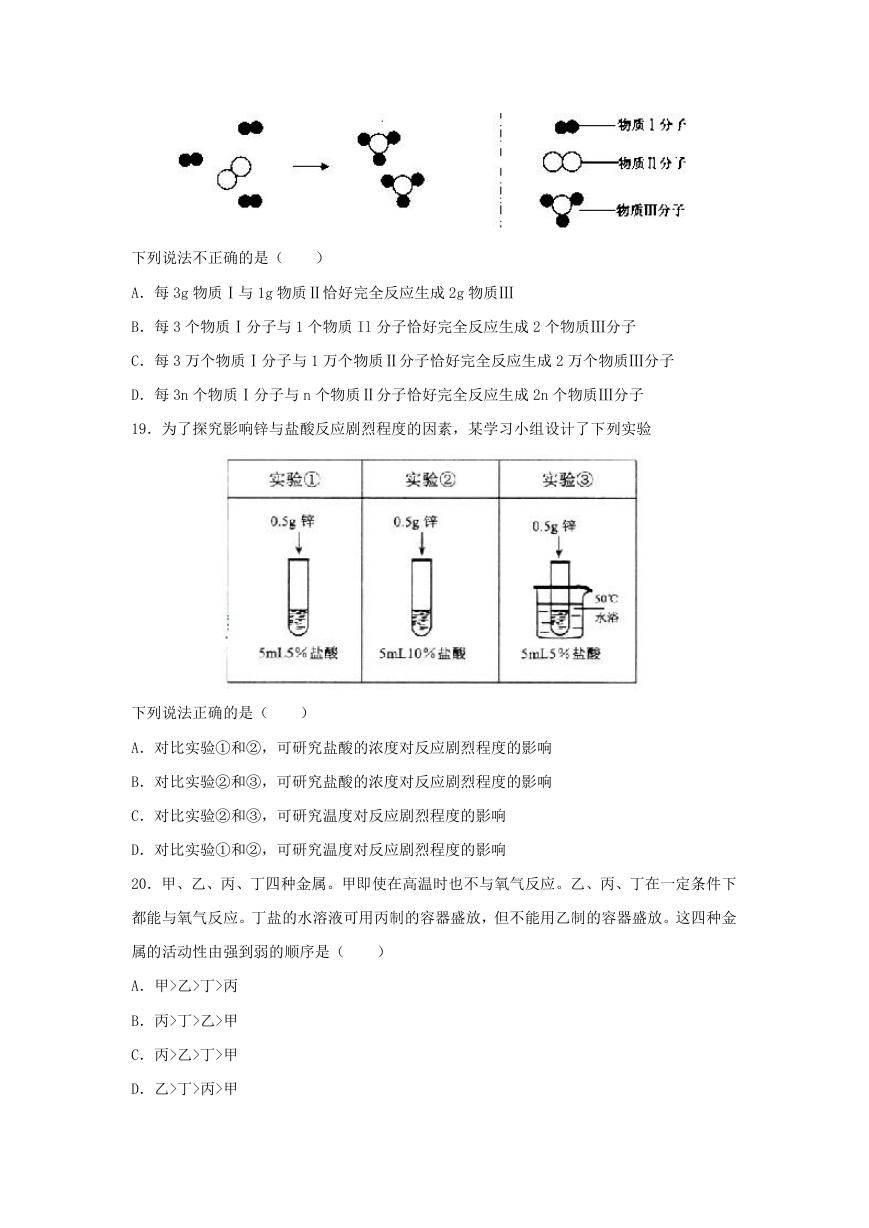
18.某化学反应的微观示意图如下,图中“ ”和“ ”分别表示不同的原子
�
下列说法不正确的是(
)
A.每 3g 物质Ⅰ与 1g 物质Ⅱ恰好完全反应生成 2g 物质Ⅲ
B.每 3 个物质Ⅰ分子与 1 个物质 Il 分子恰好完全反应生成 2 个物质Ⅲ分子
C.每 3 万个物质Ⅰ分子与 1 万个物质Ⅱ分子恰好完全反应生成 2 万个物质Ⅲ分子
D.每 3n 个物质Ⅰ分子与 n 个物质Ⅱ分子恰好完全反应生成 2n 个物质Ⅲ分子
19.为了探究影响锌与盐酸反应剧烈程度的因素,某学习小组设计了下列实验
下列说法正确的是(
)
A.对比实验①和②,可研究盐酸的浓度对反应剧烈程度的影响
B.对比实验②和③,可研究盐酸的浓度对反应剧烈程度的影响
C.对比实验②和③,可研究温度对反应剧烈程度的影响
D.对比实验①和②,可研究温度对反应剧烈程度的影响
20.甲、乙、丙、丁四种金属。甲即使在高温时也不与氧气反应。乙、丙、丁在一定条件下
都能与氧气反应。丁盐的水溶液可用丙制的容器盛放,但不能用乙制的容器盛放。这四种金
属的活动性由强到弱的顺序是(
)
A.甲>乙>丁>丙
B.丙>丁>乙>甲
C.丙>乙>丁>甲
D.乙>丁>丙>甲
�
二、本题包括 5 小题.共 31 分.
第二部分非选择题(共 60 分)
2l.(4 分)近日,有媒体报道面条可燃,一些市民据此担心面条中加入了不安全的添加剂。
⑴仅从面条可燃就判断加入了添加剂是不科学的,因为面粉含有的主要营养素淀粉本身是可
以燃烧的,淀粉的化学式为(C6H10O5)n,完全燃烧的产物是___________;燃烧过程中还可闻
到 像 头 发 烧 焦 似 的 刺 鼻 气 味 , 是 由 于 面 粉 中 另 一 种 营 养 素 燃 烧 产 生 的 , 该 营 养 索 是
____________。
⑵面粉不仅可以燃烧.一定条件下还会发生爆炸。2010 年 2 月我国某大型面粉厂灌装车间
发 生 面 粉 爆 炸 , 造 成 重 大 人 员 伤 亡 。 为 避 免 类 似 事 件 , 生 产 过 程 可 采 取 的 措 施 有
________________。
A.密封门窗,隔绝氧气
B.严禁吸烟,杜绝货源
C.轻拿轻放,减少粉尘扬起
D.提高淀粉的着火点
22.(5 分)一些物质的溶解度曲线如图,回答下列问题。
②原氧化铜的质量肝-_—g。
(1)70℃时,在 l00g 水中加入 ll0g 硝酸钾固体,所形成的溶液是______溶液(“饱和”或“不
饱和”)。
(2)将上述溶液降温到 l0℃时,析出的晶体质量是________g。
(3)工业上将硝酸钾和氯化钠的热混合溶液(两者
�
均己达到饱和)冷却至室温.析出晶体。
①析出的晶体中主要物质是_____________;
②关于剩余溶液.下列说法正确的是_________。
A.只含氯化钠,不含硝酸钾,且氯化钠达到饱和
B.含有氯化钠,又含有硝酸钾,且只有氯化钠达到饱和
C.含有氯化钠,叉含有硝酸钾,且两者都达到饱和
23.(7 分)Cu 可以形成化台价为+2 和+1 的化合物。其中+1 价化合物称为亚铜化合物。
(1)写出下列物质的化学式:氢氧化铜________,氧化亚铜___________
(2)高温时,氧化铜可被木炭还原为铜,反应的化学方程式是__________________________
(3)氧化亚铜是一种红色粉末。加热时,氧化亚铜能与氧气发生化合反应,反应的化学方程
式是___________;利用这一性质可检验氮气中是否含有氧气(装置如下图所示),判断氮中
含有氧气的现象是________________________。
24.(9 分)钢铁是使用最多的金属材料。
(1)生铁和钢都是铁合金,其中含碳量较高的是_______________。
(2)人们常用“铜墙铁壁”来形容物体的坚固.但铁在一定条件下也能发生各种反应,
如铁丝在氧气中燃烧,反应的化学方程式是__________________。
(3)将 mg 氧化铜加入稀硫酸中完全溶解后,再加入铁粉充分反应,过滤,得到滤渣 A
和滤液 B。再将滤渣 A 加入足量稀硫酸中,有气泡冒出,充分反应后,剩余固体物质的质量
为 12.8g
①滤渣的成分是__________,滤液 B 的成分是_________________。
②原氧化铜的质量 m=________________g。
25.(6 分)氯化钙在生活中常用作干燥剂、融雪剂,在工业上可用于制造防冻液等。某工厂
以石灰石为原料生产二水化钙(CaCl2·2H2O )的流程如下。原料石灰石中含有杂质主要是
�
MgCO 、
3
MgSO 和
4
2OAl 。
3
(1)石灰石粉溶解时,Al2O3 发生反应的化学方程式为______________。
(2)加入 BaCl2 除去的杂质离子是________________;加入 Ca(OH)2 除去的杂质离子
是________。
⑶检验“滤液”酸碱性,如果显碱性,还需加入适量的___________________(填化学式)提
高产品纯度。
三、本题包括 4 小篡,共 29 分。
26.(4 分)实验室常用排空气集气法收集干燥气体。下面是两种简易的排空气集气装置。用
编号填空:
(1)实验室收集 CO2 选用_____________,收集 O2 用___________。
(2)如果要收集 SO2 应选用________________,收集 CH4 选用______________。
27.(9 分)从海水中可以提取镁,其中的一个步骤是将卤水(含 MgCl2、NaCl、KCl 的混合
液)转化为氯化镁晶体。实验室中模拟该转化的过程如下,回答有关问题 a
(1)制备氢氧化镁:向卤水中加入适量生石灰(CaO),充分反应后过滤。
①该过程中发生了多个反应,其中会大量放热的反应是(填化学方程式)_________________
②过滤操作需用到的玻璃仪器除烧杯外,还有__________________________。
(2)制各氯化镁溶液:用盐酸溶解 Mg(OH)2。为了便于后续操作.盐酸不宜过量
①反应的化学方程式是_____________________________________。
②通过计算,可准确知道所需盐酸的量。理论上溶解 5.8gMg(OH)2 需要 36. 5%HCl 溶液
③由于准确称量 Mg(OH)2 的步骤繁琐,实验中并不常用,而是通过一定操作方法来达到
到控制盐酸用量的目的。操作是:将 Mg(OH)2 加入烧杯中,___________________________
直到 Mg(OH)2 完全溶解为止。
�
(3)制各氯化镁晶体:蒸发浓缩 MgCl2 溶液,冷却结晶
28.(8 分)某校“我与化学”活动小组通过查舞资料了解到,我国超市每年消耗约 40 万吨
塑料袋。假定这些使用后的废塑料袋都通过焚烧处理。将排放大量 CO2。该活动小组用下图
所示装置,测量一定质量塑料袋燃烧后产生的 CO2 的质量。
(1)为了保证测量的准确性,连接好实验装置后应检查________________________,再加入
药品进行实验。
(2)装置Ⅰ的小烧杯中加入足量 H2O2 和催化剂.可持续产生 O2 供塑料袋充分燃烧,产
生 O2 的化学方程式是__________________________。
(3)塑料袋燃尽,装置Ⅰ逐渐冷却时,装置Ⅱ中液体也不易倒吸进入装置Ⅰ中.原因是
___________________
(4)根据实验目的,需要称量的是_________。
A.实验前塑料袋的质量
B.实验前和实验后装置Ⅱ的质量
C.实验前和实验后装置Ⅲ的质量
29.(8 分)有三种白色粉末.分别是碳酸钡、硫酸钡和碳酸钠。请设计一个实验方案.把这
三种粉末区分开来。叙述实验操作、预期现象和结论。
(实验室仅提供了稀 HCl、Na2SO4 溶液、蒸馏水以及常用的实验仪器。)
实验操作
预期现象与结论
�















 2023年江西萍乡中考道德与法治真题及答案.doc
2023年江西萍乡中考道德与法治真题及答案.doc 2012年重庆南川中考生物真题及答案.doc
2012年重庆南川中考生物真题及答案.doc 2013年江西师范大学地理学综合及文艺理论基础考研真题.doc
2013年江西师范大学地理学综合及文艺理论基础考研真题.doc 2020年四川甘孜小升初语文真题及答案I卷.doc
2020年四川甘孜小升初语文真题及答案I卷.doc 2020年注册岩土工程师专业基础考试真题及答案.doc
2020年注册岩土工程师专业基础考试真题及答案.doc 2023-2024学年福建省厦门市九年级上学期数学月考试题及答案.doc
2023-2024学年福建省厦门市九年级上学期数学月考试题及答案.doc 2021-2022学年辽宁省沈阳市大东区九年级上学期语文期末试题及答案.doc
2021-2022学年辽宁省沈阳市大东区九年级上学期语文期末试题及答案.doc 2022-2023学年北京东城区初三第一学期物理期末试卷及答案.doc
2022-2023学年北京东城区初三第一学期物理期末试卷及答案.doc 2018上半年江西教师资格初中地理学科知识与教学能力真题及答案.doc
2018上半年江西教师资格初中地理学科知识与教学能力真题及答案.doc 2012年河北国家公务员申论考试真题及答案-省级.doc
2012年河北国家公务员申论考试真题及答案-省级.doc 2020-2021学年江苏省扬州市江都区邵樊片九年级上学期数学第一次质量检测试题及答案.doc
2020-2021学年江苏省扬州市江都区邵樊片九年级上学期数学第一次质量检测试题及答案.doc 2022下半年黑龙江教师资格证中学综合素质真题及答案.doc
2022下半年黑龙江教师资格证中学综合素质真题及答案.doc