2014 年四川省雅安市中考化学真题及答案
本试卷分为第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,全卷满分为 90 分。考试
时间:物理、化学共 150 分钟。
第Ⅰ卷(选择题 共 36 分)
注意事项:
1、答题前,考生务必将自己的姓名、准考证号及座位号用 0.5 毫米的黑色墨迹签字笔
填写在答题卡上。并检查条形码粘贴是否正确。
2、选择题使用 2B 铅笔涂在答题卡对应题目标号位置上;非选择题用 0.5 毫米黑色墨迹
签字笔书写在答题卡的对应框内,超出答题区域书写的答案无效;在草稿纸、试题卷上答题
无效。
3、考试结束后,将试题卷和答题卡收回。
计算可能用到的相对原子质量:H-1
C-12
O-16
Cl-35.5
Ca-40
Fe-56
Zn-65
选择题(本大题共 12 个小题,每小题 3 分;每小题只有一个选项符合题意,多选、错选均
不给分。)
1.下列物质的性质中,属于物理性质的是
A.稳定性
B.酸碱性
C.还原性
D.挥发性
2.下列含有“水”的物质中,属于纯净物的是
A.硬水
B.蒸馏水
C.矿泉水
D.自来水
3.将塑料袋密封良好的方便面从平原带到高原时,塑料袋鼓起,是因为袋内的气体分子
A.质量增大
B.个数增多
C.间隔增大
D.体积增大
4.衣服上沾有碘很难洗净,碘在下列四种不同溶剂中的溶解性如下表所示:
溶质
溶剂
溶解性
水
微溶
碘
酒精
可溶
汽油
易溶
苯(有毒)
易溶
由表中提供的信息判断,洗净衣服上的碘污渍的最佳选择是
A.水
B.酒精
C.汽油
D.苯
5.下列化学符号中的数字表示的意义不正确的是
A.NO2:“2”表示一个二氧化氮分子含有两个氧原子
�
B.2Na:“2”表示两个钠元素
2
Mg
C.
:“+2”表示镁元素的化合价为+2 价
D.2O H-:“2”表示两个氢氧根离子
6.粒子 M 通过一定方式转化为 N, 如右
M
+19
2 8 8 1
N
+19
2 8 8
图所示:
变化前后保持不变的是
A.核电荷数
B.带电情况
C.化合价
D.化学性质
7.下列物质加入水中,所得溶液 pH 可能为 10 的是
A.生石灰
B.白醋
C.桔子汁
D.食盐
8.偏钛酸钡(BaTiOx)因其显著的“压电效应”而广泛应用于超声波发生装置中。已知偏钛
酸钡中钛元素的化合价为+4 价,则其化学式中 x的数值是
A.1
B.2
C.3
D.4
9.下列物质的用途与性质不对应的是
A.食品包装中充氮气以防腐——常温下氮气的化学性质不活泼
B.一氧化碳用于冶炼金属——一氧化碳具有可燃性
C.稀有气体能制成多种用途的电光源——稀有气体在通电时发出不同颜色的光
D.干冰可用做制冷剂—— 干冰升华吸热
10.下列对有关主题知识的归纳错误的是
A.安全常识
B.元素与人体健康
室内煤气泄漏——立即打开排风扇
人体缺铁——易引起贫血
浓硫酸沾到到皮肤上——立即用水清洗
人体缺氟——易产生龋齿
C.生活常识
D.环保与物质的利用
洗涤剂洗去油污——乳化作用
减少白色污染——使用可降解塑料
煤炉取暖防中毒——开窗通风
减少汽车尾气污染——使用乙醇汽油
11.右图是 A、B、C三种固体物质的溶解度曲线。下列说
法错误的是
A.物质 A的溶解度随温度的升高而增大
B.t1℃时,物质 B的溶解度大于物质 A的溶解度
C.t1℃时,物质 A和物质 C的溶解度相等
溶
解
度
/g
A
B
C
t1
t2
温度/℃
�
D.将 t2℃时的物质 C 的饱和溶液降温到 t1℃时,溶液依然饱和
12.镧(La)是一种活动性比锌更强的元素,它的氧化物的化学式为 La2O3,La(OH)3 是不溶于
水的碱,而 LaCl3、La(NO3)3 都可溶于水。由此判断下列几组物质,不能直接反应制取
LaCl3 的是
A.La(OH)3 和 HCl
C.La 和 HCl
B .La2O3 和 HCl
D.NaCl 和 La(OH)3
第Ⅱ卷(非选择题 共 54 分)
注意:回答第Ⅱ卷时,只能用 0.5 毫米黑色墨迹签字笔书写在答题卡的对应框内,超出答题
区域书写的答案无效;在草稿纸、试题卷上答题无效。
13、(5 分)化学材料的发展和应用,推动了社会的进步。铁、铝、铜合金、棉花、塑料等
都是人们生活和生产中常见的材料。
(1)上述材料中,属于天然有机材料的是
▲ ;属于合成有机材料的是 ▲
。
(2)铁和铝能制成铁锅、铝锅等生活中常用的炊具。铁锅容易生锈,是因为与空气中的 ▲
和 ▲
反应;而铝锅表面易形成一层致密 ▲ (写化学式)薄膜,使铝锅不易
生锈,阻止铝进一步氧化。
14、(4 分)大米是我们餐桌上的主食,含淀粉约 80%。
(1)大米主要为我们提供的营养素是
▲
。
(2)某些地区因为工业污染使当地生产的大米含有超标的有毒元素镉,对人体的肺和
肾脏等造成损害。镉属于 ▲
(填“金属”或“非金属”)元素。
(3)为了提高大米产量,种植过程中需要施用适量的化肥。下列化肥属于复合肥料的
是 ▲
。
A、Ca3(PO4)2
B、NH4HCO3
C、NH4H2PO4
D、KCl
15、(6 分)燃烧是人类最早利用的化学反应之一。
(1)下面是一些常用的灭火方法的事例:
①熄灭酒精灯时,用灯帽盖灭;
②熄灭燃气灶火焰时,关闭阀门;
③油锅着火时,用锅盖盖灭;
④森林着火时,将大火蔓延线路前的一片树木砍掉;
⑤房屋着火时,用高压水枪灭火。
�
请你从灭火原理角度,选择一种分类标准进行分类:
分类标准
▲
包括事例
▲
(填序号)
(2)打火机中常用丁烷(C4H10)做燃料,丁烷与甲烷完全燃烧产物相同,请写出丁烷完
全燃烧的化学方程式
▲
。
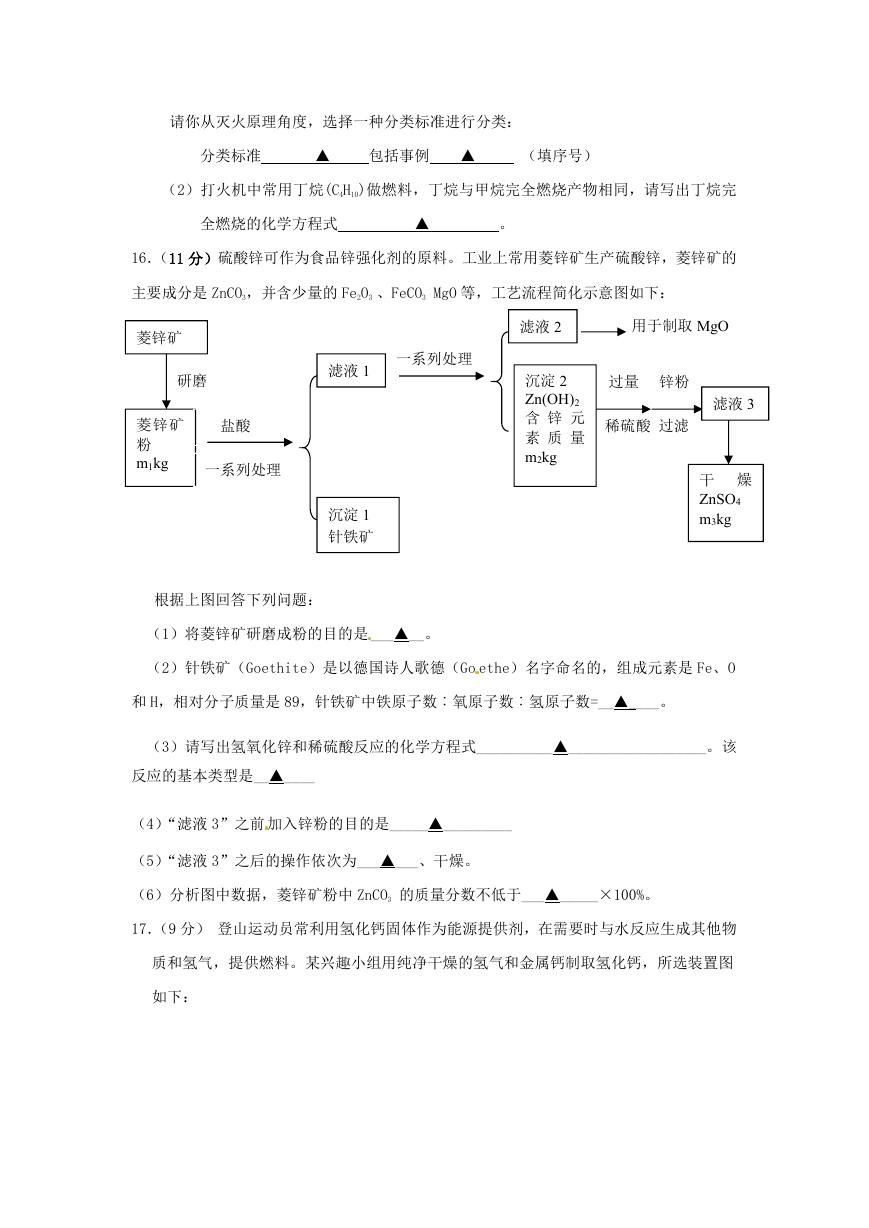
16.(11 分)硫酸锌可作为食品锌强化剂的原料。工业上常用菱锌矿生产硫酸锌,菱锌矿的
主要成分是 ZnCO3,并含少量的 Fe2O3 、FeCO3 MgO 等,工艺流程简化示意图如下:
菱锌矿
研磨
菱锌矿
粉
m1kg
盐酸
一系列处理
一系列处理
滤液 1
沉淀 1
针铁矿
滤液 2
用于制取 MgO
过量 锌粉
稀硫酸
过滤
滤液 3
沉淀 2
Zn(OH)2
含 锌 元
素 质 量
m2kg
干 燥
ZnSO4
m3kg
根据上图回答下列问题:
(1)将菱锌矿研磨成粉的目的是 ___▲__。
(2)针铁矿(Goethite)是以德国诗人歌德(Go ethe)名字命名的,组成元素是 Fe、O
和 H,相对分子质量是 89,针铁矿中铁原子数︰氧原子数︰氢原子数=__▲____。
(3)请写出氢氧化锌和稀硫酸反应的化学方程式__________▲__________________。该
反应的基本类型是__▲____
(4)“滤液 3”之前 加入锌粉的目的是_____▲_________
(5)“滤液 3”之后的操作依次为___▲___、干燥。
(6)分析图中数据,菱锌矿粉中 ZnCO3 的质量分数不低于___▲_____×100%。
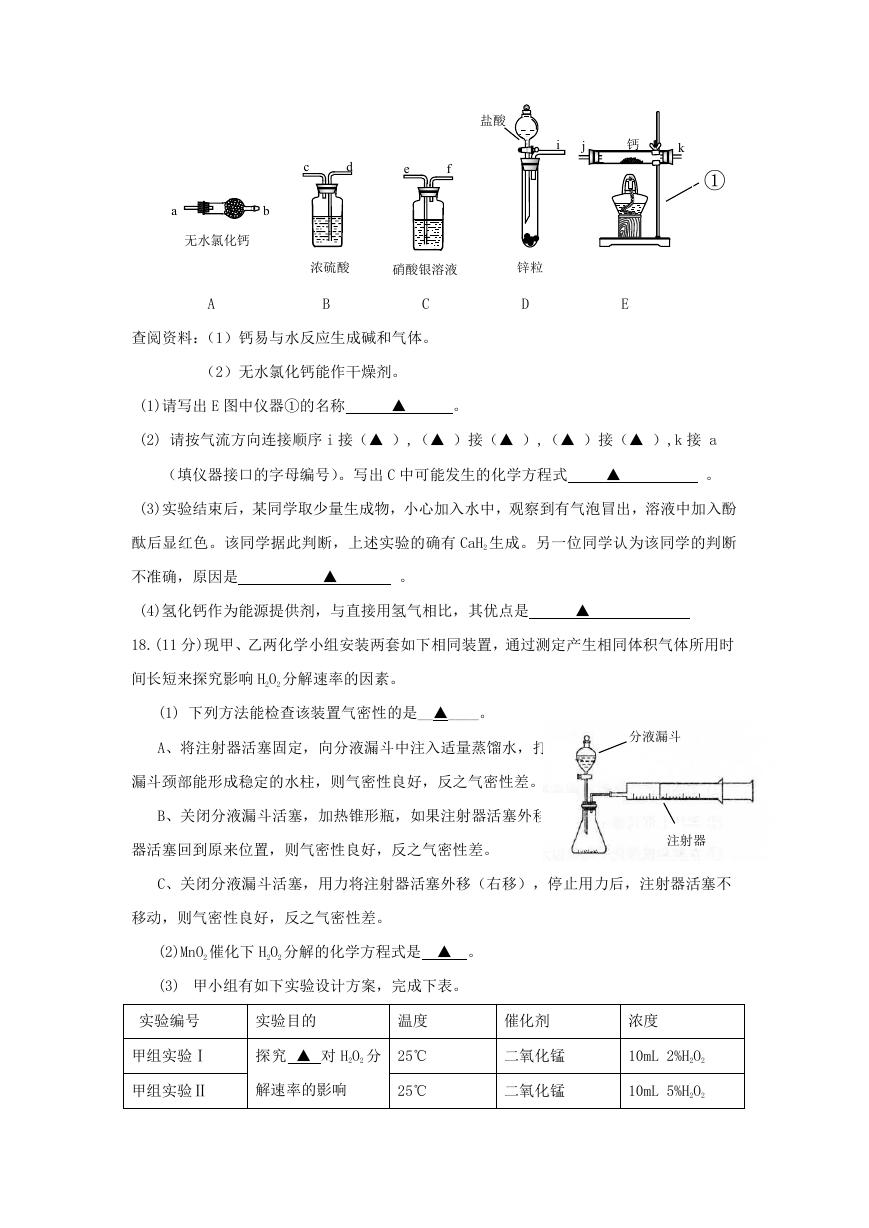
17.(9 分) 登山运动员常利用氢化钙固体作为能源提供剂,在需要时与水反应生成其他物
质和氢气,提供燃料。某兴趣小组用纯净干燥的氢气和金属钙制取氢化钙,所选装置图
如下:
�
c
d
e
f
盐酸
i
j
钙
k
①
a
b
无水氯化钙
浓硫酸
硝酸银溶液
A
B
C
锌粒
D
E
查阅资料:(1)钙易与水反应生成碱和气体。
(2)无水氯化钙能作干燥剂。
(1)请写出 E 图中仪器①的名称
▲
。
(2) 请按气流方向连接顺序 i 接(▲ ),(▲ )接(▲ ),(▲ )接(▲ ),k 接 a
(填仪器接口的字母编号)。写出 C 中可能发生的化学方程式
▲
。
(3)实验结束后,某同学取少量生成物,小心加入水中,观察到有气泡冒出,溶液中加入酚
酞后显红色。该同学据此判断,上述实验的确有 CaH2 生成。另一位同学认为该同学的判断
不准确,原因是
▲
。
(4)氢化钙作为能源提供剂,与直接用氢气相比,其优点是
▲
18.(11 分)现甲、乙两化学小组安装两套如下相同装置,通过测定产生相同体积气体所用时
间长短来探究影响 H2O2 分解速率的因素。
(1) 下列方法能检查该装置气密性的是__▲____。
A、将注射器活塞固定,向分液漏斗中注入适量蒸馏水,打开分液漏斗活塞,如果分液
分液漏斗
漏斗颈部能形成稳定的水柱,则气密性良好,反之气密性差。
B、关闭分液漏斗活塞,加热锥形瓶,如果注射器活塞外移(右移),停止加热后注射
器活塞回到原来位置,则气密性良好,反之气密性差。
注射器
C、关闭分液漏斗活塞,用力将注射器活塞外移(右移),停止用力后,注射器活塞不
移动,则气密性良好,反之气密性差。
(2)MnO2 催化下 H2O2 分解的化学方程式是 ▲ 。
(3) 甲小组有如下实验设计方案,完成下表。
实验编号
实验目的
温度
催化剂
浓度
甲组实验Ⅰ
探究 ▲ 对 H2O2 分
25℃
二氧化锰
10mL 2%H2O2
甲组实验Ⅱ
解速率的影响
25℃
二氧化锰
10mL 5%H2O2
�
⑷甲、乙两小组得出如图数据。
①甲组实验得出的数据可知:浓度越大,H2O2 分
解速率 ▲ ;
②由乙组研究的酸、碱对 H2O2 分解影响因素的
数据分析:相同条件下, H2O2 在 ▲ (填
“酸”或“碱”)性环境下放出气体速率较快;
乙组提出可以用 Ba02 固体与硫酸溶液反应制 H202(已知还生成另一种物质),其化学反
应方程式为 ▲ ;支持这一方案的理由是 ▲ 。
19、(8 分)某化学小组为测定一瓶失去标签的盐酸的溶质质量分数,分成甲、乙两组,分
别用不同的方法进行测定。
实验设计:
甲组:取纯净碳酸钙粉末 5g 于烧杯中,加入 20g 该盐酸溶液,充分反应后,过滤、洗
涤、干燥,称量得剩余固体 3g。
乙组:取纯 净碳酸钙粉末 5g 于锥形瓶中,将 20g
该盐酸溶液加入分液漏斗,利用测定产生二
氧化碳的体积(20℃、标准大气压)计算盐
酸浓度。装 置示意图如下:
数据处理:
(1)请利用甲组数据计算该盐酸的溶质质量分数。
(写出计算过程)
(2)乙组计算结果略小于甲组。经过多次实验仍得到相同结果(忽略量筒引起的误差),
可能的原因是
�
参考答案及评分标准
本次阅卷过程中:
(1)化学专用名词、化学式书写错误相应给分点不给分。
(2)化学方程式未配平,相应化学方程式不给分。书写化学方程式时,必要的反应条件未
写或写错误,要适当扣分。
(3)除提供的答案外,其它合理 的回答也参考给分。
第Ⅰ卷
选择题(本大题共 12 个小题,每小题 3 分;每小题只有一个选项符合题意,多选、错选均
不给分。)
1 D、 2 B、 3 C、 4 C、 5 B、 6 A、 7 A、 8 C、 9 B、 10 A、 11 D、 12 D
第Ⅱ卷
13、(共 5 分)
(1)棉花; 塑料(2 分,每空 1 分)
(2)水(或 H2O) 氧气(或 O2); Al2O3(3 分,每空 1 分)
14、(共 4 分)
(1)糖或糖类(1 分)
(2)金属(1 分)
(3)C (2 分)
15、(共 6 分)
(1) 隔离可燃物 (2 分)
②④ (2 分,答对一个给 1 分,有错不给分,下同)
或隔绝空气
①③
或降低温度到着火点以下 ⑤
( 2 ) 2C4H10+ 13O2
10H2O+8CO2 (2 分)
16、(共 11 分)
(1)菱锌矿粉与盐酸充分反应(1 分);
(2)1:2:1(2 分);
(3)Zn(OH)2 +H2SO4= ZnSO4+2H2O(2 分);复分解(1 分);
(4)除去剩余的硫酸(2 分);
(5)蒸发或蒸发结晶(1 分);
(6)25m2/13m1 或 125m2/65m1 (2 分)
�
17、(共 9 分)
(1)铁架台(1 分);
(2)e,f 接 d,c 接 j(2 分);AgNO3 + HCl= AgCl↓+ HNO3(2 分)
(3)钙与水反应也能生成碱,同时也有气泡冒出 (2 分,合理答案也给分);
(4)便于携带;安全;通过反应,能将水中的氢元素部分转化为氢气(2 分,答出任何一点
均给分,合理答案也给分)
18、(共 11 分)
(1)AB(2 分,每答对 1 个给 1 分,有错不给分);
MnO2 2H2O+O2↑(2 分);
(2)2H2O2
(3)浓度(1 分);
(4)①越快(1 分);
②碱(1 分);
BaO2 +H2SO4= BaSO4 ↓+H2O2(2 分);
过氧化氢在酸性环境下分解较慢(2 分)
19、(共 8 分)
(1)计算过程
解:设参加反应的 HCl 质量为 x ,消耗碳酸钙质量为 5g-3g=2g
2HCl+CaCO3=CaCl2+H2O +CO2↑
73
x
100
2g
73/x=100/2g
X=1.46g
.............2 分
……….1 分
………1 分
盐酸的溶质质量分数为:1.46g/20g×100%=7.3%
答:盐酸的溶质质量分数为 7.3%。
...............1 分
...............设、答共 1 分
(2)测量的水的体积小于生成气体的体积; B、C 之间的导管内实验前无水,实验后有水;
内外气压相同时,二氧化碳无法将相应体积的水压入量筒;二氧化碳可能溶解在 A 中反应后
的溶液中。(2 分)(合理答案均给分)
�













 2023年江西萍乡中考道德与法治真题及答案.doc
2023年江西萍乡中考道德与法治真题及答案.doc 2012年重庆南川中考生物真题及答案.doc
2012年重庆南川中考生物真题及答案.doc 2013年江西师范大学地理学综合及文艺理论基础考研真题.doc
2013年江西师范大学地理学综合及文艺理论基础考研真题.doc 2020年四川甘孜小升初语文真题及答案I卷.doc
2020年四川甘孜小升初语文真题及答案I卷.doc 2020年注册岩土工程师专业基础考试真题及答案.doc
2020年注册岩土工程师专业基础考试真题及答案.doc 2023-2024学年福建省厦门市九年级上学期数学月考试题及答案.doc
2023-2024学年福建省厦门市九年级上学期数学月考试题及答案.doc 2021-2022学年辽宁省沈阳市大东区九年级上学期语文期末试题及答案.doc
2021-2022学年辽宁省沈阳市大东区九年级上学期语文期末试题及答案.doc 2022-2023学年北京东城区初三第一学期物理期末试卷及答案.doc
2022-2023学年北京东城区初三第一学期物理期末试卷及答案.doc 2018上半年江西教师资格初中地理学科知识与教学能力真题及答案.doc
2018上半年江西教师资格初中地理学科知识与教学能力真题及答案.doc 2012年河北国家公务员申论考试真题及答案-省级.doc
2012年河北国家公务员申论考试真题及答案-省级.doc 2020-2021学年江苏省扬州市江都区邵樊片九年级上学期数学第一次质量检测试题及答案.doc
2020-2021学年江苏省扬州市江都区邵樊片九年级上学期数学第一次质量检测试题及答案.doc 2022下半年黑龙江教师资格证中学综合素质真题及答案.doc
2022下半年黑龙江教师资格证中学综合素质真题及答案.doc