2009 年福建省厦门市中考化学真题及答案
(试卷满分:100 分;考试时间:90 分钟)
准考证号______________ 姓名________________ 座位号_____________
考生注意:1.本学科有两张试卷,一是答题卡,另一是本试题(共 6 页 25 题)。请将全部
答案填在答题卡的相应答题栏内
............,否则不能得分。
2.可能用到的相对原子质量:
H 一 1
Na—23
O 一 16
C 一 12
N—l4
Si—28
C1—35.5 Ca-40
一、选择题(本题 l5 小题,共 30 分,每小题只有一个..选项符合题目要求,请在答题卡选
择题栏内用 2B 铅笔将该选项的序号涂黑)
1.广泛用于制造日常生活用品,且地壳中含量最多的金属元素是
A.铝
D.铁
2.医生建议小明多吃蔬菜,则小明需要补充的营养素主要是
B.镁
C.硅
A.维生素
B.油脂
C.蛋白质
D.无机盐
3.下列做法易使金属被腐蚀的是
A.用过的菜刀擦干 B.铝锅盛放酸菜 C.铁护栏涂上油漆 D.自行车钢圈镀铬
4.根据下表判断,肉类变质过程中酸碱性的变化趋势是
名称
pH
新鲜肉
5.8~6.2
次鲜肉
6.3~6.6
变质肉
>6.7
A.酸性变弱
B.酸性变强
C.酸性不变
D.碱性变弱
5.我市在节能减排方面走在全国前列,下列做法不利于...节能或减少二氧化碳排放的是
A.使用节能的 LED 路灯,以减少电能的消耗
B.发展 BRT 快速公交,以减少汽油的消耗
C.提高现有火电厂煤的利用率,增加单位质量煤的发电量
D.多建燃烧煤或天然气的火电厂,以保证电力的供应
6.科学家发现由 C60 制取的化合物 M 有抑制艾滋病毒的作用,下列叙述不正确...的是
A.厦大化学家制得了 C50,它与 C60 都是单质
B.某物质含有 C50 分子和 C60 分子,该物质是化合物
C.由 C60 制取化合物 M 的过程,发生了化学变化
D.C60 在空气中燃烧生成二氧化碳的反应是化合反应
7.下列是我市要打造的百亿产业群项目,其中不属于化学研究范畴的是
A.化学纤维的合成与加工
C.软件的开发与应用
B.钨的冶炼与加工
D.橡胶的合成与加工
8.科学发展观要求在经济建设中保护生态环境,则下列做法错误..的是
A.设计绿色化学工艺,使原料中的原子 100%转移到产物中
B.将垃圾分类回收后用于发电,并将尾气无害化处理后排放
C.将污染较大的企业全部迁到无人海岛,以减少对城市的污染
�
D.提高工业污水和生活污水的处理标准,减少污染物排放总量
9.科学家用单个分子制成了“纳米车”(如右图),它能在人工操纵下运输药物分子到病
源处释放以杀死癌细胞。下列有关“纳米车”的说法正确的是
A.“纳米车”的研制成功说明分子要在人为外力作用下才能运动
B.“纳米车”分子不是由原子构成的
C.“纳米车”运输药物分子的过程是肉眼可以直接看见的
D.“纳米车”研制成功说明在一定条件下人可以控制分子运动
10.下列关于耐高温新型陶瓷——氮化硅(Si3N4)的叙述,正确的是
A.氮化硅中 Si、N 两种元素的质量比为 4:3
B.氮化硅中氮元素的质量分数为 60%
C.14g 氮化硅中含硅 8.4g
D.氮化硅的相对分子质量为 l44
11.下列化学实验操作,正确的是
A.点燃酒精灯
B.检查气密性
C.读取液体体积
D.加热液体
12.根据右图所示的实验现象,下列判断不正确...的是
①白磷燃烧
③红磷不燃烧
铜片
80℃的水
A.现象①②说明物质燃烧需要氧气
B.现象①说明白磷的着火点不高于 80℃
C.现象②③说明两种可燃物的着火点均高于 80℃
D.现象①③说明两种可燃物的着火点不同
13.下列实验方案错误..的是
②白磷
不燃烧
A.从海水中获得少量饮用水,可采用蒸馏的方法
B.从氯化钠溶液中获得氯化钠晶体,可采用直接过滤的方法
C.除去氯化钠溶液中的少量碳酸钠,可加入适量稀盐酸
D.检验某井水是否为硬水,可使用肥皂水
14.对下列课外实验活动的叙述,不正确...的是
A.用小卵石、活性炭和细沙等物品可制作简易净水器
B.将明矾晶体悬挂在饱和明矾溶液中,晶体的形状可改变但质量不变
C.利用柠檬酸具有酸的性质,可在碳酸氢钠溶液中加入柠檬酸制汽水
D.将少量高锰酸钾晶体放入汽油中振荡,可形成紫红色的溶液
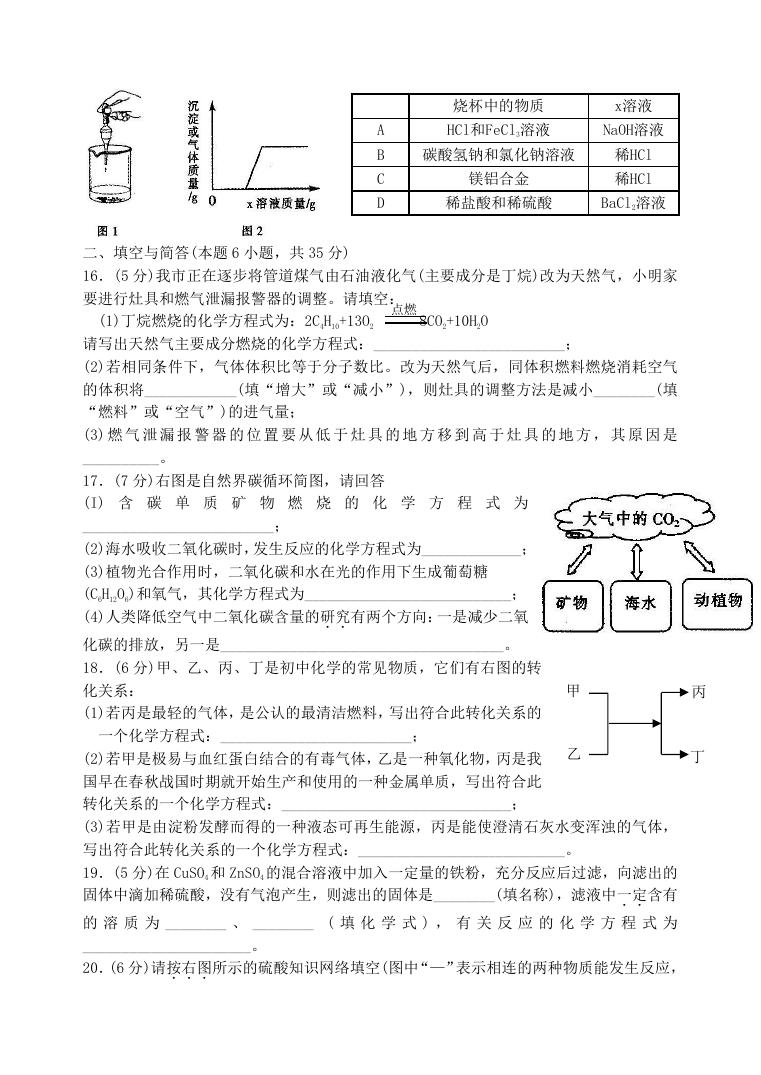
15.向烧杯中逐滴加入 x 溶液至过量(图 1),生成沉淀或气体的质量与加入 x 溶液的质量
关系符合图 2 的是
�
烧杯中的物质
HCl和FeCl3溶液
碳酸氢钠和氯化钠溶液
镁铝合金
x溶液
NaOH溶液
稀HCl
稀HCl
稀盐酸和稀硫酸
BaCl2溶液
A
B
C
D
二、填空与简答(本题 6 小题,共 35 分)
16.(5 分)我市正在逐步将管道煤气由石油液化气(主要成分是丁烷)改为天然气,小明家
要进行灶具和燃气泄漏报警器的调整。请填空:
点燃
(1)丁烷燃烧的化学方程式为:2C4H10+13O2
8CO2+10H2O
请写出天然气主要成分燃烧的化学方程式:_________________________;
(2)若相同条件下,气体体积比等于分子数比。改为天然气后,同体积燃料燃烧消耗空气
的体积将____________(填“增大”或“减小”),则灶具的调整方法是减小________(填
“燃料”或“空气”)的进气量;
(3) 燃 气 泄 漏 报 警 器 的 位 置 要 从 低 于 灶 具 的 地 方 移 到 高 于 灶 具 的 地 方 , 其 原 因 是
__________。
17.(7 分)右图是自然界碳循环简图,请回答
(I) 含 碳 单 质 矿 物 燃 烧 的 化 学 方 程 式 为
_________________________;
(2)海水吸收二氧化碳时,发生反应的化学方程式为_____________;
(3)植物光合作用时,二氧化碳和水在光的作用下生成葡萄糖
(C6H12O6)和氧气,其化学方程式为___________________________;
(4)人类降低空气中二氧化碳含量的研究..有两个方向:一是减少二氧
化碳的排放,另一是_____________________________________。
18.(6 分)甲、乙、丙、丁是初中化学的常见物质,它们有右图的转
化关系:
(1)若丙是最轻的气体,是公认的最清洁燃料,写出符合此转化关系的
甲
一个化学方程式:_________________________;
乙
(2)若甲是极易与血红蛋白结合的有毒气体,乙是一种氧化物,丙是我
国早在春秋战国时期就开始生产和使用的一种金属单质,写出符合此
转化关系的一个化学方程式:______________________________;
(3)若甲是由淀粉发酵而得的一种液态可再生能源,丙是能使澄清石灰水变浑浊的气体,
写出符合此转化关系的一个化学方程式:___________________________。
19.(5 分)在 CuSO4 和 ZnSO4 的混合溶液中加入一定量的铁粉,充分反应后过滤,向滤出的
固体中滴加稀硫酸,没有气泡产生,则滤出的固体是________(填名称),滤液中一定..含有
的 溶 质 为 ________ 、 ________ ( 填 化 学 式 ) , 有 关 反 应 的 化 学 方 程 式 为
______________________。
20.(6 分)请按右图...所示的硫酸知识网络填空(图中“—”表示相连的两种物质能发生反应,
丙
丁
�
“→”表示一种物质能转化成另一种物质):
(1)写出两个属于复分解反应的化学方程式:
①__________________; ②_____________________;
(2)总结出酸的两条化学性质的反应规律:
①__________________; ②_____________________。
21.(6 分)根据下图填空:
图 1 水蒸发实验
(1)图 2 实验的化学方程式为___________________________________;
(2)比较图 1 和图 2 两个实验中水的变化,用分子原子的观点分析其不同点:
图 2 电解水实验
图 3 家用电解水器
________________________________________________________________;
(3)在图 2 实验通电时,a 试管中液体呈碱性、b 试管中液体呈酸性,利用此原理设计的
pH
水的应用
10.0 浸泡蔬菜
家用电解水器(图 3),可得酸碱性不同的水,且各有其用途(见右
表)。
①右表中用于“日常饮用”的水遇紫色石蕊试液显_________色;
②家用电解水器生成的碱性水可除去水中有害的重金属离子,生成
小分子团水,因而对健康有益。请用化学符号表示含 5 个水分子
的水分子团:______________;
③图 2 装置电解实验完毕,测定剩余水的 pH,结果与实验前相同。
请对此现象可能的原因提出一个合理的猜想:_________________
___________________________________________________________________________。
三、实验与探究(本题 2 小题,共 l5 分)
22.(7 分)某兴趣小组要测定高锰酸钾样品的纯度(假设杂质受热不反应),请根据下列装
置填空:
9.5 日常饮用
5.5 洗涤器皿
9.0 烹饪
6.0 洗头发
(1)组成 D 装置的两种主要玻璃仪器的名称是______________和____________;
(2)高锰酸钾样品在 A 装置中反应的化学方程式为______________________________;
(3)A 装置试管口要略向下倾斜的原因是___________________________;
�
(4) 要 完 成 测 定 任 务 , 需 选 用 的 装 置 有 ___________( 填 字 母 ) , 需 测 量 的 数 据 有
__________。
23.(8 分)NaNO2 是—种致癌物质。某兴趣小组为研究水中 NaNO2 的含量和消除污染的方法,
进行了如下目视比色法实验(比较溶液颜色深浅以测定物质浓度的方法),请你参与实验,
并填空:
(1)测定方法的研究
配制质量分数为 0.07%的 NaNO2 标准溶液,分别取 0、2、4、6、8、10 mL 标准溶液于
6 支试管,加蒸馏水至总体积均为 l0mL,分别加入约 0.30gM 粉未(M 是氨基苯磺酸),振荡
后制成颜色深浅不同的标准色阶。测定时取 10 mL 水样,加入约 0.30gM 粉末,振荡后与
标准色阶比较,得出颜色相同的色阶所含标准溶液的毫升数,再按稀释比例计算出水样中
NaNO2 的质量分数(水和稀溶液的密度均按 l g·cm-3 计算)。
①配制质量分数为 0.07%的 NaNO2 溶液 l000 mL,所需 NaNO2 的质量是_________g;
②用上述方法测定某水样,其与含 2 mL 标准溶液的色阶颜色相同,此水样中 NaNO2 的
质量分数为___________;
(2)研究某水样在不同煮沸时间后 NaNO2 含量的变化
将另一水样用右图装置煮沸,测定不同煮沸时间 NaNO2 的质量分数,结果为:
煮沸时间(小时)
NaNO2 的质量分数
0
0
2
0
4
8
12
0.014%
0.028%
0.056%
① 兴 趣 小 组 设 计 的 右 图 实 验 装 置 用 到 了 蒸 气 回 流 装 置 , 其 作 用 是
_______________;
②根据上述数据,可见此水样随煮沸时问的延长 NaNO2 的质量分数会逐渐
_________;
{3)寻找能降低水中 NaNO2 含量的物质,研究消除污染的有效方法
查阅资料可知,加入醋酸或双氧水可降低水中 NaNO2 的质量分数,请设计实验证明少
量醋酸是否有降低水中 NaNO2 质量分数的作用,填写下列实验报告:
实验步骤
可能的实验现象 根据可能的实验现象得出的结论
四、信息与分析(本题 l 小题,共 l0 分)
24.阅读材料,回答问题:
材料一:l869 年,俄国化学家门捷列夫对已发现的元素进行研究,制作
了
元素周期表(右表是其片断),并在他的元素周期表中留下了许多空
位代表尚未发现的新元素,其中就预言了“类铝”这种新元素。
13
Al
14
Si
铝
硅
26.98
28.09
类铝 类硅
材料二:l875 年,法国化学家布瓦博德朗公布了他发现的新元素镓(元素符号为 Ga)的性
质:镓是银白色金属,密度 4.7g·cm-3,能与沸水剧烈反应生成氢气和氢氧化镓。不久,
他收到门捷列夫的来信称:镓就是我预言的“类铝”,其密度应在 5.9-6.0 g·cm-3 之间。
材料三:l876 年,布瓦博德朗将金属镓提纯后测得镓的密度为 5.94g·cm-3,
+X
2 8 18 3
�
从而验证了元素周期表的正确性。随后科学家根据元素周期表的空位,按图
索骥,发现了许多新元素。目前金属镓广泛用于制造半导体材料。镓的原子
结构示意图如右,常见化合价为+3。
(1)镓元素的质子数为__________,其原子最外层电子数为_____________;
(2)请根据上述材料,总结金属镓的有关知识:
物理性质:_____________________________________________;
化学性质(请用化学方程式表示):_____________________________________;
用途:____________________________________;
(3)氢氧化镓与氢氧化钠都具有碱的性质,则氢氧化镓与稀硫酸反应生成盐的化学式为
_____________;
(4)请从上述周期表片断中查出硅元素的一种数据,并指出其含义:_________________;
(5)上述材料中,化学家所使用的研究方法及其关系是________________________。
五、计算与应用(本题 l 小题,共 l0 分)
25.小明购得用于食用菌种植的轻质碳酸钙,标签如右。为测定
其含钙量小明进行的实验是:
轻质碳酸钙
XX 牌
①称取样品 5g;
②加入足量 7.3%的盐酸充分反应,反应的化学方程式为:
CaCO3+2HCl=CaCl2+H2O+CO2↑
③将所生成的全部气体除杂干燥后,通入 l00g 氢氧化钠浓
溶液,反应后此溶液总质量为 l02.2g。
请计算,并回答下列有关问题:
(1)样品中碳酸钙的质量分数是多少?
(2)标签标示的含钙量是否正确,若不正确应如何改正?
含量:含钙>40%
质量:25kg
XX 化工厂出品
�
参考答案
注:化学方程式评分要求:每个化学方程式 2 分,所有化学式都正确 l 分,其他都完整正
确 l 分。另外本卷答案多有开放性,只要学生的答案合理就给分。
一、选择题(每小题只有一个正确选项,每小题 2 分,共 30 分)
题号 1
答案 A
2
A
3
B
4
A
5
D
6
B
7
C
8
C
9
D
10
C
1l
B
12
C
13
B
14
D
15
A
二、填空与简答(6 小题,共 35 分)
16.(5 分)(1)CH4+2O2
点燃
CO2+2H2O(2 分)
(2)减小(1 分),空气(1 分)
(3)甲烷密度比空气小,而丁烷比空气大(1 分)
17.(7 分)(1)C+O2
点燃
CO2(2 分)
(2)CO2+H2O=H2CO3(2 分)
(3)6CO2+6H2O
光
叶绿体
C6H12O6+6O2(2 分)
(4)增加空气中二氧化碳的消耗(1 分)
18.(6 分)(1)Zn+2HCl=ZnCl2+H2↑ (2 分,其他正确答案参照给分)
(2)3CO+Fe2O3
高温
2Fe+3CO2
(2 分)(3)C2H5OH+3O2
点燃
2CO2+3H2O(2 分)
19.(5 分)铜(1 分);ZnSO4、FeSO4(各 1 分,共 2 分)
Fe+CuSO4=FeSO4+Cu
(2 分)
20.(6 分)本题有多种可能的正确答案,请注意参照评分。
(1)①Fe2O3+3H2SO4===Fe2(SO4)3+3H2O(2 分);
②BaCl2+H2SO4=BaSO4↓+2HCl(2 分)
(2)①酸和碱反应生成盐和水;②金属和酸反应生成盐和氢气(各 1 分,共 2 分)
21.(6 分)(1)2H2O
通电
2H2↑+O2↑ (2 分)
(2)图 1 实验中水分子没有变化,而图 2 实验中水分子变成了氢分子和氧分子(1 分)
(3)①蓝(1 分) ②5H2O 或(H2O)5
③本小题是开放性问题,只要是学生针对本题情况的合理猜想均给 1 分。如:
(1 分)
两电极产生的酸和碱,在电解完毕后恰好完成中和
三、实验与探究(2 小题,共 l5 分)
22.(7 分)(1)水槽或导管(1 分)
量筒(1 分)
(2)2KMnO4
△
K2MnO4+MnO2 +O2↑(2 分)
(3)防止药品中的湿存水加热后,产生的水流回试管底部,使试管破裂(1 分)
(4)本小题有多种可能答案,请参照评分(前后各 1 分,共 2 分),如:
Ⅰ.A;高锰酸钾样品质量和反应前后 A 中试管及所盛固体物质的总质量
Ⅱ.AD;高锰酸钾样品质量和测定产生气体的体积
Ⅲ.AB 或 ABC;高锰酸钾样品质量和反应前后装置 B 中玻璃管(含铜丝)的总质量
23.(8 分)①0.7(1 分)
(2)①保持水的总量不变(1 分)
②0.014%(1 分)
②增多(1 分)
�
(3)(4 分,其他合理答案参照给分)
实验步骤
可能的实验现象
可能的结论
取10 mL NaNO2标准溶液于试管,加
入数滴醋酸后振荡,再加入0.3gM粉
末,振荡后与标准色阶比较(2分)
溶液颜色比10 mLNaNO2标准色
阶的颜色浅(1分)
少量醋酸有降低NaNO2
的作用(1分)
四、信息与分析(1 小题,共 l0 分)
24.(1)31,3(各 1 分,共 2 分)
(2)物理性质:银白色金属,密度为 5.94g·cm-3(1 分)
化学性质:2Ga+6H2O=Ga(OH)3+3H2↑(2 分)
用途:制造半导体材料(1 分)
(3)Ga2(SO4)3(1 分)
(4)相对原子质量(原子量)为 28.09 或质子数(原子序数、核电荷数)为 14(1 分)
(5)考生能从两种以上化学研究方法进行说明得 2 分,如
化学研究方法有理论研究和实验研究
化学理论研究要得到实验研究的验证
化学实验研究为理论研究提供依据
化学理论研究为化学实验研究提供了方向
考生能从一种化学方法或具体方法进行说明得 l 分,如
化学研究可以使用理论和推理的方法
化学研究可以使用实验的方法
元素周期表研究使用了理论(模型、猜想)的研究方法
镓元素的发现应用了实验研究方法
五、计算与应用(1 小题,共 l0 分)
25.(I)设样品中碳酸钙的质量为 x
CaCO3+2HCl===CaCl2+H2O+CO2↑
100
x
100:x=44:2.2g
x=5g
样品中碳酸钙的质量分数为 l00%
(2)碳酸钙中含钙元素的质量分数为
44
…………………………(1 分)
(1 分)
………………(2 分)
102.2g-100g………………………(2 分)
……………………(2 分)
Ca
CaCO
3
×100%=40%(1 分)
标签中“含钙>40%”应该改为“含钙≤40%”(1 分)
答:样品中碳酸钙的含量为 l00%,标签中“含钙>40%”应该改为“含钙≤40%”。
�















 2023年江西萍乡中考道德与法治真题及答案.doc
2023年江西萍乡中考道德与法治真题及答案.doc 2012年重庆南川中考生物真题及答案.doc
2012年重庆南川中考生物真题及答案.doc 2013年江西师范大学地理学综合及文艺理论基础考研真题.doc
2013年江西师范大学地理学综合及文艺理论基础考研真题.doc 2020年四川甘孜小升初语文真题及答案I卷.doc
2020年四川甘孜小升初语文真题及答案I卷.doc 2020年注册岩土工程师专业基础考试真题及答案.doc
2020年注册岩土工程师专业基础考试真题及答案.doc 2023-2024学年福建省厦门市九年级上学期数学月考试题及答案.doc
2023-2024学年福建省厦门市九年级上学期数学月考试题及答案.doc 2021-2022学年辽宁省沈阳市大东区九年级上学期语文期末试题及答案.doc
2021-2022学年辽宁省沈阳市大东区九年级上学期语文期末试题及答案.doc 2022-2023学年北京东城区初三第一学期物理期末试卷及答案.doc
2022-2023学年北京东城区初三第一学期物理期末试卷及答案.doc 2018上半年江西教师资格初中地理学科知识与教学能力真题及答案.doc
2018上半年江西教师资格初中地理学科知识与教学能力真题及答案.doc 2012年河北国家公务员申论考试真题及答案-省级.doc
2012年河北国家公务员申论考试真题及答案-省级.doc 2020-2021学年江苏省扬州市江都区邵樊片九年级上学期数学第一次质量检测试题及答案.doc
2020-2021学年江苏省扬州市江都区邵樊片九年级上学期数学第一次质量检测试题及答案.doc 2022下半年黑龙江教师资格证中学综合素质真题及答案.doc
2022下半年黑龙江教师资格证中学综合素质真题及答案.doc