2019 年湖北省荆门市中考化学真题及答案
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。满分 80 分,考试时间 100 分钟。
可能用到的相对原子质量: H 1— C 12—
Cu
65—
Zn
64—
O 16—
Na
23—
Ca
40—
Fe
56—
一、选择题(每小题只有一个选项符合题意)。
1.化学使世界变得更加绚丽多彩。下列说法正确的是
(
)
A.化学是人类社会进步的关键,但化学不能研究和创造自然界不存在的物质
B.“粉身碎骨浑不怕,要留清白在人间”的“清白”是指氢氧化钙
C.儿童发育停滞,智力低下,严重时会得侏儒症,其体内缺少的元素是碘
D.“工业的维生素”稀土广泛应用于新能源、新材料、航空航天、电子信息等尖端科技领域,是重要战
略资源。合理开发、利用稀土资源,保护稀土资源,人人有责
2.将物质进行分类、类比是学习化学的重要途径。下列有关分类、类比的说法正确的是
(
)
A.硅与碳的最外层电子数相同,二氧化硅能与氢氧化钠溶液反应
B.醋酸、纯碱、硫酸钡分别属于酸、碱、盐
C.化学变化大多伴生发光发热,所以有发光发热的变化一定是化学变化
D.硫酸、盐酸、干冰都是纯净物
3.下列化学实验操作正确的是
A.向浓硫酸中缓慢加入乙醇,边加边振荡
B.用10 mL 的量筒量取9.75 mL 的溶液
(
)
C.闻气体的气味时,应用手在瓶口轻轻煽动,让极少量的气体飘入鼻孔
D.不小心打破温度计,应立即用大量水冲洗
4.除去下列物质中混有的杂质,所用试剂和操作方法不正确的是
(
)
选项
物质(括号内为杂质)
除去杂质的方法
A
Na SO 溶液 NaOH(
2
4
)
滴加适量的稀硫酸
C
B 铜粉(铁粉)
CO CO( )
2
CaCl(
NaCl 溶液
D
加入足量稀硫酸,过滤、洗涤、干燥
)
2
通过足量 NaOH 的溶液,干燥
通入过量的 2CO ,过滤
5.甲元素一价阳离子有 10 电子,乙元素与氢元素组成三核 10 电子的分子。则关于甲、乙、氢元素形成的
化合物 W 的说法正确的是
A.W 是由分子构成的
(
)
B.10%W 溶液与 30%W 溶液等体积混合,得 20%W 溶液
C.W 是一种重要的化工原料,在生活上可用来去除油污
D.用托盘天平称取 15.2 克 W,计量只需要一个 5 克、一个 10 克的砝码和游码
�
6.下列关于物质用途的描述中,不正确的是
(
)
A.石墨用作电极材料,活性炭用作吸附家装产生的有害气体
B.聚乙烯塑料用作食品包装袋,可以大量使用
(
C.磷酸二氢铵
NH H PO
4
2
)用作复合肥料
4
D.氧气用作气焊
7.甲、乙两种物质是 NaCl 和 KNO3,它们的溶解度曲线如图所示。下列叙述不正确的是
(
)
A.将 t1℃时甲的饱和溶液变为不饱和溶液,可采取升温到 t3℃的方法
B.t2℃时,质量相等的甲和乙的饱和溶液,其溶质的质量一定相等
C.配制 t1 ℃20%的甲溶液:称取 20 克 NaCl 溶解在 80 克热水中,再降温至 t1℃
D.乙中少量的甲杂质,可采用加水溶解、蒸发浓缩、热结晶、趁热过滤、洗涤、
干燥的方法提纯
8.走绿色发展道路,既要金山银山又要绿水青山。下列关于环境方面的知识正确的是
(
)
A.空气污染指数的项目主要有二氧化硫、二氧化碳、氮的氧化物、可吸入颗粒等污染物
B.臭氧层在距地面10 50 km
的高空,吸收大部分紫外线保护地球生物
C.倡导绿色出行,节能减排。减排是指减少大气污染气的排放
D.水体污染的来源主要有酸碱污染、重金属污染和毒气污染
二、非选择题
9.(5 分)请用化学知识回答下列问题。
(1)钙是人体内含量最高的金属元素,是构成人体的重要组分。如牙齿中含有羟基磷酸钙
Ca
10
PO
4 6
OH
2
晶体。羟基磷酸钙中磷元素的化合价为 ▲ 。
(2)质子是化学反应中常见的一种微粒,其化学符号为 ▲ 。
(3)用湿润的 PH 试纸测定盐酸的 PH 值,PH 值会 ▲ (增大或减小或不变)
(4)“借问酒家何处有,牧童遥指杏花村”涉及到常见有机物的化学式为 ▲ 。
(5)基本营养素包括蛋白质、糖类、油脂、 ▲ 、无机盐和水六大类。
10.(8 分)按要求填空
(1)溶洞里形态各异的钟乳石的形成过程可简单理解为:石灰岩长时间缓慢的“溶解”在水中,水在
滴落时又缓慢的生长出钟乳。钟乳石生长的化学方程式为 ▲ ,其反应类型为 ▲ 。
(2)汽车尾气中含有多种氮的氧化物和一氧化碳,对空气有污染作用。有人设计在尾气处加装高效催
化剂,将其转化成无污染的一种单质和一种化合物。则生成的化合物的化学式为 ▲ ,反应中
化合价降低的元素符号是 ▲ 。
(3)侯德榜是我国杰出的化学家,他发明的联合制碱法大大提高了原料的利用率。联合制碱的主要反
应原理:向饱和的食盐溶液通入过量的氨气(易溶于水的碱性气体)和二氧化碳气体,反应后分
�
离出碳酸氢钠。反应方程式为
NaCl
(饱和)
NH H O CO
3
2
2
NaHCO NH Cl
3
4
,向饱和
的食盐溶液是先通入氨气还是二氧化碳? ▲ (填化学式)。该反应属于复分解反应,该反应能
够发生的依据是 ▲ 。
(4)已知某铁的氧化物可表示为 x
Fe O
y
aFeO bFe O
2
。经测:15.2 克的某铁的氧化物中铁的质量
3
为 11.2 克。则 :
x y ▲ , :
a b
▲ (均填最小整数比)
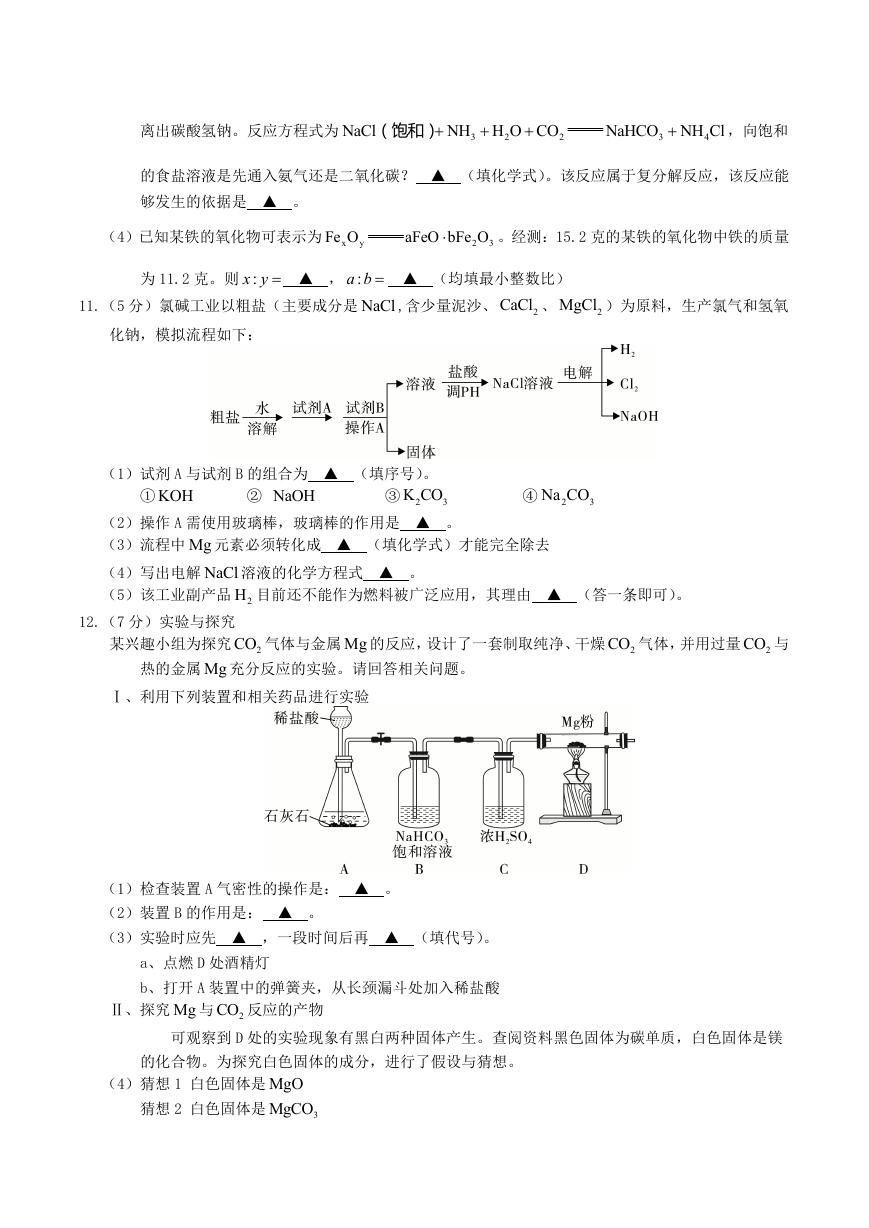
11.(5 分)氯碱工业以粗盐(主要成分是 NaCl ,含少量泥沙、
CaCl 、
2
2MgCl )为原料,生产氯气和氢氧
化钠,模拟流程如下:
(1)试剂 A 与试剂 B 的组合为 ▲ (填序号)。
K CO
3
② NaOH
① KOH
③ 2
Na CO
④ 2
3
(2)操作 A 需使用玻璃棒,玻璃棒的作用是 ▲ 。
(3)流程中 Mg 元素必须转化成 ▲ (填化学式)才能完全除去
(4)写出电解 NaCl 溶液的化学方程式 ▲ 。
(5)该工业副产品 2H 目前还不能作为燃料被广泛应用,其理由 ▲ (答一条即可)。
12.(7 分)实验与探究
某兴趣小组为探究 2CO 气体与金属 Mg 的反应,设计了一套制取纯净、干燥 2CO 气体,并用过量 2CO 与
热的金属 Mg 充分反应的实验。请回答相关问题。
Ⅰ、利用下列装置和相关药品进行实验
(1)检查装置 A 气密性的操作是: ▲ 。
(2)装置 B 的作用是: ▲ 。
(3)实验时应先 ▲ ,一段时间后再 ▲ (填代号)。
a、点燃 D 处酒精灯
b、打开 A 装置中的弹簧夹,从长颈漏斗处加入稀盐酸
Ⅱ、探究 Mg 与 2CO 反应的产物
可观察到 D 处的实验现象有黑白两种固体产生。查阅资料黑色固体为碳单质,白色固体是镁
的化合物。为探究白色固体的成分,进行了假设与猜想。
(4)猜想 1 白色固体是 MgO
MgCO
3
猜想 2 白色固体是
�
猜想 3 白色固体是 ▲
(5)验证与结论取 D 中固体适量于试管,加入足量的 ▲ ,观察到:有黑色固体不溶物,白色固体
消失, ▲ 的现象,则猜想 1 成立。猜想 2 和猜想 3 不成立的可能原因是 ▲ 。
13.(4 分)瓦斯气的主要成分是 4CH ,存在煤矿坑道中。当煤矿坑道中瓦斯气达到一定浓度范围,遇明火
就会发生爆炸, 4CH 与 2O 恰好完全反应时(生成 2CO )爆炸最强烈。求煤矿坑道中瓦斯爆炸最强烈时
4CH 的体积百分含量(同温同压时,气体分子个数比等于其体积比)。
要求:写出计算过程,结果保留一位小数
湖北省荆门市 2019 年初中学业水平考试
化学答案解析
一、选择题
1.【答案】D
2.【答案】A
3.【答案】C
4.【答案】D
5.【答案】C
6.【答案】B
7.【答案】C
8.【答案】B
二、非选择题
9.【答案】(1)+5
�
(2) H
(3)增大
(4) 2
6C H O | 2
5C H OH
(5)维生素
10.【答案】(1)
Ca HCO
(
)
3 2
CaCO
3
CO
2
H
O
2
分解反应
(2) 2CO
N
(3) 3NH
NaHCO 的溶解度小,有沉淀生成
3
(4)4:5
2:1
11.【答案】(1)②④
(2)引流
(3)
Mg(OH)
2
(4)
2NaCl 2H O
2
电解
H
2
Cl
2
2NaOH
(5) 2H 不易储存和运输或生产 2H 的成本高(其他合理答案也可)
12.【答案】(1)关闭弹簧夹(或止水夹),从长颈漏斗加水使漏斗颈内的液面高于锥形瓶内的液面,静置
一段时间,两液面高度不变,则气密性好。
(2)除去 2CO 中的 HCl 气体
(3)b
a
(4) MgO 和
MgCO 的混合物
3
(5)稀硫酸|稀盐酸
无气体产生|无使石灰水变浑浊的气体产生
加热时氧化镁不能与二氧化碳反应|碳酸镁受热分解
13.【答案】解:设 4CH 的体积为 1V ,空气的体积为 2V ,则 2O 的体积为 2V 21%
�
CO 2H O
2
2
CH 2O
4
2
1
:
2
V :V 21%V :V 21 200
1
:
2
2
1
4CH % 21/ 200 21
(
)
9.5%
答:当 4CH 的体积百分含量为 9.5%时,瓦斯爆炸最强烈。
�











 2023年江西萍乡中考道德与法治真题及答案.doc
2023年江西萍乡中考道德与法治真题及答案.doc 2012年重庆南川中考生物真题及答案.doc
2012年重庆南川中考生物真题及答案.doc 2013年江西师范大学地理学综合及文艺理论基础考研真题.doc
2013年江西师范大学地理学综合及文艺理论基础考研真题.doc 2020年四川甘孜小升初语文真题及答案I卷.doc
2020年四川甘孜小升初语文真题及答案I卷.doc 2020年注册岩土工程师专业基础考试真题及答案.doc
2020年注册岩土工程师专业基础考试真题及答案.doc 2023-2024学年福建省厦门市九年级上学期数学月考试题及答案.doc
2023-2024学年福建省厦门市九年级上学期数学月考试题及答案.doc 2021-2022学年辽宁省沈阳市大东区九年级上学期语文期末试题及答案.doc
2021-2022学年辽宁省沈阳市大东区九年级上学期语文期末试题及答案.doc 2022-2023学年北京东城区初三第一学期物理期末试卷及答案.doc
2022-2023学年北京东城区初三第一学期物理期末试卷及答案.doc 2018上半年江西教师资格初中地理学科知识与教学能力真题及答案.doc
2018上半年江西教师资格初中地理学科知识与教学能力真题及答案.doc 2012年河北国家公务员申论考试真题及答案-省级.doc
2012年河北国家公务员申论考试真题及答案-省级.doc 2020-2021学年江苏省扬州市江都区邵樊片九年级上学期数学第一次质量检测试题及答案.doc
2020-2021学年江苏省扬州市江都区邵樊片九年级上学期数学第一次质量检测试题及答案.doc 2022下半年黑龙江教师资格证中学综合素质真题及答案.doc
2022下半年黑龙江教师资格证中学综合素质真题及答案.doc