2014 年福建省泉州市中考化学真题
(满分:100 分;考试时间:60 分钟)
友情提示:所有答案必须填写到答题卡相应的位置上。
毕业学校
姓名
考生号
可能用到的相对原子质量:H - 1
C - 12
O - 16
Na - 23
Al - 27
一、选择题[本题有 12 小题,其中 1—6 小题每题 2 分,7—12 小题每题 3 分,共 30 分。每
小题只有一个选项符合题意。请将各小题的选项(A、B、C、D)涂在答题卡上]
1.“清新指数”是空气清洁度的一种标准。下列做法对“清新指数”会产生不利影响....的是
A.提倡使用新能源
C.工 厂废气经处理达标后排放
2.下列物质由离子构成的是
B.开展植树造林
D.大力发展燃煤发电
A.氮气
B.氯化钠
C.金刚石
D.五氧化二磷
3.下列化肥中属于复合肥料的是
A.KNO3
B.(NH4)2SO4
C.Ca3(PO4)2
D.CO(NH2)2
4.硒在光照下导电能力提高近千倍,可用作静电复印硒鼓的材料。元素周期表中“硒”的
信息如右图所示。 下列关于硒元素说法错误..的是
A.是非金属元素
B.原子序数为 34
C.相对原子质量为 78.96g
D.元素符号为 Se
5.没有水就没有生命。下列关于水的说法正确的是
34 Se
硒
78.96
A.水能溶解所有的物质
B.用肥皂水可区分硬水和软水
C.洗涤剂可使油污溶解在水中
D.通过活性炭吸附可将海水淡化
6.下列实验操作正确的是
7.下列化学用语书写正确的是
A.1 个铁离子:Fe3+
C.氧化镁:MgO2
8.在日常生活中,下列做法正确的是
B.3 个氧分子:3O
D.2 个氮原子:N2
A.用甲醛浸泡虾仁
B.焙制糕点时添加含小苏打的发酵粉
C.用霉变的谷物做饲料
D.为防止骨质疏松,长期摄入过量的钙元素
9.下图是某个化学反应的微观示意图,从示意图中获取的信息正确的是
�
A.图①分子中两种原子的个数比为 1:4
B.图②对应的物质是化合物
C.反应前后原子的种类和个数不变
D.两种生成物的分子个数比为 1:2
10.为增加食品酸味常使用柠檬酸(C6H8O7)。有关柠檬酸的说法不正确...的是
A.是有机化合物
B.碳元素的质量分数为 37.5%
C.氢元素与氧元素的质量比为 8:7
D.一个柠檬酸分子由 6 个碳原子、8 个氢原子和 7 个氧原子构成
11.硬铝的组成金属有铝、镁、铜、锰。已知:锰丝放入稀硫酸中,有气泡产生;锰丝放入
硫酸铝溶液中,表面没有金属析出。下列有关金属的活动性强弱判断错误..的是
A.Mn > Cu
B.Al > Mn
C.Mg > Al
D.Mn > Mg
12.甲、乙两种固体物质的溶解度曲线如右图所示。下列
说法正确的是
A.甲的溶解度大于乙的溶解度
B.升高温度可使甲的不饱和溶液变为饱和溶液
C.t1℃时,甲、乙两种饱和溶液的溶质质量分数相等
D.t2℃时,50g 乙加入 100g 水中得到乙的不饱和溶液
二、填空与简答题(本题有 3 小题,共 29 分)
13.(9 分)化学是造福人类的科学。请利用所学知识回答下列问题。
I.化学帮助我们正确认识物质
(1)氧气可用于
(填一种用途),但氧气也是导致铁锈蚀的因素
之一。写出防止铁生锈的一种方法:
。
II.化学指导人类合理利用资源
(2)下图是化学家研究出的高效、经济的制氢途径。
�
途径 1:常用二氧化钛(TiO2)作催化剂。二氧化钛中钛元素的化合价为
。
途径 2:电解水是将电能转化为
能。
III.化学促进科学技术的 发展
(3)科学家研制出有“自我修复能力”的塑料。塑料属于
(选填 “无机”、“合
成”或“复合”)材料。
(4)二氧化硅(SiO2)可用于制造光导纤维。氧气和四氯化硅蒸气(SiCl4)在高温
条件下可反应生成二氧化硅和氯气(Cl2),该反应的化学方程式是
。
14.(10 分)泉州是东亚文化之都,旅游资源丰富,请你一起领略泉州的魅力。
(1)泉州小吃“牛肉羹”的主要原料有牛肉、地瓜粉等,其中富含蛋白质的是
。
(2)品尝名茶“铁观音”习惯先闻茶香。从微粒的观点解释能闻到茶香的主要原因
是
。
(3)泉州特色民俗表演“火鼎公婆”是利用木炭在铁锅中燃烧来制造“火鼎”效果,
演员摇动扇子让木炭燃烧更剧烈,其化学原理是
木炭完全燃烧的化学方程式:
。
。
(4)泉州古民居“蚝壳厝”的建筑材料之一是海蛎壳。检验海 蛎壳含有碳酸盐的方法
是
(写出实验步骤、现象和结论)。
15.(10 分)下图是化学园地中一张表示物质间反应关系的卡片图(“——”表示相连的
两种物质能够在溶液体系中发生化学反应),其中 A、B、C 三处的卡片尚未粘贴。
请你思考一种粘贴方案,并回答下列问题:
(1)A 处贴上的卡片可以是
(写卡片中的化学式)。
(2)B 处卡片中的物质属于
(选填“酸”、“碱”或“盐”)。
(3)C 处卡片中的物质与 Fe 反应的化学方程式为
,该
反应的基本类型是
反应。
(4)你认为下列物质可用来替换“Fe”位置的是
(填序号)。
① NaOH
② Zn
③ Ag
④ Fe2O3
三、实验与探究题(本题有 2 小题,共 31 分)
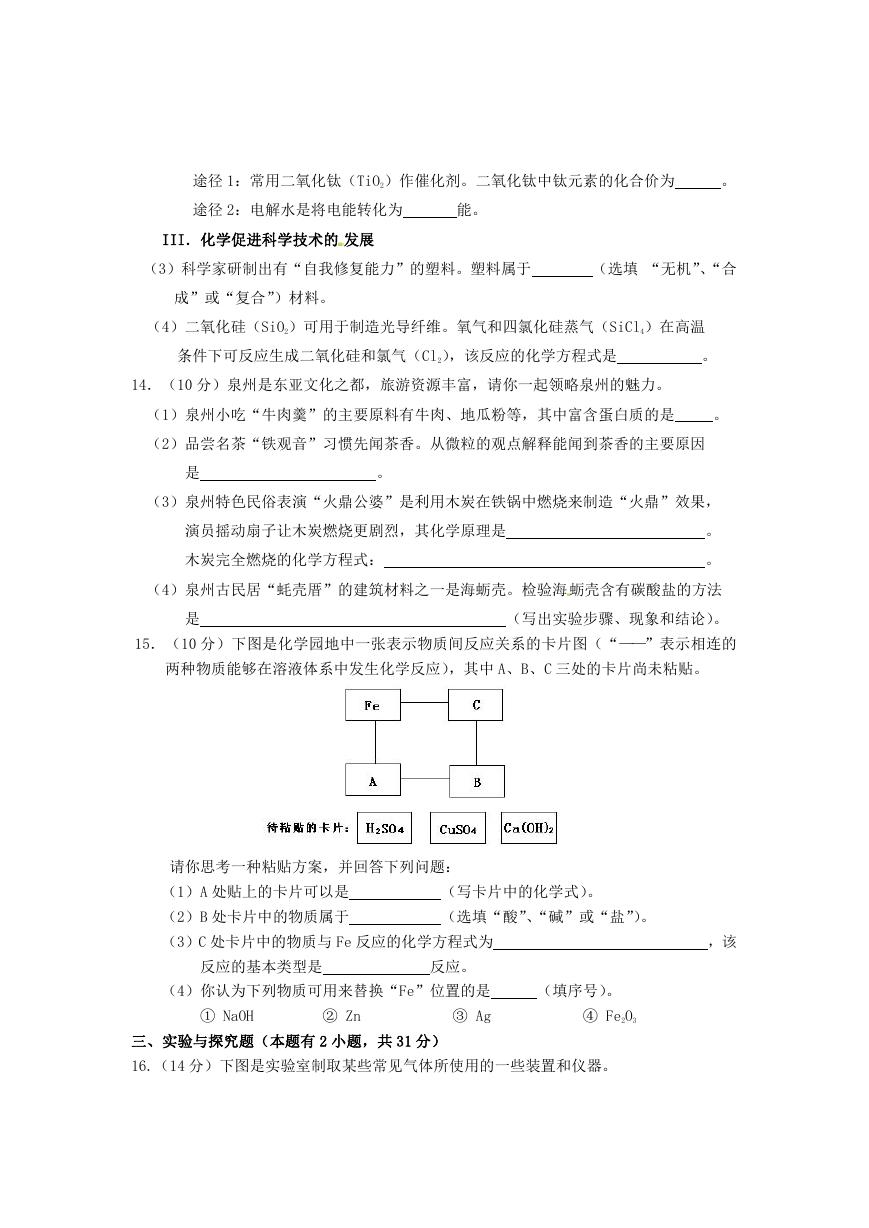
16.(14 分)下图是实验室制取某些常见气体所使用的一些装置和仪器。
�
(1)从图 1 的装置中任意选择一种仪器,写出它的名称:
,简要说出它的
用途:
。
(2)写出实验室制取氧气的一个化学方程式:
,用该
方法制取氧气的发生装置可选择图 1 中的
(填标号)。
(3)实验室制取二氧化碳选择的药品是
和
。收集二氧化碳通常
选择图 2 中的
(填标号)仪器进行组合。欲收集满一瓶二氧化碳气体,
收集一段时间后,将燃着的木条放在集气瓶口,若观察到火焰熄灭,则接下来应进行
的操作是
;若火焰不熄灭,则可能的原因是
。
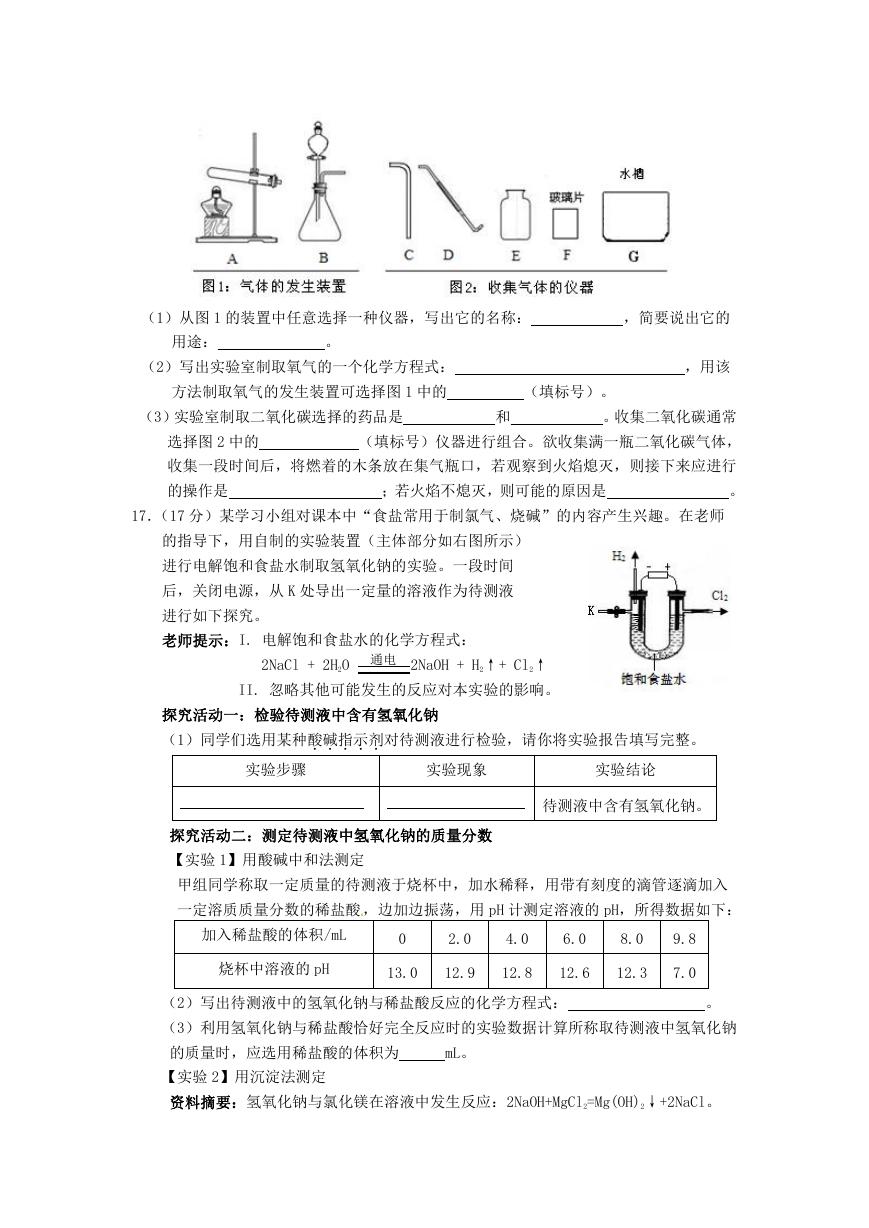
17.(17 分)某学习小组对课本中“食盐常用于制氯气、烧碱”的内容产生兴趣。在老师
的指导下,用自制的实验装置(主体部分如右图所示)
进行电解饱和食盐水制取氢氧化钠的实验。一段时间
后,关闭电源,从 K 处导出一定量的溶液作为待测液
进行如下探究。
老师提示:I. 电解饱和食盐水的化学方程式:
2NaCl + 2H2O
通电
2NaOH + H2↑+ Cl2↑
II. 忽略其他可能发生的反应对本实验的影响。
探究活动一:检验待测液中含有氢氧化钠
(1)同学们选用某种酸碱指示剂
.....对待测液进行检验,请你将实验报告填写完整。
实验步骤
实验现象
实验结论
待测液中含有氢氧化钠。
探究活动二:测定待测液中氢氧化钠的质量分数
【实验 1】用酸碱中和法测定
甲组同学称取一定质量的待测液于烧杯中,加水稀释,用带有刻度的滴管逐滴加入
一定溶质质量分数的稀盐酸 ,边加边振荡,用 pH 计测定溶液的 pH,所得数据如下:
加入稀盐酸的体积/mL
0
2.0
4.0
6.0
8.0
9.8
烧杯中溶液的 pH
13.0
12.9
12.8
12.6
12.3
7.0
(2)写出待测液中的氢氧化钠与稀盐酸反应的化学方程式:
。
(3)利用氢氧化钠与稀盐酸恰好完全反应时的实验数据计算所称取待测液中氢氧化钠
的质量时,应选用稀盐酸的体积为
mL。
【实验 2】用沉淀法测定
资料摘要:氢氧化钠与氯化镁在溶液中发生反应:2NaOH+MgCl2=Mg(OH)2↓+2NaCl。
�
乙组同学按下图所示的实验步骤进行实验:
①
取待测液
称重
②
加入足量
氯化镁溶液
③
过滤出
沉淀物
④
洗涤
沉淀
⑤
干燥
称重
(4)步骤②加入的氯化镁溶液必需足量,其目的是
。滴加一定量氯化镁溶
液后,判断所加氯化镁溶液是否足量的具体操作: 静置,
(5)步骤③过滤出的沉淀物是
。
(6)利 用 沉淀 物 的 质 量 计算 氢 氧 化 钠 的质 量 分 数 , 若缺 少 步 骤 ④的 操 作, 所
测 定 氢氧化钠的质量分数将
(选填“偏大”、“偏小”或“没影响”)。
(写出实验步骤、现象和结论)。
四、计算题(本题有 2 小题,共 10 分)
18.(5 分)“84 消毒液”广泛应用于物体表面的消毒,其有效成分是次氯酸钠。
(1)50g 溶质质量分数为 12%的次氯酸钠溶液中,需要固体次氯酸 钠
g。
水
mL
(2)可将上述溶液稀释成溶质质量分 数为 0.2%的次氯酸钠溶液
g。
19.(5 分)工业上常用 NaOH 溶液处理铝土矿(主要成分 Al2O3),反应的化学方程式:Al2O3+2NaOH
=2NaAlO2+H2O。欲对含 Al2O3 204 t 的铝土矿进行处理(杂质不参与反应),理论上
需要消耗 NaOH 的质量为多少?
�








 2023年江西萍乡中考道德与法治真题及答案.doc
2023年江西萍乡中考道德与法治真题及答案.doc 2012年重庆南川中考生物真题及答案.doc
2012年重庆南川中考生物真题及答案.doc 2013年江西师范大学地理学综合及文艺理论基础考研真题.doc
2013年江西师范大学地理学综合及文艺理论基础考研真题.doc 2020年四川甘孜小升初语文真题及答案I卷.doc
2020年四川甘孜小升初语文真题及答案I卷.doc 2020年注册岩土工程师专业基础考试真题及答案.doc
2020年注册岩土工程师专业基础考试真题及答案.doc 2023-2024学年福建省厦门市九年级上学期数学月考试题及答案.doc
2023-2024学年福建省厦门市九年级上学期数学月考试题及答案.doc 2021-2022学年辽宁省沈阳市大东区九年级上学期语文期末试题及答案.doc
2021-2022学年辽宁省沈阳市大东区九年级上学期语文期末试题及答案.doc 2022-2023学年北京东城区初三第一学期物理期末试卷及答案.doc
2022-2023学年北京东城区初三第一学期物理期末试卷及答案.doc 2018上半年江西教师资格初中地理学科知识与教学能力真题及答案.doc
2018上半年江西教师资格初中地理学科知识与教学能力真题及答案.doc 2012年河北国家公务员申论考试真题及答案-省级.doc
2012年河北国家公务员申论考试真题及答案-省级.doc 2020-2021学年江苏省扬州市江都区邵樊片九年级上学期数学第一次质量检测试题及答案.doc
2020-2021学年江苏省扬州市江都区邵樊片九年级上学期数学第一次质量检测试题及答案.doc 2022下半年黑龙江教师资格证中学综合素质真题及答案.doc
2022下半年黑龙江教师资格证中学综合素质真题及答案.doc