2010 年北京高考理科综合真题及答案
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,第Ⅰ卷 1 至 4 页,第Ⅱ卷 5 至
13 页,共 300 分。考试时长 150 分钟。考生务必将答案答在答题卡上,在试卷上作答无效。
考试结束后,将本试卷和答题卡一并交回。
以下数据可供解题时参考:
可能用到的相对原子质量:H 1
Mg 24
Al 27
O
C 12
16
第Ⅰ卷 (选择题 共 120 分)
N 14
本卷共 20 小题,每小题 6 分,共 120 分。在每小题列出的四个选项中,选出符合题目
要求的一项。
1. 在家庭中用鲜葡萄制作果酒时,正确的操作是
A.让发酵装置接受光照
C.向发酵装置通入空气
B.给发酵装置适时排气
D.酵母菌装置放在 45℃处
2.下列对生物细胞代谢活动的描述,不正确...的是
A.大肠杆菌在拟核区转录信使RNA
B.乳酸杆菌在细胞质基质中产乳酸
C.衣藻进行光合作用的场所是叶绿体
D.酵母菌的高尔基体负责合成蛋白质
3.以下依据神经细胞功能做出的判断,不正确...的是
A.膝跳反射弧中传出(运动)神经元的轴突较长
B.膝跳反射弧中传入(感觉)神经元的树突较多
C.突触前膜释放的递质(如乙酰胆碱)始终不被酶分解
D.分泌肽类激素旺盛的神经细胞核糖体较多
4.决定小鼠毛色为黑(B)/褐(b)色、有(s)/无(S)白斑的两对等位基因
分别位于两对同源染色体上。基因型为 BbSs 的小鼠间相互交配,后代中出现黑色有白斑小
鼠的比例是
A.1/16
B.3/16
C.7/16
D.9/16
5.保护生物多样性是实现人类社会可持续发展的基础。下列对生物多样性的理解正确
的是
A.生物多样性的丰富程度与自然选择无关
B.群落演替过程中的生物多样性逐渐降低
C.物种多样性比较高的生态系统相对稳定
D.遗传多样性较低的种群适应环境能力强
6.下列有关钢铁腐蚀与防护的说法正确的是
A.钢管与电源正极连接,钢管可被保护
B.铁遇冷浓硝酸表面钝化,可保护内部不被腐蚀
C.钢管与铜管露天堆放在一起,钢管不易被腐蚀
D.钢铁发生析氢腐蚀时,负极反应是
Fe
3
e
Fe
3
7.下列物质与常用危险化学品的类别不对应...的是
A. 2
H SO 、 NaOH ——腐蚀品
4
B. 4
CH 、
4C H
2
——易燃液体
C.
2CaC 、Na ——遇湿易燃物品
D.
KMnO
、KCr ——氧化剂
4
O2 2
7
�
8.下列说法正确的是
A.
的结构中含有脂基
B.顺-2-丁烯和反-2-丁烯的加氢产物不同
C.1 mol 葡萄糖可水解生成2 mol 乳酸( 3
C H O )
6
3
D.幼稚和蛋白质都是能发生水解反应的高分子化合物
9.用右图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应。下列实验不合..
理.的是
A.上下移动①中铜丝可控制 2SO 的量
B.②中选用品红溶液验证 2SO 的生成
C.③中选用NaOH溶液吸收多余的 2SO
D.为确认
CuSO 生成,向①中加水,观察颜色
4
10.下列解释实验事实的方程式不正确...的是
A.0.1 mol /L 3CH COOH 溶液的PH>1: 3CH COOH
3CH COO H
B.“ 2NO 球”浸泡在冷水中,颜色变浅2 2NO (g)
4N O
2
(g)△H<0
C.铁溶于稀硝酸,溶液变黄:3Fe+8H++2N 3O
3Fe2++2NO↑+4H2
(红棕色)
(无色)
O
D.向Na2CO3溶液中滴入酚酞溶液,溶液变红: 2
CO
3
H O
2
HCO OH
3
11.自然界地表层原生铜的硫化物经氧化、淋滤作用后变成CuSO4溶液,向地下层渗
透,遇到难溶的ZnS或PbS,慢慢转变为铜蓝(CuS)。下列分析正确的是
A.CuS的溶解度大于PbS的溶解度
B.原生铜的硫化物具有还原性,而铜蓝没有还原性
C.CuSO4与ZnS反应的离子方程式是 2
Cu
S
2
CuS↓
D.整个过程涉及的反应类型有氧化还原反应和复分解反应
�
12.某温度下, 2
( )
H g CO g
( )
2
( )
H O g CO g
( )
2
的平衡常数
K .该温度
9
4
下在甲、乙、丙三个恒容密闭容器中,
投入H2(g)和CO2(g),其起始浓度
如右表所示。下列判断不正确...的是
A.平衡时,乙中CO2的转化率大于 60%
B.平衡时,甲中和丙中H2的转化率均是
60%
C.平衡时,丙中c(CO2)是甲中的 2 倍,是 0.012mol/L
D.反应开始时,丙中的反应速率最快,甲中的反应速率最慢
13.属于狭义相对论基本假设的是:在不同的惯性系中,
A.真空中光速不变
C.物体的质量不变
B.时间间隔具有相对性
D.物体的能量与质量成正比
14.对于红、黄、绿、蓝四种单色光,下列表述正确的是
A.在相同介质中,绿光的折射率最大
C.在相同介质中,蓝光的波长最短
15.太阳因核聚变释放出巨大的能量,同时其质量不断减少。太阳每秒钟辐射出的能量约
为4×1026J,根据爱因斯坦质能方程,太阳每秒钟减少的质量最接近
A.1036Kg
16.一物体静置在平均密度为的球形天体表面的赤道上。已知万有引力常量G,若由
于天体自转使物体对天体表面压力恰好为零,则天体自转周期为
B.红光的频率最高
D.黄光光子的能量最小
C.1013Kg
B.1018Kg
D.109Kg
A.
1
2
4(
)
3G
B.
(
1
2
3
)
4 G
C.
1
2
(
)
G
D.
1
2
3(
)
G
17.一列横波沿 x 轴正向传播,a,b,c,d为介质中的沿波传播方向上四个质点的平
衡位置。某时刻的波形如图1所示,此后,若经过3/4周期开始计时,则图2描述的是
A.a处质点的振动图像
C.c处质点的振动图像
B.b处质点的振动图像
D.d处质点的振动图像
18.用控制变量法,可以研究影响平行板电容器的因素(如图)。设两极板正对面积为S,
极板间的距离为d,静电计指针偏角为。实
验中,极板所带电荷量不变,若
A. 保持 S 不变,增大 d,则变大
�
B. 保持 S 不变,增大 d,则变小
C. 保持 d 不变,增大 S,则变小
D. 保持 d 不变,增大 S,则不变
19.在如图所示的电路中,两个相同的下灯泡 L1 和 L2 分别串联一个
带铁芯的电感线圈 L 和一个滑动变阻器 R。闭合开关 S 后,调整 R,
使 L1 和 L2 发光的亮度一样,此时流过两个灯泡的电流为I。然后,
断开S。若t 时刻再闭合S,则在t 前后的一小段时间内,正确反
映流过 L1 的电流i1、流过L2的电流i2随时间t的变化的图像是
20.如图,若x轴表示时间,y轴表示位置,则该图像反映了某质
点做匀速直线运动时,位置与时间的关系。若令x轴和y轴分别表示
其他的物理量,则该图像又可以反映在某种情况下,相应的物理量之
间的关系。下列说法中正确的是
A.若x轴表示时间,y轴表示动能,则该图像可以反映某物体受恒
定合外力作用做直线运动过程中,物体动能与时间的关系
B.若x轴表示频率,y轴表示动能,则该图像可以反映光电效应中,光电子最大初动能与
入射光频率之间的关系
C.若x轴表示时间,y轴表示动量,则该图像可以反映某物体在沿运动方向的恒定合外力
作用下,物体动量与时间的关系
D.若x轴表示时间,y轴表示感应电动势,则该图像可以反映静置于磁场中的某闭合回路,
当磁感应强度随时间均匀增大时,闭合回路的感应电动势与时间的关系
第Ⅱ卷(非选择题 共 180 分)
本卷共 11 小题,共 180 分。
21.(18分)
(1)甲同学要把一个量程为 200 A 的直流电流计 ,改装成量度范围是 0~4V的直流
电压表。
�
1 她按图1所示电路、用半偏法测定电流计 的内电阻 rg,其中电阻R0 约为1 k 。为
使 rg 的测量值尽量准确,在以下器材中,电源E应选用______________,电阻器R1 应
选用______________,电阻器R2 应选用______________(选填器材前的字母)
A.电源(电动势 1.5V)
C.电阻箱(0~999.9 )
E.电位器(一种可变电阻,与滑动变阻器相当)(0~5.1 k )
F.电位器(0~51 k )
D.滑动变阻器(0~500 )
B.电源(电动势 6V)
②该同学在开关断开情况下,检查电路连接无误后,将R2的阻值调至最大。后续的实验操
作步骤依次是______________,______________,______________,______________,最后
记录R1 的阻值并整理好器材。(请按合理的实验顺序,选填下列步骤前的字母)
A.闭合S1
B.闭合S2
C.调节R2的阻值,使电流计指针偏转到满刻度
D.调节R2的阻值,使电流计指针偏转到满刻度的一半
E.调节R1的阻值,使电流计指针偏转到满刻度的一半
F.调节R1的阻值,使电流计指针偏转到满刻度
③ 如 果 所 得 的 R 1的 阻 值 为 300.0 , 则 图 1 中 被 测 电 流 计 的 内 阻 r 的 测 量 值 为
______________ ,该测量值__________实际值(选填“略大于”、“略小于”或“等于”)。
④给电流计 __________联(选填“串”或“并”)一个阻值为__________ k 的电阻,就
可以将该电流计 改装为量程4V的电压表。
(2)乙同学要将另一个电流计 改装成直流电压表,但他不仅借到一块标准电压表 、
一个电池组E、一个滑动变阻器 R 和几个待用的阻值准确的定值电阻。
①该同学从上述具体条件出发,先将带改装的表 直接与电压表 校准。请你画完图2
方框中的校准电路图。
2 实验中,当定值电阻R选用 17.0 k 时,调整滑动变阻器 R
�
的阻值,电压表 的示数是 4.0V时,表 的指针恰好指到满量程的五分之二;当R
选用 7.0 k 时,调整 R 的阻值,电压表 的示数是 2.0V时,表 的指针又指到满
量程的五分之二。
由此可以判定,表 的内阻rg是_______ k ,满偏电流 gI 是_______mA。若
要将表 改装为量程是 15V的电压表,应配备一个_______ k 的电阻。
22.(16分)
如图,跳台滑雪运动员经过一段加速滑行后
从O点水平飞出,经过 3.0s罗到斜坡上的A点。已
知 O 点 是 斜 坡的 起 点 , 斜 坡 与 水 平 面 的 夹角=
37°,运 动员 的质量 m=50kg.不计 空气 阻力 。( 取
sin37°=0.60,cos37°=0.80;g 取 10m/s2)q 求
(1) A 点与 O 点时的速度大小;
(2) 运动员离开 0 点时的速度大小;
(3) 运动员落到 A 点时的动能。
23.(18 分)
利用霍尔效应制作的霍尔元件以及传感器,广泛应用于测量和自动控制等领域。
如图 1,将一金属或半导体薄片垂直至于磁场 B 中,在薄片的两个侧面 a 、b 间通以电
流 I 时,另外两侧 c 、 f 间产生电势差,这一现象称霍尔效应。其原因是薄片中的移动电荷
受洛伦兹力的作用相一侧偏转和积累,于是c、 f 间建立起电场EH,同时产生霍尔电势差
UH。当电荷所受的电场力与洛伦兹力处处相等时,EH和UH达到稳定值,UH的大小与 I 和
U
B 以及霍尔元件厚度 d 之间满足关系式 H
,其中比例系数RH称为霍尔系数,仅
IB
d
R
H
与材料性质有关。
(1) 设半导体薄片的宽度(c、 f 间距)为l ,请写出UH和EH的关系式;若半导体材
料是电子导电的,请判断图1中c、 f 哪端的电势高;
(2) 已知半导体薄片内单位体积中导电的电子数为n,电子的电荷量为e,请导出霍尔
�
系数RH的表达式。(通过横截面积S的电流 I
的平均速率);
nevS
,其中 v 是导电电子定向移动
(3) 图 2 是霍尔测速仪的示意图,将非磁性圆盘固定在转轴上,圆盘的周边等距离地嵌
装着m个永磁体,相邻永磁体的极性相反。霍尔元件置于被测圆盘的边缘附近。当
圆盘匀速转动时,霍尔元件输出的电压脉冲信号图像如图3所示。
a.若在时间t内,霍尔元件输出的脉冲数目为 P ,请导出圆盘转速 N 的表达式。
b.利用霍尔测速仪可以测量汽车行驶的里程。除除此之外,请你展开“智慧的翅膀”,
提出另一个实例或设想。
24.(20 分)
雨滴在穿过云层的过程中,不断与漂浮在云层中的小水珠相遇并结合为一体,其质
量逐渐增大。现将上述过程简化为沿竖直方向的一系列碰撞。已知雨滴的初始质量为 0m ,
初速度为 0v ,下降距离 l 后于静止的小水珠碰撞且合并,质量变为 1m 。此后每经过同样的
距离l 后,雨滴均与静止的小水珠碰撞且合并,质量依次为 2m 、 3m ...... nm ......(设
各质量为已知量)。不计空气阻力。
(1) 若不计重力,求第 n 次碰撞后雨滴的速度 nv ;
(2) 若考虑重力的影响,
a.求第1次碰撞前、后雨滴的速度 1v 和 1v ;
b.求第n次碰撞后雨滴的动能
1
2 n nm v 。
2
25.(14分)
由短周期元素组成的化合物...X是某抗酸药的有效成分。甲同学欲探究X的组成。
查阅资料:①由短周期元素组成的抗酸药的有效成分有碳酸氢钠、碳酸镁、氢氧化铝、硅酸
镁铝、磷酸铝、碱式碳酸镁铝。
②Al3+在pH=5.0 时沉淀完全;
Mg2+在pH=8.8 时开始沉淀,在pH=11.4 时沉淀完全。
实验过程:
Ⅰ.向化合物X粉末中加入过量盐酸,产生气体A,得到无色溶液。
Ⅱ.用铂丝蘸取少量I中所得的溶液,在火焰上灼烧,无黄色火焰。
Ⅲ.向I中所得的溶液中滴加氨水,调节pH至5~6,产生白色沉淀B,过滤。
Ⅳ.向沉淀B中加过量 NaOH 溶液,沉淀全部溶解。
Ⅴ.向Ⅲ中得到的滤液中滴加 NaOH 溶液,调节pH 至 12,得到白色沉淀C。
(1) Ⅰ中气体A可使澄清石灰水变浑浊,A的化学式是__________。
(2) 由Ⅰ、Ⅱ判断 X 一定不含有...的元素是磷、_____________。
(3) Ⅲ中生成 B 的离子方程式是_____________。
(4) Ⅳ中 B 溶解的离子方程式是_____________。
(5) 沉淀 C 的化学式是_____________。
�
(6) 若上述 n(A):n(B):n(C)=1:2:3,则 X 的化学式是_____________。
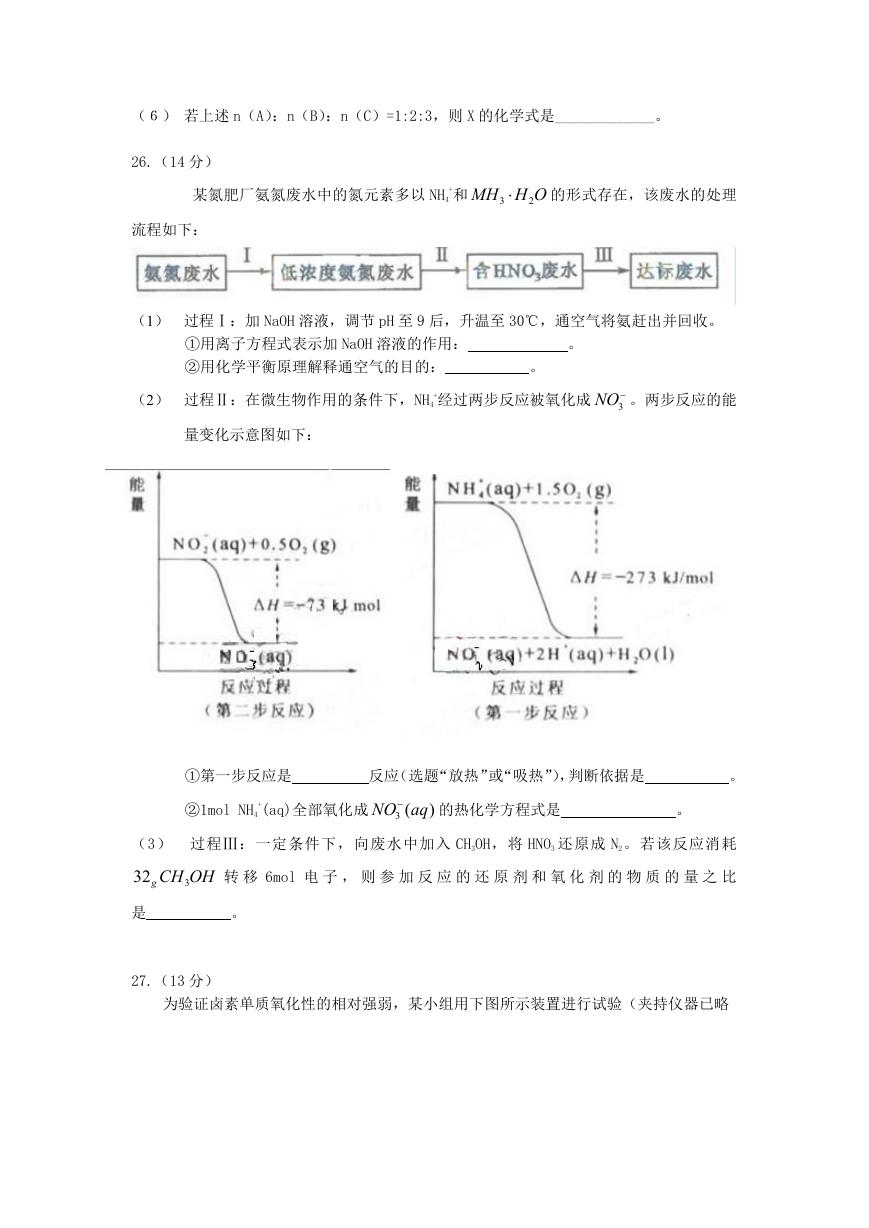
26.(14 分)
某氮肥厂氨氮废水中的氮元素多以 NH4
+和
流程如下:
MH H O
3
2
的形式存在,该废水的处理
(1) 过程Ⅰ:加 NaOH 溶液,调节 pH 至 9 后,升温至 30℃,通空气将氨赶出并回收。
①用离子方程式表示加 NaOH 溶液的作用:
②用化学平衡原理解释通空气的目的:
。
。
(2) 过程Ⅱ:在微生物作用的条件下,NH4
+经过两步反应被氧化成 3NO 。两步反应的能
量变化示意图如下:
①第一步反应是
反应(选题“放热”或“吸热”),判断依据是
。
②1mol NH4
+(aq)全部氧化成 3 (
NO aq
)
的热化学方程式是
。
(3) 过程Ⅲ:一定条件下,向废水中加入 CH3OH,将 HNO3 还原成 N2。若该反应消耗
32g CH OH 转 移 6mol 电 子 , 则 参 加 反 应 的 还 原 剂 和 氧 化 剂 的 物 质 的 量 之 比
3
是
。
27.(13 分)
为验证卤素单质氧化性的相对强弱,某小组用下图所示装置进行试验(夹持仪器已略
�















 2023年江西萍乡中考道德与法治真题及答案.doc
2023年江西萍乡中考道德与法治真题及答案.doc 2012年重庆南川中考生物真题及答案.doc
2012年重庆南川中考生物真题及答案.doc 2013年江西师范大学地理学综合及文艺理论基础考研真题.doc
2013年江西师范大学地理学综合及文艺理论基础考研真题.doc 2020年四川甘孜小升初语文真题及答案I卷.doc
2020年四川甘孜小升初语文真题及答案I卷.doc 2020年注册岩土工程师专业基础考试真题及答案.doc
2020年注册岩土工程师专业基础考试真题及答案.doc 2023-2024学年福建省厦门市九年级上学期数学月考试题及答案.doc
2023-2024学年福建省厦门市九年级上学期数学月考试题及答案.doc 2021-2022学年辽宁省沈阳市大东区九年级上学期语文期末试题及答案.doc
2021-2022学年辽宁省沈阳市大东区九年级上学期语文期末试题及答案.doc 2022-2023学年北京东城区初三第一学期物理期末试卷及答案.doc
2022-2023学年北京东城区初三第一学期物理期末试卷及答案.doc 2018上半年江西教师资格初中地理学科知识与教学能力真题及答案.doc
2018上半年江西教师资格初中地理学科知识与教学能力真题及答案.doc 2012年河北国家公务员申论考试真题及答案-省级.doc
2012年河北国家公务员申论考试真题及答案-省级.doc 2020-2021学年江苏省扬州市江都区邵樊片九年级上学期数学第一次质量检测试题及答案.doc
2020-2021学年江苏省扬州市江都区邵樊片九年级上学期数学第一次质量检测试题及答案.doc 2022下半年黑龙江教师资格证中学综合素质真题及答案.doc
2022下半年黑龙江教师资格证中学综合素质真题及答案.doc