2023 年山东普通高中学业水平等级考试化学真题及答案
可能用到的相对原子质量:H-1
C-12
N-14
O-16
F-19
Si-28
S-32
C1-35.5
K-39
Cu-64
一、选择题:本题共 10 小题,每小题 2 分,共 20 分。每小题只有一个选项符合题目要求。
1. 下列之物具有典型的齐鲁文化特色,据其主要化学成分不能与其他三种归为一类的是
A. 泰山墨玉
B. 龙山黑陶
C. 齐国刀币
D. 淄博琉璃
2. 实验室中使用盐酸、硫酸和硝酸时,对应关系错误的是
A. 稀盐酸:配制
3AlCl 溶液
B. 稀硫酸:蔗糖和淀粉的水解
C. 稀硝酸:清洗附有银镜的试管
D. 浓硫酸和浓硝酸的混合溶液:苯的磺化
3. 下列分子属于极性分子的是
A.
2CS
B.
3NF
C.
3SO
D.
4SiF
4. 实验室安全至关重要,下列实验室事故处理方法错误的是
A. 眼睛溅进酸液,先用大量水冲洗,再用饱和碳酸钠溶液冲洗
B. 皮肤溅上碱液,先用大量水冲洗,再用 2% 的硼酸溶液冲洗
C. 电器起火,先切断电源,再用二氧化碳灭火器灭火
D. 活泼金属燃烧起火,用灭火毛(石棉布)灭火
5. 石墨与 F2 在 450℃反应,石墨层间插入 F 得到层状结构化合物(CF)x,该物质仍具润滑性,其单层局部结
构如图所示。下列关于该化合物的说法正确的是
A. 与石墨相比,(CF)x 导电性增强
B. 与石墨相比,(CF)x 抗氧化性增强
C. (CF)x 中C C 的键长比 C F 短
D. 1mol(CF)x 中含有 2xmol 共价单键
6. 鉴别浓度均为
0.1mol L
的
1
NaClO Ba(OH)
、
2
Al SO 三种溶液,仅用下列一种方法不可行的
、
2
4 3
�
是
A. 测定溶液 pH
C. 滴加
0.1mol L KI
1
溶液
B. 滴加酚酞试剂
D. 滴加饱和 2
Na CO 溶液
3
7. 抗生素克拉维酸的结构简式如图所示,下列关于克拉维酸的说法错误的是
A. 存在顺反异构
B. 含有 5 种官能团
C. 可形成分子内氢键和分子间氢键
D. 1mol 该物质最多可与 1molNaOH 反应
8. 一定条件下,乙酸酐
CH CO O
3
2
CH CO O ROH
CH COOR CH COOH
3
3
3
2
醇解反应
可进行完全,利用此反应定量测定有机醇
ROH 中的羟基含量,实验过程中酯的水解可忽略。实验步骤如
下:
①配制一定浓度的乙酸酐-苯溶液。
②量取一定体积乙酸酐-苯溶液置于锥形瓶中,加入 mgROH 样品,充分反应后,加适量水使剩余乙酸酐完
全水解:
CH CO O H O
3
2
2CH COOH
3
。
2
③加指示剂并用
cmol L NaOH-
1
甲醇标准溶液滴定至终点,消耗标准溶液 1V mL 。
④在相同条件下,量取相同体积的乙酸酐-苯溶液,只加适量水使乙酸酐完全水解;加指示剂并用
cmol L NaOH-
1
甲醇标准溶液滴定至终点,消耗标准溶液 2V mL 。对于上述实验,下列做法正确的是
A. 进行容量瓶检漏时,倒置一次即可
B. 滴入半滴标准溶液,锥形瓶中溶液变色,即可判定达滴定终点
C. 滴定读数时,应单手持滴定管上端并保持其自然垂直
D. 滴定读数时,应双手一上一下持滴定管
9. 一定条件下,乙酸酐
CH CO O
3
2
醇解反应
CH CO O ROH
CH COOR CH COOH
3
3
3
2
�
可进行完全,利用此反应定量测定有机醇
ROH 中的羟基含量,实验过程中酯的水解可忽略。实验步骤如
下:
①配制一定浓度的乙酸酐-苯溶液。
②量取一定体积乙酸酐-苯溶液置于锥形瓶中,加入 mgROH 样品,充分反应后,加适量水使剩余乙酸酐完
全水解:
CH CO O H O
3
2
2
2CH COOH
3
。
③加指示剂并用
cmol L NaOH-
1
甲醇标准溶液滴定至终点,消耗标准溶液 1V mL 。
④在相同条件下,量取相同体积的乙酸酐-苯溶液,只加适量水使乙酸酐完全水解;加指示剂并用
cmol L NaOH-
1
甲醇标准溶液滴定至终点,消耗标准溶液 2V mL 。ROH 样品中羟基含量(质量分数)计算
正确的是
A.
C.
c V -V 17
2
1000m
1
100%
0.5c V -V 17
2
1
1000m
100%
10. 一定条件下,乙酸酐
CH CO O
3
2
c V -V
2
1
1000m
17
100%
c 0.5V -V 17
2
1
1000m
100%
B.
D.
醇解反应
CH CO O ROH
CH COOR CH COOH
3
3
2
3
可进行完全,利用此反应定量测定有机醇
ROH
中的羟基含量,实验过程中酯的水解可忽略。实验步骤如下:
①配制一定浓度的乙酸酐-苯溶液。
②量取一定体积乙酸酐-苯溶液置于锥形瓶中,加入 mgROH 样品,充分反应后,加适量水使剩余乙酸酐完
全水解:
CH CO O H O
3
2
2
2CH COOH
3
。
③加指示剂并用
cmol L NaOH-
1
甲醇标准溶液滴定至终点,消耗标准溶液 1V mL 。
④在相同条件下,量取相同体积的乙酸酐-苯溶液,只加适量水使乙酸酐完全水解;加指示剂并用
cmol L NaOH-
1
甲醇标准溶液滴定至终点,消耗标准溶液 2V mL 。根据上述实验原理,下列说法正确的
是
A. 可以用乙酸代替乙酸酐进行上述实验
B. 若因甲醇挥发造成标准溶液浓度发生变化,将导致测定结果偏小
C. 步骤③滴定时,不慎将锥形瓶内溶液溅出,将导致测定结果偏小
D. 步骤④中,若加水量不足,将导致测定结果偏大
�
二、选择题:本题共 5 小题,每小题 4 分,共 20 分。每小题有一个或两个选项符合题目要求,全部选对得
4 分,选对但不全的得 2 分,有选错的得 0 分。
11. 利用热再生氨电池可实现
CuSO 电镀废液的浓缩再生。电池装置如图所示,甲、乙两室均预加相同的
4
CuSO 电镀废液,向甲室加入足量氨水后电池开始工作。下列说法正确的是
4
A. 甲室 Cu 电极为正极
B. 隔膜为阳离子膜
C. 电池总反应为:
2
Cu
4NH
Cu NH
3 4
3
2
D.
3NH 扩散到乙室将对电池电动势产生影响
12. 有机物 X
Y 的异构化反应如图所示,下列说法错误的是
A. 依据红外光谱可确证 X、Y 存在不同的官能团
B. 除氢原子外,X 中其他原子可能共平面
C. 含醛基和碳碳双键且有手性碳原子的 Y 的同分异构体有 4 种(不考虑立体异构)
D. 类比上述反应,
的异构化产物可发生银镜反应和加聚反应
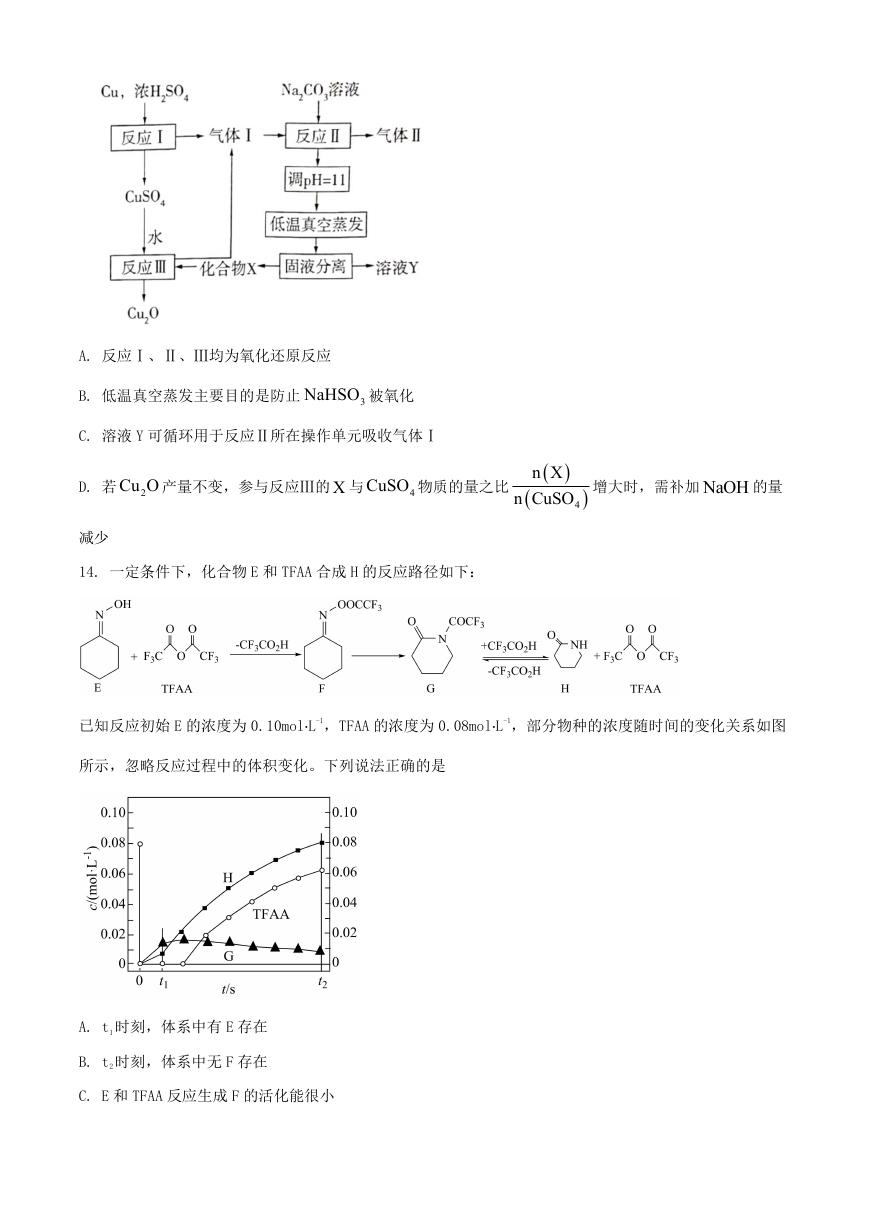
13. 一种制备 2Cu O 的工艺路线如图所示,反应Ⅱ所得溶液 pH 在 3~4 之间,反应Ⅲ需及时补加 NaOH 以
保持反应在 pH 5 条件下进行。常温下, 2
H SO 的电离平衡常数
3
K
al
1.3 10 , K
2
6.3 10
8
a2
。下列
说法正确的是
�
A. 反应Ⅰ、Ⅱ、Ⅲ均为氧化还原反应
B. 低温真空蒸发主要目的是防止
NaHSO 被氧化
3
C. 溶液 Y 可循环用于反应Ⅱ所在操作单元吸收气体Ⅰ
D. 若 2Cu O 产量不变,参与反应Ⅲ的 X 与
CuSO 物质的量之比
4
减少
14. 一定条件下,化合物 E 和 TFAA 合成 H 的反应路径如下:
n X
n CuSO 增大时,需补加 NaOH 的量
4
已知反应初始 E 的浓度为 0.10mol∙L-1,TFAA 的浓度为 0.08mol∙L-1,部分物种的浓度随时间的变化关系如图
所示,忽略反应过程中的体积变化。下列说法正确的是
A. t1 时刻,体系中有 E 存在
B. t2 时刻,体系中无 F 存在
C. E 和 TFAA 反应生成 F 的活化能很小
�
D. 反应达平衡后,TFAA 的浓度为 0.08mol∙L-1
15. 在含 HgI2(g)的溶液中,一定 c(I-)范围内,存在平衡关系:
HgI
2
s
HgI
2
aq
;
2HgI
aq
2
Hg
2I
;
2HgI
aq
2
HgI
aq
lgc HgI 、
3
2I
lgc HgI 随
HgI
2
2
4
4
,平衡常数依次为 0
;
HgI
HgI
I
;
、 、 、 、 。已知
HgI
lgc Hg 、
K K K K K
2
aq
3
I
2
1
2
3
4
lgc HgI ,
lgc I 的变化关系如图所示,下列说法错误的是
lgc HgI 的变化情况
2
4
A. 线 L 表示
B. 随
c I 增大,
c HgI
2
aq
先增大后减小
C.
a
lg
K
K
1
2
D. 溶液中 I 元素与 Hg 元素的物质的量之比始终为 2 :1
三、非选择题:本题共 5 小题,共 60 分。
16. 卤素可形成许多结构和性质特殊的化合物。回答下列问题:
(1) 40 ℃时, 2F 与冰反应生成 HOF 利 HF 。常温常压下, HOF 为无色气休,固态 HOF 的晶体类型
为_____, HOF 水解反应的产物为_____(填化学式)。
(2) 2ClO 中心原子为Cl , 2Cl O 中心原子为 O ,二者均为 V 形结构,但 2ClO 中存在大 π 键
中 Cl 原子的轨道杂化方式_____;为O Cl O
键角_____ Cl O Cl
键角(填“>”“ <”或“=”)。比
5
3Π 。 2ClO
较 2ClO 与 2Cl O 中Cl O 键的键长并说明原因_____。
(3)一定条件下,
CuCl K、 和 2F 反应生成 KCl 和化合物 X 。已知 X 属于四方晶系,晶胞结构如图所示
2
(晶胞参数 a
b c,α β γ 90
),其中Cu 化合价为 2 。上述反应的化学方程式为_____。若阿伏加
�
德罗常数的值为 AN ,化合物 X 的密度ρ _____
g cm
3
(用含 AN 的代数式表示)。
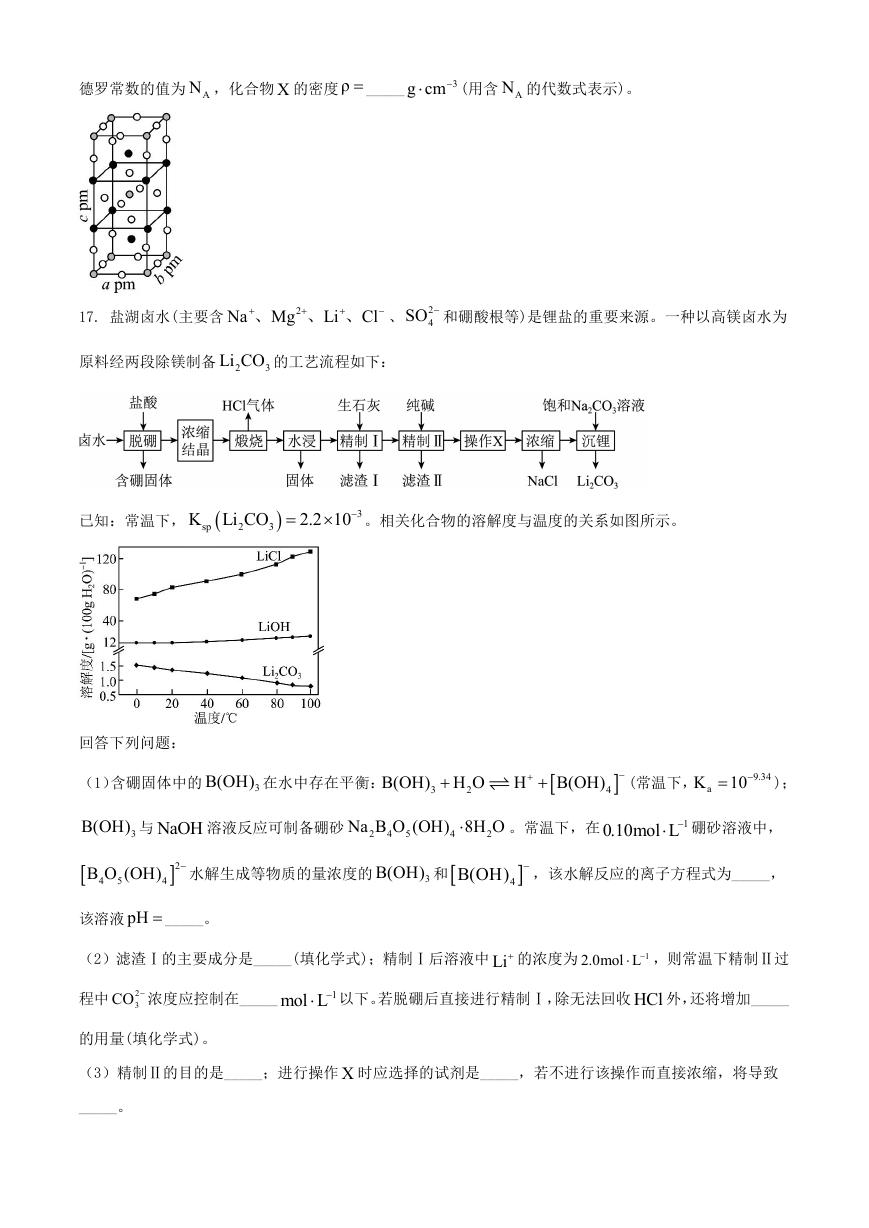
17. 盐湖卤水(主要含
Na Mg
、
2
、 、 、 2
Li Cl
4SO 和硼酸根等)是锂盐的重要来源。一种以高镁卤水为
原料经两段除镁制备 2
Li CO 的工艺流程如下:
3
已知:常温下,
K Li CO
sp
2
3
3
2.2 10
。相关化合物的溶解度与温度的关系如图所示。
回答下列问题:
(1)含硼固体中的
B(OH) 在水中存在平衡:
3
B(OH) H O
3
2
H
B(OH)
4
(常温下,
aK 10
9.34
);
B(OH) 与 NaOH 溶液反应可制备硼砂 2
Na B O (OH) 8H O
3
4
5
4
2
。常温下,在
0.10mol L 硼砂溶液中,
1
B O (OH)
4
5
2
4
水解生成等物质的量浓度的
B(OH) 和
3
B(OH)
4
,该水解反应的离子方程式为_____,
该溶液 pH _____。
(2)滤渣Ⅰ的主要成分是_____(填化学式);精制Ⅰ后溶液中 Li 的浓度为
2.0mol L
,则常温下精制Ⅱ过
1
程中 2
3CO 浓度应控制在_____
1
mol L
以下。若脱硼后直接进行精制Ⅰ,除无法回收 HCl 外,还将增加_____
的用量(填化学式)。
(3)精制Ⅱ的目的是_____;进行操作 X 时应选择的试剂是_____,若不进行该操作而直接浓缩,将导致
_____。
�
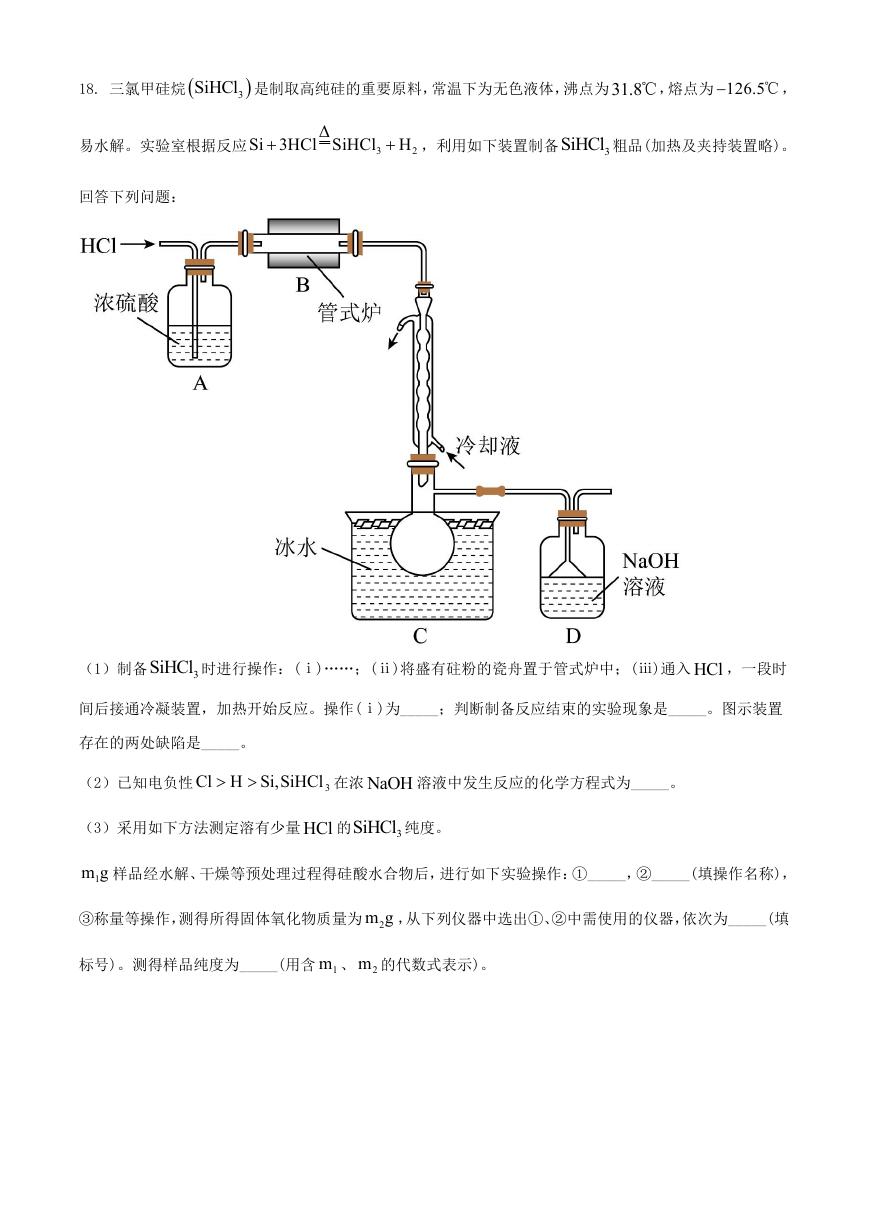
18. 三氯甲硅烷
SiHCl 是制取高纯硅的重要原料,常温下为无色液体,沸点为31.8℃,熔点为 126.5
℃ ,
3
Si 3HCl Si Cl H
H
,利用如下装置制备
SiHCl 粗品(加热及夹持装置略)。
3
Δ
3
2
易水解。实验室根据反应
回答下列问题:
(1)制备
SiHCl 时进行操作:(ⅰ)……;(ⅱ)将盛有砫粉的瓷舟置于管式炉中;(ⅲ)通入 HCl ,一段时
3
间后接通冷凝装置,加热开始反应。操作(ⅰ)为_____;判断制备反应结束的实验现象是_____。图示装置
存在的两处缺陷是_____。
(2)已知电负性
Cl H Si,SiHCl
在浓 NaOH 溶液中发生反应的化学方程式为_____。
3
(3)采用如下方法测定溶有少量 HCl 的
SiHCl 纯度。
3
1m g 样品经水解、干燥等预处理过程得硅酸水合物后,进行如下实验操作:①_____,②_____(填操作名称),
③称量等操作,测得所得固体氧化物质量为 2m g ,从下列仪器中选出①、②中需使用的仪器,依次为_____(填
标号)。测得样品纯度为_____(用含 1m 、 2m 的代数式表示)。
�













 2023年江西萍乡中考道德与法治真题及答案.doc
2023年江西萍乡中考道德与法治真题及答案.doc 2012年重庆南川中考生物真题及答案.doc
2012年重庆南川中考生物真题及答案.doc 2013年江西师范大学地理学综合及文艺理论基础考研真题.doc
2013年江西师范大学地理学综合及文艺理论基础考研真题.doc 2020年四川甘孜小升初语文真题及答案I卷.doc
2020年四川甘孜小升初语文真题及答案I卷.doc 2020年注册岩土工程师专业基础考试真题及答案.doc
2020年注册岩土工程师专业基础考试真题及答案.doc 2023-2024学年福建省厦门市九年级上学期数学月考试题及答案.doc
2023-2024学年福建省厦门市九年级上学期数学月考试题及答案.doc 2021-2022学年辽宁省沈阳市大东区九年级上学期语文期末试题及答案.doc
2021-2022学年辽宁省沈阳市大东区九年级上学期语文期末试题及答案.doc 2022-2023学年北京东城区初三第一学期物理期末试卷及答案.doc
2022-2023学年北京东城区初三第一学期物理期末试卷及答案.doc 2018上半年江西教师资格初中地理学科知识与教学能力真题及答案.doc
2018上半年江西教师资格初中地理学科知识与教学能力真题及答案.doc 2012年河北国家公务员申论考试真题及答案-省级.doc
2012年河北国家公务员申论考试真题及答案-省级.doc 2020-2021学年江苏省扬州市江都区邵樊片九年级上学期数学第一次质量检测试题及答案.doc
2020-2021学年江苏省扬州市江都区邵樊片九年级上学期数学第一次质量检测试题及答案.doc 2022下半年黑龙江教师资格证中学综合素质真题及答案.doc
2022下半年黑龙江教师资格证中学综合素质真题及答案.doc