2023 年辽宁普通高中学业水平选择性考试化学真题及答案
本试卷满分 100 分,考试时间 75 分钟。
可能用到的相对原子质量:H-1
B-11
C-12
N-14
O-16
Na-23
S-32
Fe-56
一、选择题:本题共 15 小题,每小题 3 分,共 45 分。在每小题给出的四个选项中,只有
一项符合题目要求。
1. 科技是第一生产力,我国科学家在诸多领域取得新突破,下列说法错误的是
A. 利用 CO2 合成了脂肪酸:实现了无机小分子向有机高分子的转变
B. 发现了月壤中的“嫦娥石[(Ca8Y)Fe(PO4)7]”:其成分属于无机盐
C. 研制了高效率钙钛矿太阳能电池,其能量转化形式:太阳能→电能
D. 革新了海水原位电解制氢工艺:其关键材料多孔聚四氟乙烯耐腐蚀
2. 下列化学用语或表述正确的是
A. BeCl2 的空间结构:V 形
B. P4 中的共价键类型:非极性键
C. 基态 Ni 原子价电子排布式:3d10
D. 顺—2—丁烯的结构简式:
3. 下列有关物质的工业制备反应错误的是
A. 合成氨:N2+3H2
催化剂
高温、高压
2NH3
B. 制 HCl:H2+Cl2
点燃
2HCl
C. 制粗硅:SiO2+2C
高温
Si+2CO
D. 冶炼镁:2MgO(熔融)
电解
2Mg+O2↑
4. 下列鉴别或检验不能达到实验目的的是
A. 用石灰水鉴别 Na2CO3 与 NaHCO3
B. 用 KSCN 溶液检验 FeSO4 是否变质
C. 用盐酸酸化的 BaCl2 溶液检验 Na2SO3 是否被氧化
D. 加热条件下用银氨溶液检验乙醇中是否混有乙醛
5. 我国古代四大发明之一黑火药的爆炸反应为:
2
3CO
2
2
。
S 2KNO 3C K S N
=
3
设 AN 为阿伏加德罗常数的值,下列说法正确的是
A.
11.2LCO 含 π 键数目为 AN
2
B. 每生成
2.8gN 转移电子数目为
2
AN
C.
0.1molKNO 晶体中含离子数目为
3
0.2N
A
D.
数目为
0.1N
A
1L0.1mol L K S
2
1
溶液中含 2S
�
6. 在光照下,螺呲喃发生开、闭环转换而变色,过程如下。下列关于开、闭环螺呲喃说法
正确的是
A. 均有手性
B. 互为同分异构体
C. N 原子杂化方式相同
7. 某无隔膜流动海水电解法制 2H 的装置如下图所示,其中高选择性催化剂 PRT 可抑制
2O 产生。下列说法正确的是
D. 闭环螺吡喃亲水性更好
A. b 端电势高于 a 端电势
C. 电解后海水 pH 下降
B. 理论上转移 2mole 生成
4gH
2
D. 阳极发生:
₂
HClO H
Cl H O 2e
8. 冠醚因分子结构形如皇冠而得名,某冠醚分子 c 可识别 K ,其合成方法如下。下列说
法错误的是
A. 该反应为取代反应
C. c 核磁共振氢谱有 3 组峰
B. a、b 均可与 NaOH 溶液反应
D. c 可增加 KI 在苯中的溶解度
9. 某种镁盐具有良好的电化学性能,其阴离子结构如下图所示。W、X、Y、Z、Q 是核电荷
数依次增大的短周期元素,W、Y 原子序数之和等于 Z,Y 原子价电子数是 Q 原子价电子数的
2 倍。下列说法错误的是
�
A. W 与 X 的化合物为极性分子
C. Q 的氧化物是两性氧化物
B. 第一电离能 Z>X>Y
D. 该阴离子中含有配位键
10. 某工厂采用如下工艺制备
Cr(OH) ,已知焙烧后 Cr 元素以 +6 价形式存在,下列说法
3
错误的是
A. “焙烧”中产生 2CO
C. 滤液①中Cr 元素的主要存在形式为
2
4CrO
B. 滤渣的主要成分为
Fe(OH)
2
D. 淀粉水解液中的葡萄糖起还原作
用
11. 某低成本储能电池原理如下图所示。下列说法正确的是
A. 放电时负极质量减小
B. 储能过程中电能转变为化学能
D. 充电总反应:
C. 放电时右侧 H 通过质子交换膜移向左侧
PbSO
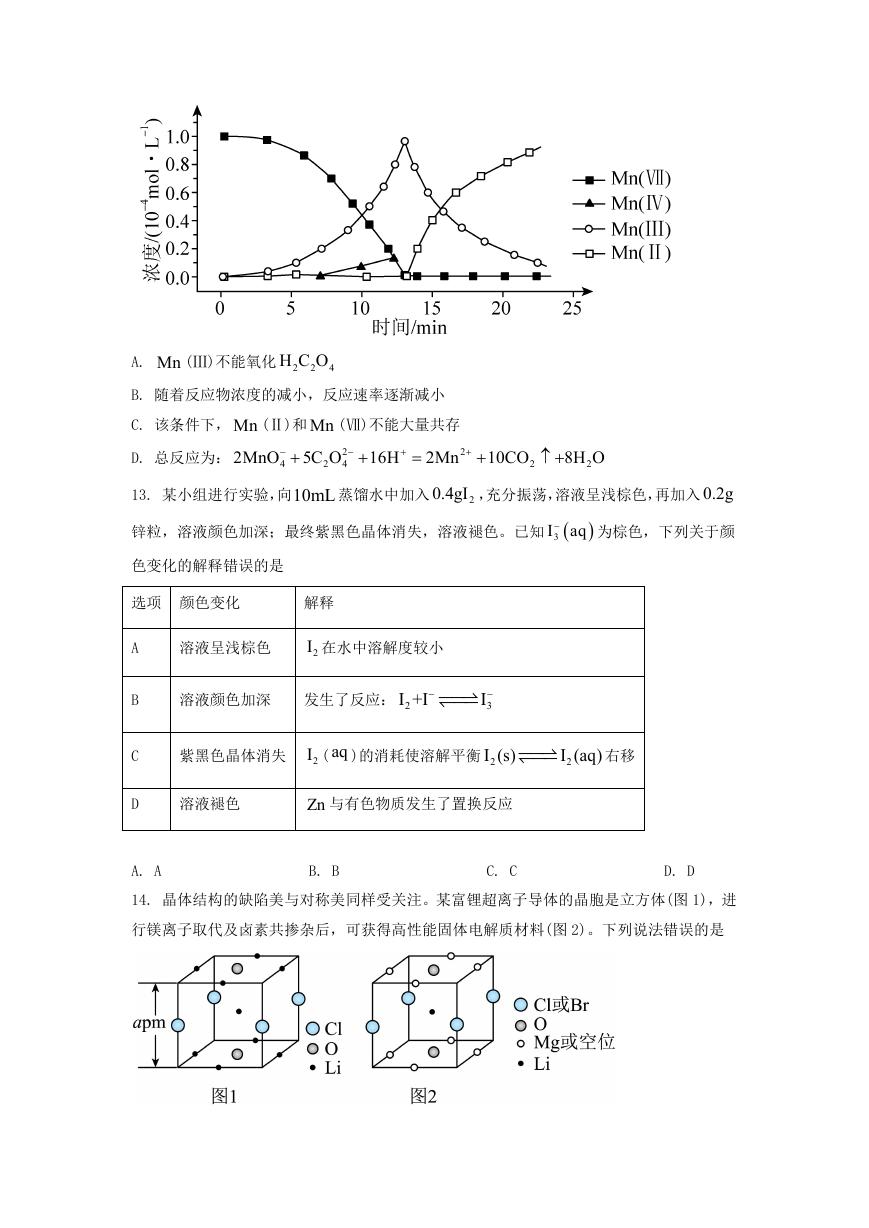
H C O 发生反应,Mn (Ⅱ)起催化作用,过程中不
KMnO 溶液与 2
12. 一定条件下,酸性
Pb SO
2Fe
2
4
2Fe
2
2
4
4
3
4
同价态含 Mn 粒子的浓度随时间变化如下图所示。下列说法正确的是
�
A. Mn (Ⅲ)不能氧化 2
H C O
2
4
B. 随着反应物浓度的减小,反应速率逐渐减小
C. 该条件下, Mn (Ⅱ)和 Mn (Ⅶ)不能大量共存
2Mn
2MnO 5C O
D. 总反应为:
16H
4
2
4
2
2
10CO
8H O
2
2
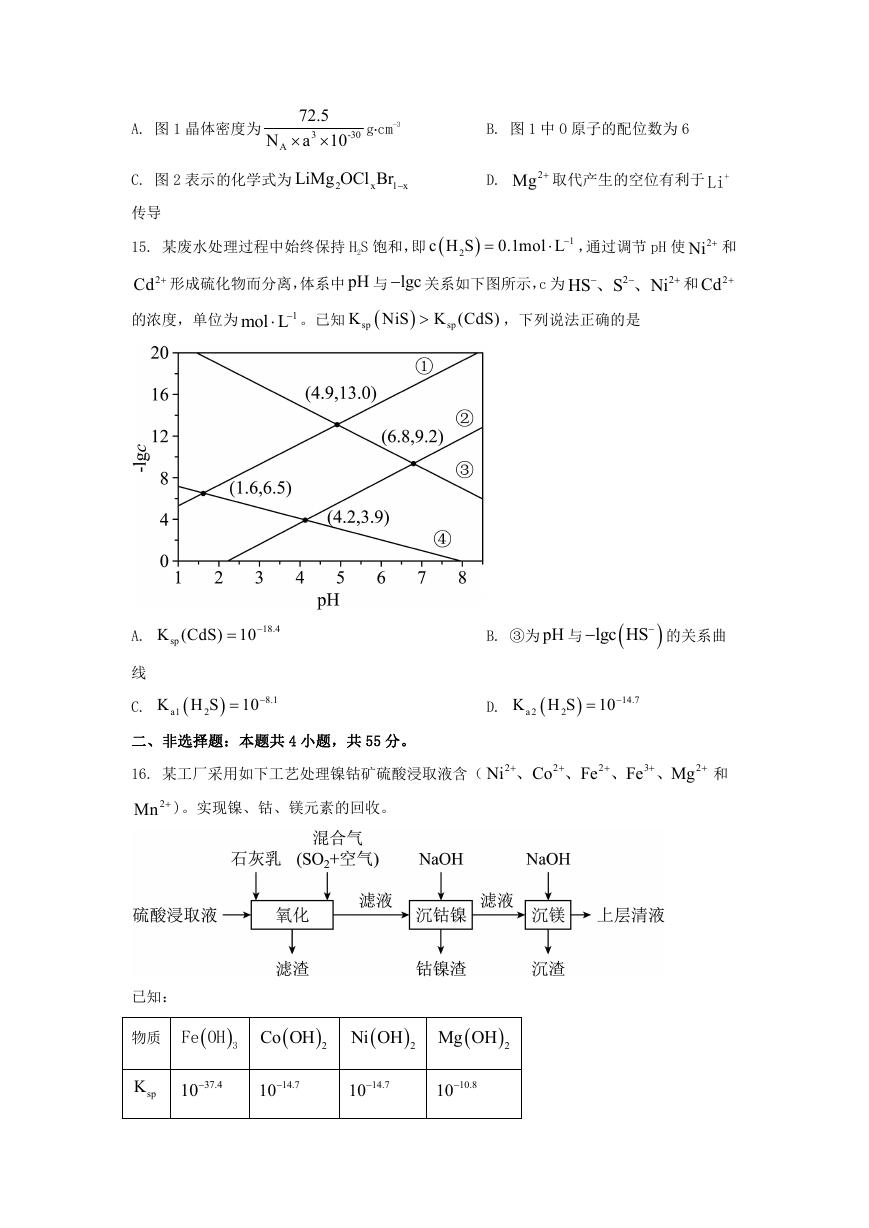
13. 某小组进行实验,向10mL 蒸馏水中加入
锌粒,溶液颜色加深;最终紫黑色晶体消失,溶液褪色。已知
3I
2
0.4gI ,充分振荡,溶液呈浅棕色,再加入 0.2g
aq
为棕色,下列关于颜
色变化的解释错误的是
选项 颜色变化
解释
A
B
C
D
溶液呈浅棕色
2I 在水中溶解度较小
溶液颜色加深
发生了反应: 2
I +I
I
3
紫黑色晶体消失 2I ( aq )的消耗使溶解平衡 2
I (s)
I (aq)
2
右移
溶液褪色
Zn 与有色物质发生了置换反应
A. A
B. B
C. C
D. D
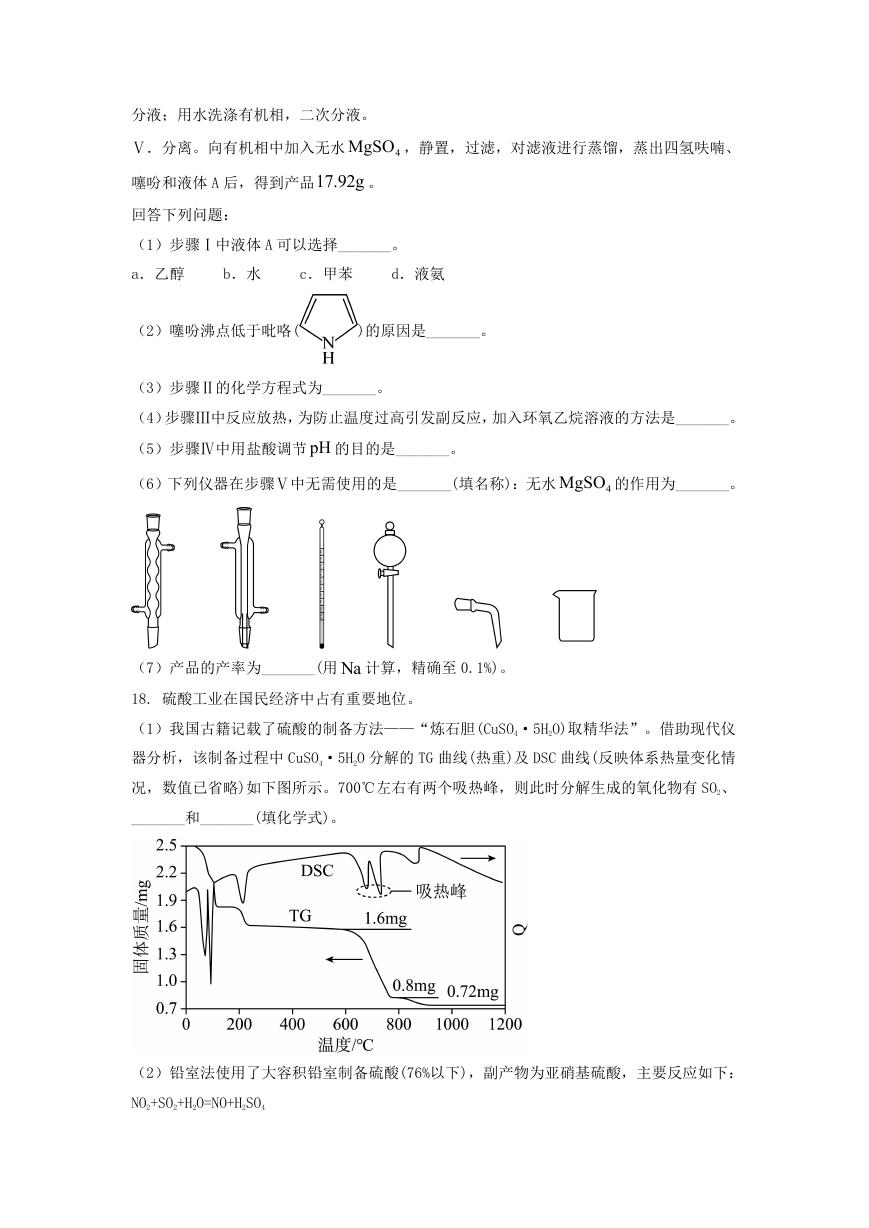
14. 晶体结构的缺陷美与对称美同样受关注。某富锂超离子导体的晶胞是立方体(图 1),进
行镁离子取代及卤素共掺杂后,可获得高性能固体电解质材料(图 2)。下列说法错误的是
�
A. 图 1 晶体密度为
72.5
N a
3
A
g∙cm-3
-30
10
B. 图 1 中 O 原子的配位数为 6
C. 图 2 表示的化学式为
LiMg OCl Br
1 x
2
x
D.
2Mg 取代产生的空位有利于 +Li
传导
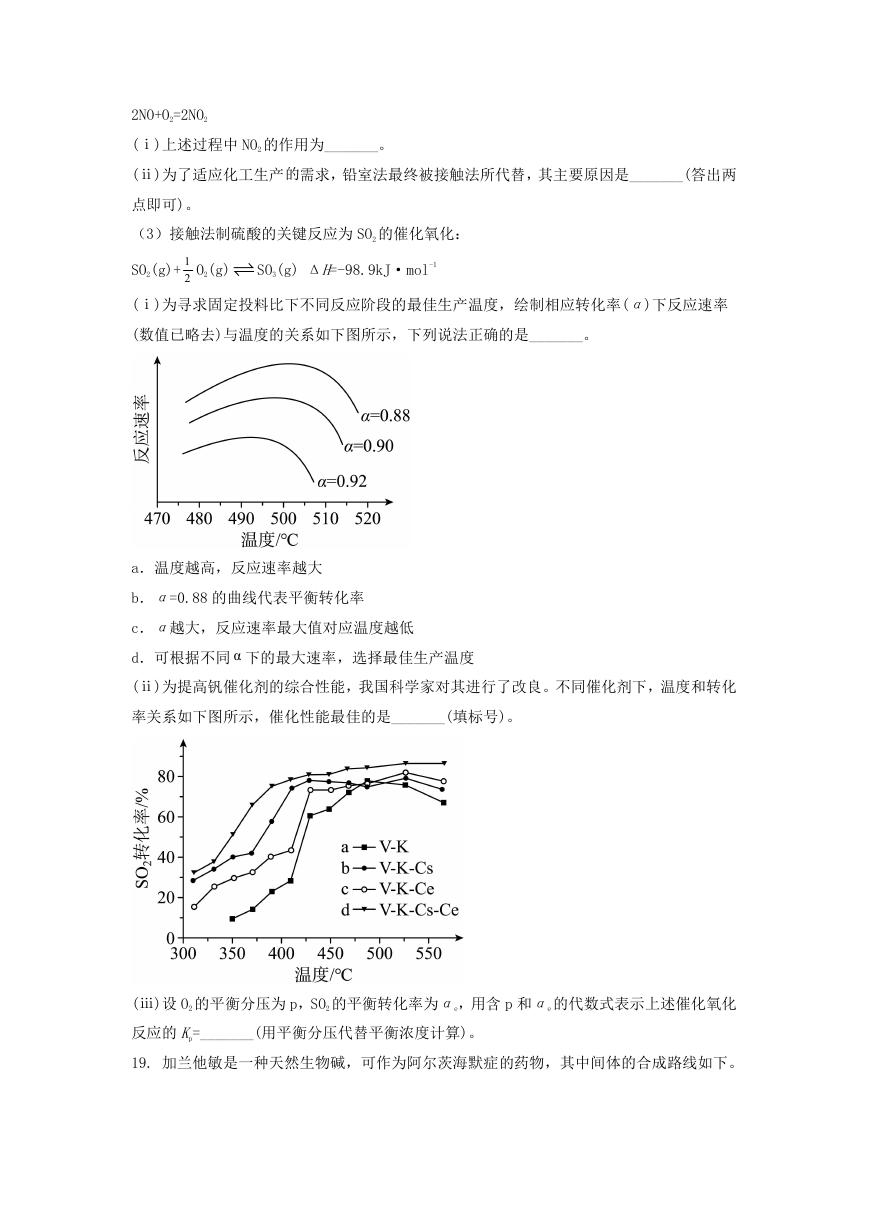
15. 某废水处理过程中始终保持 H2S 饱和,即
0.1mol L
2Cd 形成硫化物而分离,体系中 pH 与 lgc 关系如下图所示,c 为
c H S
2
HS
、 、 和 2Cd
Ni
2
S
2
1
,通过调节 pH 使 2Ni 和
的浓度,单位为
1
mol L
。已知
K NiS
sp
K (CdS)
sp
,下列说法正确的是
spK (CdS) 10
18.4
B. ③为 pH 与
lgc HS
的关系曲
K H S
2
a1
10
8.1
D.
K H S
2
a 2
10
14.7
A.
线
C.
、 、 、 、
Fe Mg
Co
Fe
3
2
2
2
和
二、非选择题:本题共 4 小题,共 55 分。
16. 某工厂采用如下工艺处理镍钴矿硫酸浸取液含( 2
Ni
2Mn )。实现镍、钴、镁元素的回收。
已知:
物质
Fe OH
3
Co OH
2
Ni OH
2
Mg OH
2
spK
37.4
10
14.7
10
14.7
10
10.8
10
�
回答下列问题:
(1)用硫酸浸取镍钴矿时,提高浸取速率的方法为_______(答出一条即可)。
(2)“氧化”中,混合气在金属离子的催化作用下产生具有强氧化性的过一硫酸
H SO ,
2
5
2
1molH SO 中过氧键的数目为_______。
(3)“氧化”中,用石灰乳调节 pH 4 , 2Mn 被 2
5
H SO 氧化为
5
2MnO ,该反应的离子
方程式为_______(
H SO 的电离第一步完全,第二步微弱);滤渣的成分为
2
5
2MnO 、
_______(填化学式)。
(4)“氧化”中保持空气通入速率不变, Mn (Ⅱ)氧化率与时间的关系如下。 2SO 体积分
数为_______时, Mn (Ⅱ)氧化速率最大;继续增大 2SO 体积分数时, Mn (Ⅱ)氧化速率减
小的原因是_______。
(5)“沉钴镍”中得到的 Co (Ⅱ)在空气中可被氧化成 CoO(OH) ,该反应的化学方程式
为_______。
(6)“沉镁”中为使 2Mg 沉淀完全
25℃ ,需控制 pH 不低于_______(精确至 0.1)。
17. 2—噻吩乙醇(
rM 128
)是抗血栓药物氯吡格雷的重要中间体,其制备方法如下:
Ⅰ.制钠砂。向烧瓶中加入300mL 液体 A 和 4.60g 金属钠,加热至钠熔化后,盖紧塞子,
振荡至大量微小钠珠出现。
Ⅱ.制噻吩钠。降温至10℃,加入 25mL 噻吩,反应至钠砂消失。
Ⅲ.制噻吩乙醇钠。降温至 10 ℃,加入稍过量的环氧乙烷的四氢呋喃溶液,反应30min 。
Ⅳ.水解。恢复室温,加入 70mL 水,搅拌30min ;加盐酸调 pH 至 4~6,继续反应 2h ,
�
分液;用水洗涤有机相,二次分液。
Ⅴ.分离。向有机相中加入无水
MgSO ,静置,过滤,对滤液进行蒸馏,蒸出四氢呋喃、
4
噻吩和液体 A 后,得到产品17.92g 。
回答下列问题:
(1)步骤Ⅰ中液体 A 可以选择_______。
a.乙醇
b.水
c.甲苯
d.液氨
(2)噻吩沸点低于吡咯(
)的原因是_______。
(3)步骤Ⅱ的化学方程式为_______。
(4)步骤Ⅲ中反应放热,为防止温度过高引发副反应,加入环氧乙烷溶液的方法是_______。
(5)步骤Ⅳ中用盐酸调节 pH 的目的是_______。
(6)下列仪器在步骤Ⅴ中无需使用的是_______(填名称):无水
MgSO 的作用为_______。
4
(7)产品的产率为_______(用 Na 计算,精确至 0.1%)。
18. 硫酸工业在国民经济中占有重要地位。
(1)我国古籍记载了硫酸的制备方法——“炼石胆(CuSO4·5H2O)取精华法”。借助现代仪
器分析,该制备过程中 CuSO4·5H2O 分解的 TG 曲线(热重)及 DSC 曲线(反映体系热量变化情
况,数值已省略)如下图所示。700℃左右有两个吸热峰,则此时分解生成的氧化物有 SO2、
_______和_______(填化学式)。
(2)铅室法使用了大容积铅室制备硫酸(76%以下),副产物为亚硝基硫酸,主要反应如下:
NO2+SO2+H2O=NO+H2SO4
�
2NO+O2=2NO2
(ⅰ)上述过程中 NO2 的作用为_______。
(ⅱ)为了适应化工生产的需求,铅室法最终被接触法所代替,其主要原因是_______(答出两
点即可)。
(3)接触法制硫酸的关键反应为 SO2 的催化氧化:
SO2(g)+
1
2
O2(g) SO3(g) ΔH=-98.9kJ·mol-1
(ⅰ)为寻求固定投料比下不同反应阶段的最佳生产温度,绘制相应转化率(α)下反应速率
(数值已略去)与温度的关系如下图所示,下列说法正确的是_______。
a.温度越高,反应速率越大
b.α=0.88 的曲线代表平衡转化率
c.α越大,反应速率最大值对应温度越低
d.可根据不同 α 下的最大速率,选择最佳生产温度
(ⅱ)为提高钒催化剂的综合性能,我国科学家对其进行了改良。不同催化剂下,温度和转化
率关系如下图所示,催化性能最佳的是_______(填标号)。
(ⅲ)设 O2 的平衡分压为 p,SO2 的平衡转化率为αe,用含 p 和αe 的代数式表示上述催化氧化
反应的 Kp=_______(用平衡分压代替平衡浓度计算)。
19. 加兰他敏是一种天然生物碱,可作为阿尔茨海默症的药物,其中间体的合成路线如下。
�












 2023年江西萍乡中考道德与法治真题及答案.doc
2023年江西萍乡中考道德与法治真题及答案.doc 2012年重庆南川中考生物真题及答案.doc
2012年重庆南川中考生物真题及答案.doc 2013年江西师范大学地理学综合及文艺理论基础考研真题.doc
2013年江西师范大学地理学综合及文艺理论基础考研真题.doc 2020年四川甘孜小升初语文真题及答案I卷.doc
2020年四川甘孜小升初语文真题及答案I卷.doc 2020年注册岩土工程师专业基础考试真题及答案.doc
2020年注册岩土工程师专业基础考试真题及答案.doc 2023-2024学年福建省厦门市九年级上学期数学月考试题及答案.doc
2023-2024学年福建省厦门市九年级上学期数学月考试题及答案.doc 2021-2022学年辽宁省沈阳市大东区九年级上学期语文期末试题及答案.doc
2021-2022学年辽宁省沈阳市大东区九年级上学期语文期末试题及答案.doc 2022-2023学年北京东城区初三第一学期物理期末试卷及答案.doc
2022-2023学年北京东城区初三第一学期物理期末试卷及答案.doc 2018上半年江西教师资格初中地理学科知识与教学能力真题及答案.doc
2018上半年江西教师资格初中地理学科知识与教学能力真题及答案.doc 2012年河北国家公务员申论考试真题及答案-省级.doc
2012年河北国家公务员申论考试真题及答案-省级.doc 2020-2021学年江苏省扬州市江都区邵樊片九年级上学期数学第一次质量检测试题及答案.doc
2020-2021学年江苏省扬州市江都区邵樊片九年级上学期数学第一次质量检测试题及答案.doc 2022下半年黑龙江教师资格证中学综合素质真题及答案.doc
2022下半年黑龙江教师资格证中学综合素质真题及答案.doc