2018 年广东暨南大学材料综合考研真题
招生专业及代码:080501 材料物理与化学、080502 材料学、080503 材料加工工程、0805Z1
生物材料、085204 材料工程(专业学位)
考试科目级代码:821 材料综合
考生请注意: 《材料综合》满分 150 分,考卷包括 A《基础化学》、B《材料科学基础》两
项内容。请根据自己的专业背景和未来拟从事的专业研究方向,只能从 A、B 两项中任选其
中一项作答,如果两项都做,仅记 A 项的成绩。
考生注意:所有答案必须写在答题纸(卷)上,写在本试题上一律不给分。
A、基础化学
一、 是非题(判断下列叙述是否正确,正确的在括号中画√,错误的画×)(共 10 小题,
每小题 1 分,共计 10 分)
( )1.氢电极的电极电位是 0.0000 V。
( )2.极性分子中的化学键是极性键,非极性分子中的化学键是非极性键。
( )3.25 ℃时,0.10 mol·L-1 的 H[Al(OH)4]溶液中 OH-浓度是 H+浓度的 4 倍。
( )4.分子间形成氢键的物质, 沸点和熔点会降低。
( )5.HAC 溶液和 NaOH 溶液混合可以配成缓冲溶液,条件是 NaOH 比 HAC 的物质的量适
度过量。
( )6.吸光度表示物质对光吸收的程度,物质浓度越大,吸光度一定越大。
( )7.当溶液中无其它干扰离子存在时,应选择波长为λmax 的光作入射光进行分光光度
法测定。
( )8.在配合滴定中,金属离子与滴定剂 EDTA 一般是以 1:1 配合。
( )9.当溶液中 H+浓度与 OH-浓度相等时,酸碱指示剂显示其中间色。
( )10.Na2CO3 溶液中 H2CO3 的浓度近似等于 Kb2 。
二、 填空题(共 7 小题,每空 1 分,共 20 分)
1.关于 Raoult 定律所讨论的依数性适用于______、______的______溶液。
�
2.反应 (a) C(s) + H2O(g) CO(g) + H2(g) 及反应 (b) 3H2(g) + N2(g) 2NH3(g)
在密闭容器中进行,且呈平衡状态,当温度不变时,在上述反应中加入氮气以增加
总压力,对反应(a)平衡将______移动,对反应(b)平衡将______移动。(填正向,逆
向或不)
3. K3 [Fe(CN)6]的中心离子是______,配位数是______,配位原子是______,配体是
______,配合物的命名是______。
4.已知下列反应均按正方向进行,在以下这些物质中,最强的氧化剂是______,最强
的还原剂是______。
2FeCl3 + SnCl2 = 2FeCl2 + SnCl4
2KMnO4 + 10FeSO4 + 8H2SO4 = 2MnSO4 + 5Fe2(SO4)3 + K2SO4 + 8H2O
5.有下列几种物质:I、NH3·H2O、CN 和 S2-;
(1) 当______存在时,Ag+ 的氧化能力最强;
(2) 当______存在时,Ag 的还原能力最强。
(Ksp(AgI) = 8.51 10-17,Ksp(Ag2S) = 6.69 10-50,K稳(Ag(NH3)
2 ) = 1.1 107,
K稳(Ag(CN)
2 ) = 1.3 1021 )
6.在分光光度分析中,当空白溶液置入光路时,应使 T = ______, A = ______。
7. NaHCO3 和 Na2CO3 组成的缓冲溶液,抗酸成分是______,抗碱成分是______,该缓冲
系的有效缓冲范围是______至______。(已知:H2CO3 的 pKa1=6.35,pKa2=10.33)
三、 单项选择题(选择正确答案的序号填入括号内)(共 20 小题,每小题 2 分,共 40 分)
( )1. 下列具有相同配位数的一组配合物是:
A. [Co(en)3]Cl3
[Co(en)2(NO2)2]
B. [Cu(H2O)2Cl2]
[Ni(en)2(NO2)2]
C. [Pt(NH3)2Cl2]
[Pt(en)2Cl2]2+
D. 都不相同
( )2. 已知 313 K 时,水的 KW=3.8×10-14,此时 c(H+)=1.0×10-7 mol·L-1 的溶液是:
A. 酸性
C. 碱性
B. 中性
D. 缓冲溶液
( )3.某一有色溶液,测得其透光率为 T。若将该溶液浓缩至其原来浓度的 2 倍,则在
�
同样条件下,测得的透光率为:
A. 2T
C. T2
B. T/2
D. T1/2
( )4. 环境对系统作 10 kJ 的功,且系统又从环境获得 5 kJ 的热量,系统内能变化是:
A. +5 kJ
C. -15 kJ
B. +15 kJ
D. -5 kJ
( )5. 下列配合物中属于弱电解质的是:
A. [Ag(NH3)2]Cl
C. [Co(en)3]Cl2
B. K3[FeF6]
D. [PtCl2(NH3)2]
( )6. 二级反应速率常数的量纲是:
A. s-1
B. mol·dm-3
C. mol·dm-3·s-1
D. mol-1·dm3·s-1
( )7. 下列分子中属于极性分子的是:
A. CCl4
C. BCl3
B. CH3OCH3
D. PCl5
( )8.下列说法中,正确的是:
A. 主量子数为 1 时,有自旋相反的两个轨道。
B. 主量子数为 3 时,3s、3p、3d 共三个轨道。
C. 在除氢以外的原子中,2 p 能级总是比 2s 能级高。
D. 电子云是电子出现的概率随 r变化的图像。
( )9. 以下哪种物质的熵值最高?
A. 金刚石
C. I2(g)
B. Cl2(l)
D. Cu(s)
( )10. 在一个标准大气压,298 K 时,反应 O3 + NO
O2 + NO2的活化能为 10.7 kJ·mol-1,
△H为-193.8 kJ·mol-1,则其逆反应的活化能为(单位:kJ·mol-1) :
A. 204.5
C. 183.1
B. -204.5
D. -183.1
�
( )11. 改变速率常数 k的因素是:
A. 减少生成物浓度
B. 增加体系总压力
C. 增加反应物浓度
D. 升温和加入催化剂
( )12. 下列反应中,
mr S 值最大的是:
A. C(s) + O2(g) CO2(g)
B. 2SO2(g) + O2(g) 2SO3(g)
C. CaSO4(s) + 2H2O(l) CaSO4·2H2O(s)
D. 3H2(g) + N2(g) 2NH3(g)
( )13.在 0.1 mol·L-1 NaF 溶液中:
A. c(H+) ≈ c(HF)
B. c(HF) ≈ c(OH-)
C. c(H+) ≈ c(OH-)
D. c(H+) ≈ c(HF)
( )14. 在铜锌原电池的铜半电池中加入氨水,则其电动势:
A. 上升
C. 不变
B. 下降
D. 取决于具体浓度
( )15. 下列各组原子轨道中不能叠加成键的是:
A. px–px
C. s–px
B. px–py
D. s–pz
( )16. 下列反应均在恒压下进行,若压缩容器体积,增加其总压力,平衡正向移动的是:
A. CaCO3(s)
CaO(s) + CO2(g)
B. H2(g) + Cl2(g)
C. 2NO(g) + O2(g)
2HCl(g)
2NO2(g)
D. COCl2(g)
CO(g) + Cl2(g)
( )17. 以下计算式答案 x 应为:
11.05+1.3153+1.225+25.0678 = x
A. 38.6581
D. 38.66
B. 38.64
C. 38.67
( )18. 与难挥发性非电解质稀溶液的蒸汽压降低、沸点升高、凝固点降低有关的因素为:
�
A. 溶液的体积
C. 溶质的本性
B. 溶液的温度
D. 单位体积溶液中溶质质点数
( )19. 对某 NaOH 溶液标定了四次,平均值为 0.1258 mol·L-1, 其中三次的偏差为 0.0004
mol·L-1, -0.0006 mol·L-1 , 0.0003 mol·L-1 。另一次的结果应为:
A. 0.1259 mol·L-1
B. 0.1258 mol·L-1
C. 0.1257 mol·L-1
D. 0.1256 mol·L-1
( )20. 将 0.900 g 某物质溶于 60.0 g 水中, 使溶液的凝固点降低了 0.150 ℃, 该物质
的相对分子质量是 (水的 Kf = 1.86 K·kg·mol-1) :
A. 204
C. 83.2
B. 186
D. 51.2
四.简答题(共 4 小题,每小题 10 分,共 40 分)
1. BF3 是平面三角形的几何构型,但 NF3 却是三角锥形的几何构型,试用杂化轨道理论加以
说明。
2. 用下列物质标定 NaOH 溶液浓度所得的浓度偏高、偏低还是准确?为什么?
(1)部分风化的 H2C2O4·H2O;
(2)含有少量不溶性杂质(中性)的邻苯二甲酸氢钾。
3.硒与健康关系密切,硒在体内的活性形式为含硒酶和含硒蛋白。缺硒会引起克山病、大
骨节病、白内障等。(1) 写出 34 号元素硒的核外电子排布式;(2) 写出硒在周期表中的位
置;(3) 根据硒在周期表中的位置,推测硒的最高价氧化物。
4. 以下是 3 个需要酶催化的反应,若原始混合物中含有 A、酶 1 和酶 3,在不太长的时间内,
体系中是否会有 D 存在?请解释理由。
(1) A 酶1 B
mrG
1 = 12.5 kJ·mol-1
(2) B 酶2 C
mrG
2 = -25 kJ·mol-1
(3) C 酶3 D
mrG
3 = -37.3 kJ·mol-1
�
五.计算题(共 4 小题,每小题 10 分,共 40 分)
1. 已知 Eθ(Cu2+/Cu)=0.340 V,Eθ(Ag+/Ag)=0.799 V,将铜片插入 0.10 mol·L-1 CuSO4 溶
液中,银片插入 0.10 mol·L-1 AgNO3 溶液中组成原电池。
(1) 计算原电池的电动势。
(2) 写出电极反应、电池反应和原电池符号。
(3) 计算电池反应的平衡常数。
2. 某试样中含 Na2CO3、NaHCO3 和不与酸反应的杂质,称取该样品 0.6839 g 溶于水,用
0.2000 mol·L-1 的 HCl 溶液滴定至酚酞的红色褪去,用去 HCl 溶液 23.10 mL。 加入
甲 基橙指示剂后,继续用 HCl 标准溶液滴定至由黄色变为橙色,又用去 26.81 mL HCl 溶
液。计算样品中两种主要成份的质量分数。
3.
3. 假设溶于水中的 Mn(OH)2完全解离,试计算(已知:Ksp(Mn(OH)2) = 2.06×10-13):
(1) Mn(OH)2在水中的溶解度(mol·L-1);
(2) Mn(OH) 2饱和溶液中的[Mn2+]和[OH-];
(3) Mn(OH) 2在 0.10 mol·L-1 NaOH 溶液中的 溶解度(假设 Mn(OH) 2在 NaOH 溶液中不
发生其
它变化);
(4) Mn(OH) 2在 0.20 mol·L-1MnCl2 溶液中的溶解度。
4. 已知下列反应在 298.15 K,标准状态下:
(1) Fe2O3(s) + 3CO(g) → 2Fe(s) + 3CO2(g); ΔrH
= -24.8 kJ·mol-1,ΔrG 1m
1m
= -
29.4 kJ·mol-1
(2) 3Fe2O3(s) + CO(g) → 2Fe3O4(s) + CO2(g);ΔrH 2m
= -47.2 kJ·mol-1,ΔrG 2m
= -61.41
kJ·mol-1
(3) Fe3O4(s) + CO(g) → 3FeO(s) + CO2(g);ΔrH 3m
= 19.4 kJ·mol-1, ΔrG 3m
= 5.21
kJ·mol-1
试求(4) FeO(s) + CO(g) → Fe(s) + CO2(g)的Δr H 4m
、Δ rG 4m
和ΔrS 4m
。
�
B、材料科学基础
一、名词解释题(共 10 小题,每小题 3 分,共 30 分)
1、金属键; 2、空间点阵; 3、间隙固溶体; 4、肖特基空位; 5、交滑移;
6、动态再结晶; 7、过冷度; 8、共晶反应; 9、珠光体; 10、马氏体
二、选择题(可多选,共 15 小题,每小题 3 分,共 45 分)
1. 在 MgO 离子化合物中,最可能取代化合物中 Mg2+的正离子(已知各正离子半径(nm)分别
是:(Mg2+) 0.066、(Ca2+) 0.099、 (Li+) 0.066、(Fe2+)0.074)是
。
(A) Ca2+
(B)Li+
(C)Fe2+
2. 简单立方晶体中原子的配位数为
。
(A) 12 个
(B) 6 个
(C) 8 个
3. 按等径球体密堆积理论,最紧密的堆积形式是
。
(A) BCC
(B) FCC
(C) HCP
4. 在晶体中形成空位的同时又产生间隙原子,这样的缺陷称为
。
(A) 肖特基空位
(B) 弗兰克尔空位
(C) 线缺陷
5. 两根同号的螺位错(柏氏矢量分别为 b1,b2),互相
。
(A) 吸引
(B) 排斥
(C) 无相互作用
6. 下列不可能是面心立方晶体的孪生面的是:
。
(A) (112)
(B) (110)
(C) (111)
7. 在菲克第一定律中,描述的稳态扩散是指质量浓度不随
而变化。
(A) 时间
(B) 距离
(C) 温度
8. 原子扩散的驱动力是
。
(A) 组元的浓度梯度
(B) 组元的化学势梯度
(C) 温度梯度
9. 柯肯达尔效应形成的原因是
。
(A) 锌和铜的扩散速率不同
(B) 钼丝在锌和铜中的扩散系数不同
�
(C) 锌和铜的扩散机制不同
10. 形成临界晶核时体积自由能的减少只能补偿表面能的
。
(A)1/3
(B)2/3
(C)3/4
11. 在固溶体液态凝固模型中,有效分配系数 Ke 表示了液相的混合程度,其取值范围是
(K0 是平衡分配系数)。
(A) 1







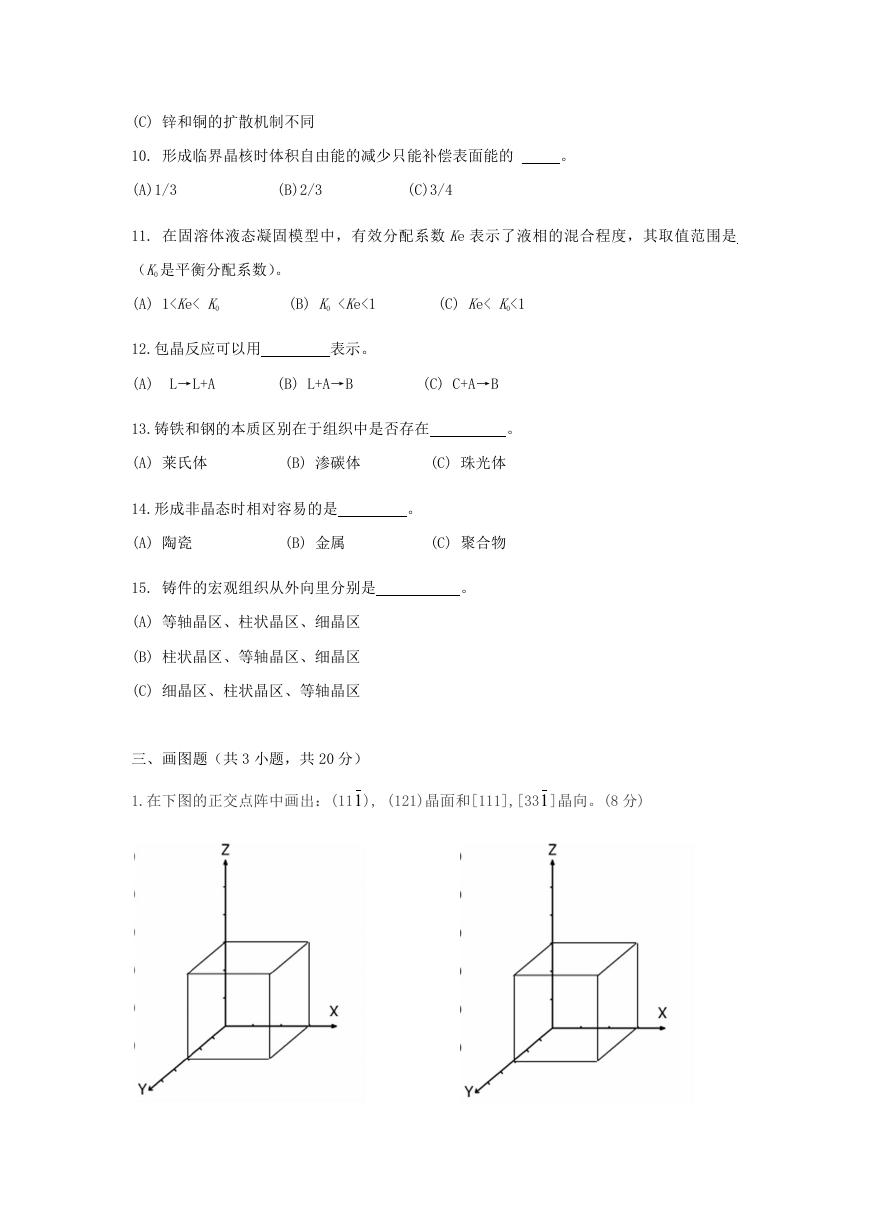








 2023年江西萍乡中考道德与法治真题及答案.doc
2023年江西萍乡中考道德与法治真题及答案.doc 2012年重庆南川中考生物真题及答案.doc
2012年重庆南川中考生物真题及答案.doc 2013年江西师范大学地理学综合及文艺理论基础考研真题.doc
2013年江西师范大学地理学综合及文艺理论基础考研真题.doc 2020年四川甘孜小升初语文真题及答案I卷.doc
2020年四川甘孜小升初语文真题及答案I卷.doc 2020年注册岩土工程师专业基础考试真题及答案.doc
2020年注册岩土工程师专业基础考试真题及答案.doc 2023-2024学年福建省厦门市九年级上学期数学月考试题及答案.doc
2023-2024学年福建省厦门市九年级上学期数学月考试题及答案.doc 2021-2022学年辽宁省沈阳市大东区九年级上学期语文期末试题及答案.doc
2021-2022学年辽宁省沈阳市大东区九年级上学期语文期末试题及答案.doc 2022-2023学年北京东城区初三第一学期物理期末试卷及答案.doc
2022-2023学年北京东城区初三第一学期物理期末试卷及答案.doc 2018上半年江西教师资格初中地理学科知识与教学能力真题及答案.doc
2018上半年江西教师资格初中地理学科知识与教学能力真题及答案.doc 2012年河北国家公务员申论考试真题及答案-省级.doc
2012年河北国家公务员申论考试真题及答案-省级.doc 2020-2021学年江苏省扬州市江都区邵樊片九年级上学期数学第一次质量检测试题及答案.doc
2020-2021学年江苏省扬州市江都区邵樊片九年级上学期数学第一次质量检测试题及答案.doc 2022下半年黑龙江教师资格证中学综合素质真题及答案.doc
2022下半年黑龙江教师资格证中学综合素质真题及答案.doc