2010 江苏省扬州市中考化学真题及答案
相对原子质量:H:1
C:12
N:14
O:16
Na:23
S:32
K:39
Fe:56
说明:
1.本试卷共 6 页,包含选择题(第 1 题一第 20 题,共 20 题)、非选择题(第 21 题一第
27 题,共 7 题)两部分。本卷满分 100 分,考试时间为 100 分钟。考试结束后,请将本试
卷和答题卡一并交回。
2.答题前,考生务必将本人的姓名、准考证号填写在答题卡相应的位置上,同时务必在试
卷的装订线内将本人的姓名、准考证号、毕业学校填写好,在试卷第一面的右下角填写好
座位号。
3.所有的试题都必须在专用的“答题卡”上作答,选择题用 2B 铅笔作答、非选择题在指定
置用 0. 5 毫米黑色水笔作答。在试卷或草稿纸上答题无效。
一、单项选择题(本题包括 15 小题,每小题 2 分,共 30 分。每小题只有一个选项符合题
意。)1.今年世界环境日的主题是“多个物种,一颗星球,一个未来”,下述不符合此主
题的是
A.提倡“低碳生活”
B.开发绿色能源
C.使用难降解的塑料制品
D.分类回收垃圾
2.鸡蛋壳中 Ca3 (PO4)2、Mg3 (PO4)2 约占 2.8%,这两种物质都属于
A.金属单质
B.酸
C.氧化物
D.化合物
3.汽车轮胎的主要材料是
A.无机非金属材料
C.复合材料
4.下列属于物理变化的是
B.非金属材料
D.合成塑料
A.干冰升华
B.铝箔发暗
C.烧碱变质
D.镁带变黑
5.温室气体是指 CO2、CH4 等痕量气体和氟碳化合物等微量气体。 氟元素符号为
A.Fe
B.F
C. V
D. Fr
6.水资源是战略资源。下列是节水标识的是
7.扬州推广“LED”绿色节能光源。砷化镓(GaAs)是光源材料,Ga 为+3 价,As 的化合价为
A.﹣3
B.﹣5
C.+3
D.+5
�
8. 某发电厂烟气处理的新工艺:CH4 十 2NO2= N2+X+2H2O,则 X 的化学式为
A. CO
B.CO2
C. O2
D. C
9.关于铁丝在氧气中燃烧、铁丝生锈的说法正确的是
A.铁丝燃烧产生白烟
B. 铁丝生锈是缓慢氧化
C.铁丝燃烧的产物是 Fe2O3
D.铁锈的主要成分是 Fe3O4
10.测得某强力除油污试剂的 pH=14,关于它的说法正确的是
A. 显碱性
B.显酸性
C.一定能与盐酸反应产生气体
D.露置空气中一段时间后 pH 将变大
11.下列操作正确的是
12.下列说法正确的是
A.煤、石油、乙醇是三种重要的化石燃料
B.洗洁精能除去餐具的油污是“乳化作用”
C.淀粉、抽脂、蛋白质中均含有 C、H、O、N 等元素
D.“白色污染”是指白色建筑材料垃圾引起的污染
13.下列图示的各物质(或元素)相对含量错误的是
14.肉毒碱(C7 H15 NO3)被认为是“最佳减肥营养素”,关于它的说法正确的是
A.相对分子质量为 161g
B.氢元素质量分数小于氮元素质量分数
C.含有臭氧(O3)
D.分子中 C、H、O、N 质量比为 84:15:48:14
�
15.如图所示的微观化学变化的反应类型是
A.置换反应
B.化合反应
C.分解反应
D.复分解反应
二、不定项选择题(本题包括 5 小题,每小题 2 分,共 10 分。每小题有一个或两个选项符
合题意。若正确答案只包括一个选项,多选时,该小题为 0 分;若正确答案包括两个选项,
只选一个且正确的为 1 分,选两个且都正确的给满分,但只要选错一个该小题就为 0 分。)
16.除去 CO 中少量的 CO2,选用的试剂和装置均正确的是
17.下列各组物质间通过一步反应就能实现如图转化,则甲、乙、丙可能是
A. NaOH
NaCl NaNO3
B.CO2
C6H12O6
H2O
C. CaO
Ca(OH)2
CaCO3
D.H2O2
H2O
O2
18.甲、乙的溶解度曲线如图,将 t2℃甲、乙的饱和溶液分别降
温到 t1℃。下列说法一定正确的是
A.两溶液仍饱和
B.甲溶液仍饱和
C.溶质质量分数:甲>乙
D.溶液质量:甲 = 乙
19.为探究 Zn 和 Cu 的金属活动性强弱,提供的试剂有:Zn、Cu、
H2SO4 溶液、ZnSO4 溶液、CuSO4 溶液。下列说法正确的是
A.选用两种试剂可实现实验目的
B. ZnSO4 溶液中加人 Cu 不能探究金属活动性强弱
C.最多只能设计一种实验方案
D.根据 Zn 和 Cu 的硬度能判断金属活动性强弱
20.某钢样品的含碳量为 0.24%(其他杂质元素不考虑),若碳元素主要以 Fe2C 和 Fe3C
的形式存在,则该钢样品中 Fe2C 和 Fe3C 的质量分数(ω)范围是
(相对分子质量:Fe2C:124,Fe3C:180)
A.0.03%<ω<2%
B. 0.48%<ω<0.72%
C. 2.24%<ω<3.36%
D. 2.48%<ω<3.6%
�
三、(本题包括 4 小题,每空 1)
21.(6 分)化学知识与生活联系密切。请用下列物质的数字序号填空。
①醋酸(CH3COOH) ②纯碱 ③尿素[CO(NH2)2] ④活性炭 ⑤食盐 ⑥维生素 C
(1)家庭制作馒头添加的“碱”_______
(2)除去铝壶中的水垢 _______
(3)腌制鱼肉等常用的调味品 _______
(4)除去冰箱异味 _______
(5)常吃蔬菜水果可补充的物质 _______
(6)含氮量最高的常用氮肥 _______
22.(6 分)人类对原子结构的认识永无止境。
(1)道尔顿认为原子是“不可再分的实心球体”,汤姆生
认为原子是“嵌着葡萄干的面包”,如今这些观点均
_____(填“正确”或“错误”),卢瑟福进行α粒子
散射实验后,认为原子是“行星模型”,即原子是由
带
_____ 电荷的原子核和核外电子构成。
道尔顿汤姆生卢瑟福
(2)右下图是元素周期表的一部分(数字表示相应元素的原子序数)。表中部分元素的原子
(离子)结构示意图如下,其中属于阳离子的是_____(填数字序号)。
选用表中元素填空 A2B2 型化合物的化学式是_________,带一个单位负电荷的一种阴离子
_______。某耐火材料是由 Mg, O 组成的化合物,写出其化学式_________。
23.(5 分)如图为速力菲补血剂的说明书。
(1)蔗糖(C12H22O6)在酶的催化作用下与水作用
只生成葡萄糖(C6H12O6 ),则 1 分子蔗糖完全与
水作用可得_____分子葡萄糖。若向速力菲的溶
液中滴加碘水,将呈现_____色。
(2)琥珀酸亚铁的相对分子质量为_____,成人
每日 1 片速力菲,每日的补铁量为_____g。
(3)丁二酸钠(Na2C4 H4O4)与硫酸亚铁发生复分
解反应可制得琥珀酸亚铁,则反应方程式为
�
__________。
24.(8 分)烟花爆竹的主要成分是黑火药,其化学组成为硝酸钾、硫磺和木炭等。
(1)黑火药中至少有_______种元素,欲分离出硝酸钾,可进行______、过滤、蒸发结晶等
操作。
(2)黑火药的一般配方是:硫磺 2 g、硝酸钾 3 g、炭粉 4. 5 g。已知黑火药在空气中燃爆
时可
发生:S + 2KNO3 + 3C = K2S + 3CO2↑+ N2↑,则 S、KNO3、C 完全反应时的质量比为
_______,该配方中 C 和_____(填化学式)明显过量。燃放烟花爆竹产生 SO2 的反应方
程式是_________。
(3)SO2 气体在空气中经粉尘催化氧化为 SO3 , SO3 与水反应,形成硫酸型酸雨,写出有关
反应的化学方程式:____________,_____________。
(4)很多城市出台“禁放”规定杜绝此类污染,以下解决“现代文明”与“传统文化”冲突
的做法可行的是_______。(填字母)A.提倡电子鞭炮 B.开发绿色鞭炮 C.关停鞭炮企业
四、(本题包括 1 小题,共 10 分)
25. (10 }) 能源“非石油化”是战略目标,发展以 CH4 、CO2 等为原料的“C1 化学”成为当
今化工生产的必然趋势。通常天然气中含有 H2S 等有毒气体,下图为天然气合成氨的工艺流
程。
(1)甲烷----氧气燃料电池是将______能转化为______能的装置。CH4 在空气中燃烧时,将
干冷的小烧杯罩在火焰上方,可观察到烧杯内壁有______。
(2 )CH4 可合成多种无机物和有机物。研究 CH4 和 CO2 反应生成 CO 和 H2,重大意义在
于______;我国科研人员首先发现 CH4 可直接分解获得 C6H6 和 H2,化学方程式为
___________。
(3)①中 CH4 与 H2O(气)反应生成 CO2、H2,化学方程式是______。②中一般加人 K2CO3
溶液吸收 CO2,此反应表示为 K2CO3+CO2+H2O = 2_________,N2 与 H2 按照分子
�
数 1:____反应生成 NH3。
(4)使用 Fe2O3·H2O 除去 H2S,生成物中含硫元素的物质有______种。流程中参与循环
的物质是_______(填化学式)。
五、(本题包括 2 小题,共 25 分)
26.(10 分)某研究性学习小组探究 CuSO4 溶液与 NaOH 溶液的反应产物。
(1)两溶液混合生成蓝色沉淀的化学方程式是_______。沉淀放置一段时间后,完全变为
黑
色沉淀,猜想是 CuO。为验证猜想,将沉淀过滤、洗涤、烘干后,用 CO 还原得到红色物
质,且生成的气体能使________,写出 CO 与 CuO 反应的化学方
程式________。
(2)CuSO4溶液与 NaOH 溶液反应有时也会生成浅绿色沉淀 [化学
式为 CuSO4·3Cu(OH)2]和 Na2SO4,则反应方程式为________。
(3)为探究新制 Cu(OH),的分解温度,设计水浴加热装置(如
图)。
写出仪器的名称:①_______②_______。该装置采用水浴加热,
其目的是_______。
(4)18℃时,将溶质质量分数均为 10%的 CuSO4 溶液与 NaOH 溶
液
混合后,测得混合液温度为 22℃,说明该反应_____(填“放热”
或“吸热”)。当水浴温度分别为 30℃、60℃、90℃时,黑色沉淀出现的时间为:2 分钟、
6 秒、1 秒,则说明温度越高,Cu(OH)2 分解速率越_____(填“快”或“慢”)。该实验
说明,Cu(OH)2 分解温度________(填“无确定数值”或 “有确定数值”)。
27. (15 分)叠氮化钠(NaN3)被广泛应用于汽车安全气囊,某兴趣小组对其进行下列研究.
【应用研究】
(1)汽车经撞击后,30 毫秒内引发 NaN3,迅速分解为 Na、N2,反应方程式为_______。
【制备研究】
(2)将金属钠与液态氨反应得 NaNH2,再将 NaNH2 与 N2O 反应可生成 NaN3、NaOH 和
气体 X,该反应的化学方程式为 2NaNH3+N2O = NaN3+NaOH+X,实验室检验 X
气体使用的试纸是湿润________。
�
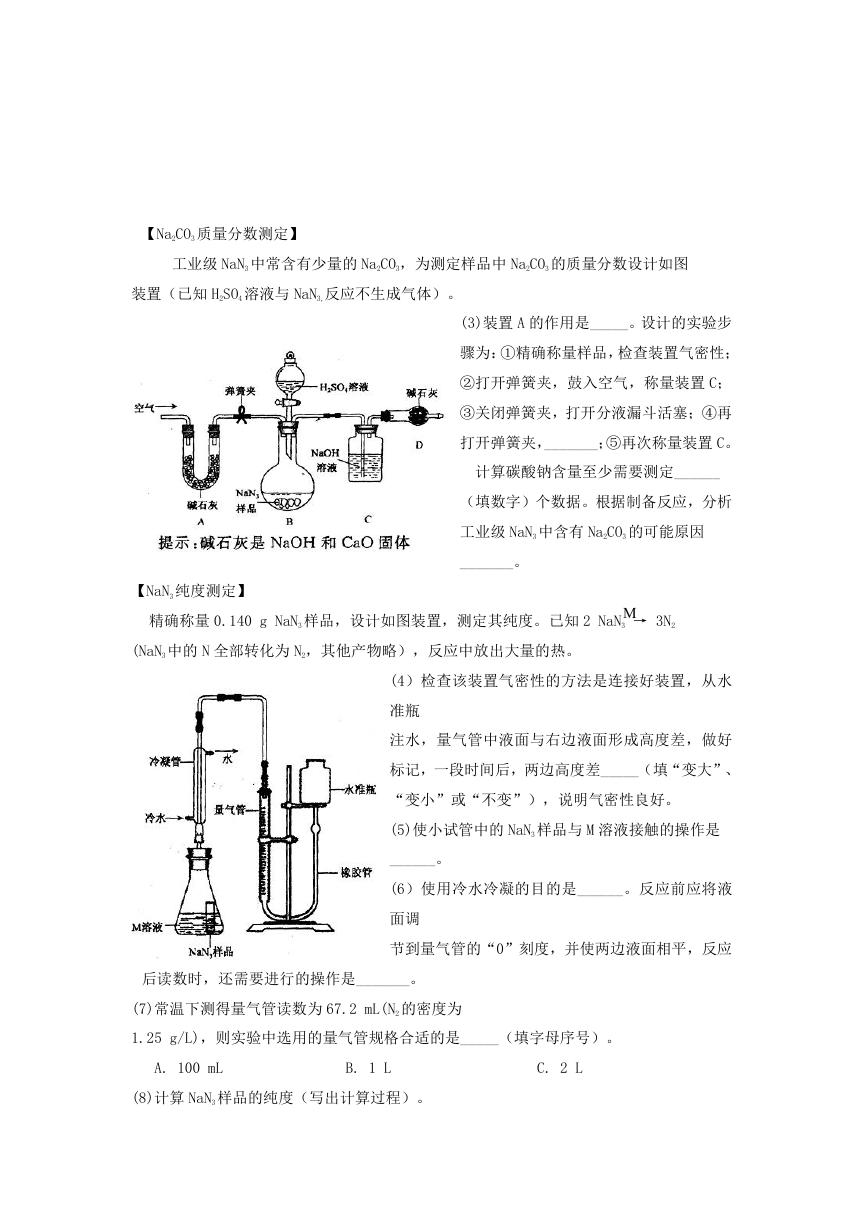
【Na2CO3 质量分数测定】
工业级 NaN3 中常含有少量的 Na2CO3,为测定样品中 Na2CO3 的质量分数设计如图
装置(已知 H2SO4 溶液与 NaN3,反应不生成气体)。
(3)装置 A 的作用是_____。设计的实验步
骤为:①精确称量样品,检查装置气密性;
②打开弹簧夹,鼓入空气,称量装置 C;
③关闭弹簧夹,打开分液漏斗活塞;④再
打开弹簧夹,_______;⑤再次称量装置 C。
计算碳酸钠含量至少需要测定______
(填数字)个数据。根据制备反应,分析
工业级 NaN3 中含有 Na2CO3 的可能原因
_______。
【NaN3 纯度测定】
精确称量 0.140 g NaN3 样品,设计如图装置,测定其纯度。已知 2 NaN3 → 3N2
M
(NaN3 中的 N 全部转化为 N2,其他产物略),反应中放出大量的热。
(4)检查该装置气密性的方法是连接好装置,从水
准瓶
注水,量气管中液面与右边液面形成高度差,做好
标记,一段时间后,两边高度差_____(填“变大”、
“变小”或“不变”),说明气密性良好。
(5)使小试管中的 NaN3 样品与 M 溶液接触的操作是
______。
(6)使用冷水冷凝的目的是______。反应前应将液
面调
节到量气管的“0”刻度,并使两边液面相平,反应
后读数时,还需要进行的操作是_______。
(7)常温下测得量气管读数为 67.2 mL(N2 的密度为
1.25 g/L),则实验中选用的量气管规格合适的是_____(填字母序号)。
A. 100 mL
B. 1 L
C. 2 L
(8)计算 NaN3 样品的纯度(写出计算过程)。
�
�














 2023年江西萍乡中考道德与法治真题及答案.doc
2023年江西萍乡中考道德与法治真题及答案.doc 2012年重庆南川中考生物真题及答案.doc
2012年重庆南川中考生物真题及答案.doc 2013年江西师范大学地理学综合及文艺理论基础考研真题.doc
2013年江西师范大学地理学综合及文艺理论基础考研真题.doc 2020年四川甘孜小升初语文真题及答案I卷.doc
2020年四川甘孜小升初语文真题及答案I卷.doc 2020年注册岩土工程师专业基础考试真题及答案.doc
2020年注册岩土工程师专业基础考试真题及答案.doc 2023-2024学年福建省厦门市九年级上学期数学月考试题及答案.doc
2023-2024学年福建省厦门市九年级上学期数学月考试题及答案.doc 2021-2022学年辽宁省沈阳市大东区九年级上学期语文期末试题及答案.doc
2021-2022学年辽宁省沈阳市大东区九年级上学期语文期末试题及答案.doc 2022-2023学年北京东城区初三第一学期物理期末试卷及答案.doc
2022-2023学年北京东城区初三第一学期物理期末试卷及答案.doc 2018上半年江西教师资格初中地理学科知识与教学能力真题及答案.doc
2018上半年江西教师资格初中地理学科知识与教学能力真题及答案.doc 2012年河北国家公务员申论考试真题及答案-省级.doc
2012年河北国家公务员申论考试真题及答案-省级.doc 2020-2021学年江苏省扬州市江都区邵樊片九年级上学期数学第一次质量检测试题及答案.doc
2020-2021学年江苏省扬州市江都区邵樊片九年级上学期数学第一次质量检测试题及答案.doc 2022下半年黑龙江教师资格证中学综合素质真题及答案.doc
2022下半年黑龙江教师资格证中学综合素质真题及答案.doc