2014 年福建省福州市中考化学真题及答案
可能用到的相对原子质量:H—1
C—12
N—14
O—16
Cl—35.5
K—39
Cu—64
一、选择题(共 36 分)
1.关于“舌尖上的化学”,下列说法不科学的是(
)
A.为了身体健康,必须均衡膳食
B.为预防缺碘性疾病,可食用适量海带
C.为延长食品保质期,在食品中添加大力防腐剂
D.为使发面食品松软可口,制作时可添加适量碳酸氢钠
2.下列生活用品所含的主要材料,属于有机合成材料的是(
)
A.铁锅
B.瓷碗
C.塑料盆
D.玻璃杯
3.二氧化锡(SnO2)可用作液晶元件电极,其中氧元素为—2 价,则锡元素的化合价为( )
[来 A.+1
4. 实 验 室 用 高 锰 酸 钾 制 取 氧 气 的 部 分 操 作 如 图 1 所 示 , 其 中 正 确 的 是 (
源:Z|xx|k.Com]
) [来
D.+4
B.+2
C.+3
5.下列化学式表示的物质是某化学肥料的主要成分,其中属于复合肥料的是(
)
A.KNO3
B.K2CO3
C.CO(NH2)2
D.Ca(H2PO4)2
6.下列保护自然资源的措施错误的是(
)
A. 为防治空气污染,应加强工业废气处理
B. 为节约用水,用工业废水直接浇灌农田
C. 为节约化石燃料,应开发和使用新能源
D. 为防止铁制品生锈,常在其表面覆盖保护层
7.用分子观点解释“干冰升华”,下列说法错误的是(
)
A.分子不停地运动
C. 分子体积急剧增大 D. 分子本身不发生改变
B. 分子间间隔变大
8.下列事实和解释相符的是(
)
A.铜丝作导线——铜有良好的导电性
B.盐酸清除铁锈——盐酸能与铁反应
C.汽油清洗油污——汽油起乳化作用
D.活性炭净水——活性炭能与水中杂质反应
9.某物质的分子模型如图 2 所示,下列说法错误的是(
)
A.该物质属于有机物
B.该物质的化学式为 CH4
C.该物质的 1 个分子中含有 5 个原子
D.该物质中碳、氢元素质量比为 1:4
[来源:学。科。网 Z。X。X。K]
10.实验室用蔗糖配制 50.0g 溶质的质量分数为 10%的蔗糖溶液,下列说法错误的是(
)
A.用托盘天平称取 5.0g 蔗糖
B.用量程为 10mL 的量筒量取所需的水
C.溶解蔗糖时,使用的玻璃仪器有烧杯、玻璃棒
D.将配制好的溶液装入细口瓶中,塞好瓶塞并贴上标签
11. 鉴别下列物质所用的方法或试剂,错误的是(
)
A.硬水和软水——观察颜色
B.纯铝和硬铝——比较硬度
C.碳酸钠和氯化钠——稀盐酸
D.羊毛纤维和合成纤维——点燃闻气味
�
12. 将铁丝、铜丝分别伸入盛有同种试剂的两支试管中,下列试剂能迅速比较出铁、铜金属
活动性强弱的是(
)
A.蒸馏水
B.稀硫酸
C.硫酸钠溶液
D.氢氧化钠溶液
二、非选择题(共 64 分)
13.(15 分)多角 度认识物质,能帮助我们更全面了解物质世界。以氧气和二氧化碳为例,
回答下列问题:
(1)认识物质的组成和构成
①从宏观上看,氧气和二氧化碳都由
(填“元素”、“原子”或“分子”,
下同)组成。
②从微观上看,氧气和二氧化碳都由
构成。
(2)认识物质的性质
①氧气的化学性质比较活泼。纳米铁粉在氧气中可自燃生成氧
化铁,反应的化学方程式为
。
②将蘸有酒精的棉芯点燃后放入烧杯中,向烧杯中缓缓倾倒二
氧化碳,观察到烧杯中的棉芯自下而上熄灭(如图 3)。说明二氧化
碳具有的性质有
,由此可推知的灭火原
理 是
是
(3)认识物质的制法
。
。 若 使 棉 芯 下 半 段 恢 复 燃 烧 , 操 作 方 法
①某同学用软塑料瓶自制气体发生装置,通过捏放瓶身可随时控制反
应发生和停止(如图 4)。若利用该装置制氧气,反应的化学方程式
为
。若利用该装置制二
氧化碳,无纺布包内药品为
(写名称)。
②工业上常用液化空气制氧气,该过程发生
(填“物理变化”或“化学变化”)。
(4)辩证地认识物质
①量变引起质变。例如:碳在充足氧气中燃烧生成二氧化碳,在不充足的氧气中燃烧生
成
(写化学式)。
②功过相对论。从“二氧化碳导致温室效应”的事实分析,“过”:使全球气候变暖导致
海平面上升等;“功”:
(举一例)。
14.(9 分)化学变化中,同种元素可在不同物质中“旅行”。(注:“——→”表示某种物质
通过一步反应可转化为另一种物质)回答下列问题:
(1)按甲、乙物质所含元素种类递增的规律,完成图 5 所示的“旅行”。
①若图 5 为碳元素的“旅行”路线,其中甲为二氧化碳,乙为碳酸钙,
写出路线Ⅱ反应的化学方程式:
属于
②若图 5 为氢元素 的“旅行”路线,写出其中一个反应的化学方程式:
(填基本反应类型)。
(写一个),该反应
(2)从单质、碱、盐中分别选择一种物质,完成图 6 所示的“旅行”。写出一组甲、乙、
丙物质的化学式。
。
甲
,乙
,丙
。
图 6
�
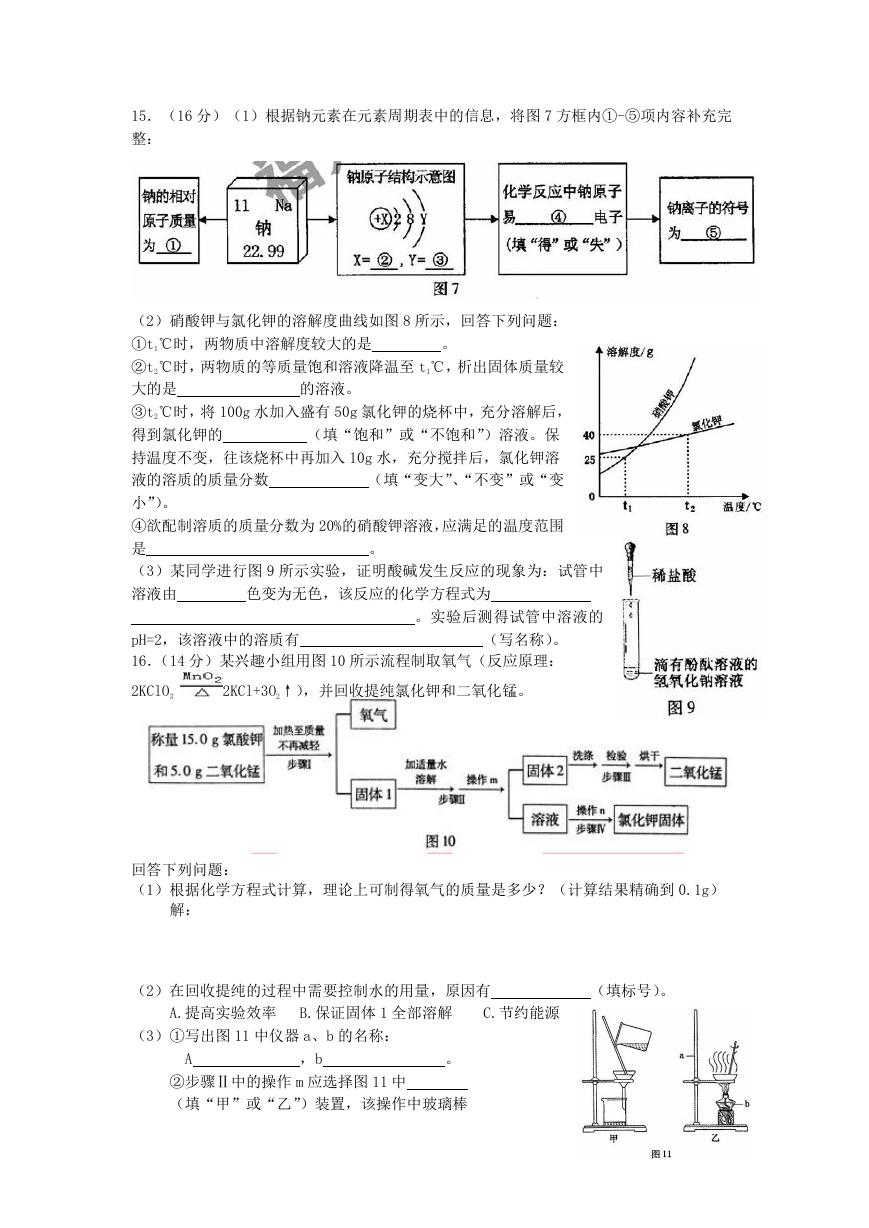
15.(16 分)(1)根据钠元素在元素周期表中的信息,将图 7 方框内①-⑤项内容补充完
整:
。
的溶液。
(2)硝酸钾与氯化钾的溶解度曲线如图 8 所示,回答下列问题:
①t1℃时,两物质中溶解度较大的是
②t2℃时,两物质的等质量饱和溶液降温至 t1℃,析出固体质量较
大的是
③t2℃时,将 100g 水加入盛有 50g 氯化钾的烧杯中,充分溶解后,
得到氯化钾的
(填“饱和”或“不饱和”)溶液。保
持温度不变,往该烧杯中再加入 10g 水,充分搅拌后,氯化钾溶
液的溶质的质量分数
(填“变大”、“不变”或“变
小”)。
④欲配制溶质的质量分数为 20%的硝酸钾溶液,应满足的温度范围
是
(3)某同学进行图 9 所示实验,证明酸碱发生反应的现象为:试管中
溶液由
色变为无色,该反应的化学方程式为
。
。实验后测得试管中溶液的
pH=2,该溶液中的溶质有
(写名称)。
16.(14 分)某兴趣小组用图 10 所示流程制取氧气(反应原理:
2KClO3
2KCl+3O2↑),并回收提纯氯化钾和二氧化锰。
回答下列问题:
(1)根据化学方程式计算,理论上可制得氧气的质量是多少?(计算结果精确到 0.1g)
解:
(2)在回收提纯的过程中需要控制水的用量,原因有
(填标号)。
A.提高实验效率 B.保证固体 1 全部溶解
C.节约能源
(3)①写出图 11 中仪器 a、b 的名称:
A
,b
。
②步骤Ⅱ中的操作 m 应选择图 11 中
(填“甲”或“乙”)装置,该操作中玻璃棒
�
的作用是
③步骤Ⅲ中用酸化的硝酸银(AgNO3)溶液检验洗出液中是否含有氯化钾,该检验方法
。
的原理为
(4)实验结束后,称得回收到的氯化钾的质量比理论值小,
(用化学方程式表示)。
可能的原因有
(写一点)。
17.(10 分)为探究气体 X 的组成,某兴趣小组进行图 12 所示实验(固定装置未画出)。
【资料在线】
(1)加热条件下,气体 X 能与氧化铜反应生成铜、水和氮气。
(2)碱 石灰为固体氢氧化钠和氧 化钙的混合物,不与气体 X 反应。
无水氯化钙可吸收气体 X。[来源:.Com]
(3)本实验条件下,氮气密度为 1.15g·L-1,装置内空气中的水与二氧化碳对相关数据测
定的影响可忽略不计。
【实验步骤】
(1)连接仪器,并检查装置气密性。
(2)取一定量氧化铜,准确称得其质量为 2.40g。
(3)按图 12 所示装入药品,测量并记录相关数据Ⅰ(见表 1)。
(4)连接 A、B、C 装置, 将气体 X 缓缓通入一段时间后,连接上 D 装置,读数后开始加热。
当 A 装置中氧化铜反应完全,停止加热,继续通入气体
记录相关数据Ⅱ(见表 1)。
【实验装置】
X 至玻璃管冷却,再次测量并
【相关数据】
【回答问题】
⑴B 装置中氧化钙吸水的原理为
⑵实验过程中,当观察到
止加热,继续通入气体 X 至玻璃管冷却的目的是
⑶分析 实验测量的数据,生成水的质量为
(用化学方程式表示)。
,说明氧化铜已反应完全,停
。
g,氧化铜中氧元素的质量为
g。
由此推知,气体 X 中一定
(填“有”或 “没有”)氧元素。
⑷通过计算推导出气体 X 的化学式。[来源:学_科_网]
�
�
�










 2023年江西萍乡中考道德与法治真题及答案.doc
2023年江西萍乡中考道德与法治真题及答案.doc 2012年重庆南川中考生物真题及答案.doc
2012年重庆南川中考生物真题及答案.doc 2013年江西师范大学地理学综合及文艺理论基础考研真题.doc
2013年江西师范大学地理学综合及文艺理论基础考研真题.doc 2020年四川甘孜小升初语文真题及答案I卷.doc
2020年四川甘孜小升初语文真题及答案I卷.doc 2020年注册岩土工程师专业基础考试真题及答案.doc
2020年注册岩土工程师专业基础考试真题及答案.doc 2023-2024学年福建省厦门市九年级上学期数学月考试题及答案.doc
2023-2024学年福建省厦门市九年级上学期数学月考试题及答案.doc 2021-2022学年辽宁省沈阳市大东区九年级上学期语文期末试题及答案.doc
2021-2022学年辽宁省沈阳市大东区九年级上学期语文期末试题及答案.doc 2022-2023学年北京东城区初三第一学期物理期末试卷及答案.doc
2022-2023学年北京东城区初三第一学期物理期末试卷及答案.doc 2018上半年江西教师资格初中地理学科知识与教学能力真题及答案.doc
2018上半年江西教师资格初中地理学科知识与教学能力真题及答案.doc 2012年河北国家公务员申论考试真题及答案-省级.doc
2012年河北国家公务员申论考试真题及答案-省级.doc 2020-2021学年江苏省扬州市江都区邵樊片九年级上学期数学第一次质量检测试题及答案.doc
2020-2021学年江苏省扬州市江都区邵樊片九年级上学期数学第一次质量检测试题及答案.doc 2022下半年黑龙江教师资格证中学综合素质真题及答案.doc
2022下半年黑龙江教师资格证中学综合素质真题及答案.doc