2020 年山东高考化学试题及答案
注意事项:
1.答卷前,考生务必将自己的姓名、考生号等填写在答题卡和试卷指定位置。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡
皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上。写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H1C12O16Na23Cl35.5Fe56
一、选择题:本题共 10 小题,每小题 2 分,共 20 分。每小题只有一个选项符合题目要求。
1.实验室中下列做法错误的是
A.用冷水贮存白磷
B.用浓硫酸干燥二氧化硫
C.用酒精灯直接加热蒸发皿
D.用二氧化碳灭火器扑灭金属钾的燃烧
2.下列叙述不涉及氧化还原反应的是
A.谷物发酵酿造食醋
B.小苏打用作食品膨松剂
C.含氯消毒剂用于环境消毒
D.大气中 NO2 参与酸雨形成
3.短周期主族元素 X、Y、Z、W 的原子序数依次增大,基态 X 原子的电子总数是其最高能级电子数的 2 倍,
Z 可与 X 形成淡黄色化合物 Z2X2,Y、W 最外层电子数相同。下列说法正确的是
A.第一电离能:W>X>Y>Z
B.简单离子的还原性:Y>X>W
C.简单离子的半径:W>X>Y>Z
D.氢化物水溶液的酸性:Y>W
4.下列关于 C、Si 及其化合物结构与性质的论述错误的是
A.键能 C C>Si Si
— 、 C H>Si H
—
—
— ,因此 C2H6 稳定性大于 Si2H6
B.立方型 SiC 是与金刚石成键、结构均相似的共价晶体,因此具有很高的硬度
C.SiH4 中 Si 的化合价为+4,CH4 中 C 的化合价为-4,因此 SiH4 还原性小于 CH4
D.Si 原子间难形成双键而 C 原子间可以,是因为 Si 的原子半径大于 C,难形成 p-p π 键
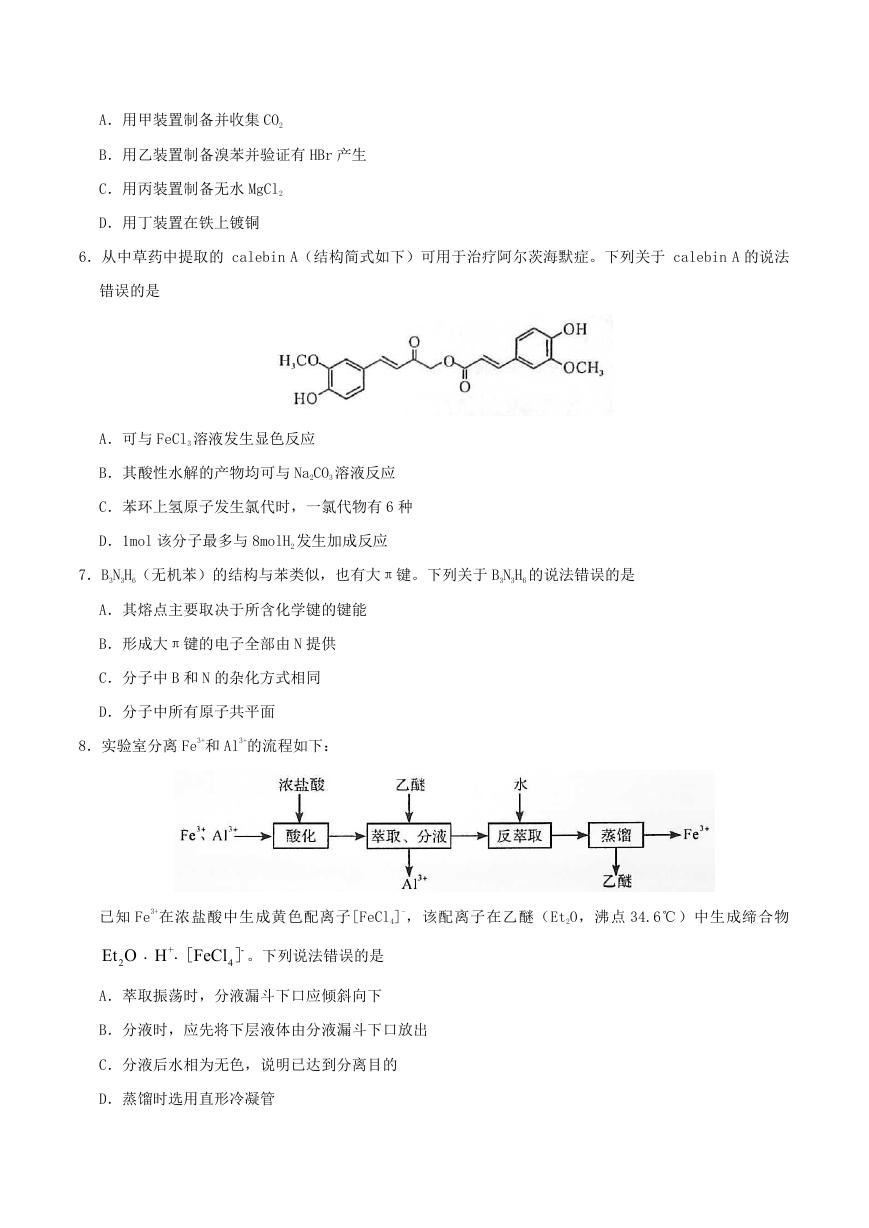
5.利用下列装置(夹持装置略)进行实验,能达到实验目的的是
�
A.用甲装置制备并收集 CO2
B.用乙装置制备溴苯并验证有 HBr 产生
C.用丙装置制备无水 MgCl2
D.用丁装置在铁上镀铜
6.从中草药中提取的 calebin A(结构简式如下)可用于治疗阿尔茨海默症。下列关于 calebin A 的说法
错误的是
A.可与 FeCl3 溶液发生显色反应
B.其酸性水解的产物均可与 Na2CO3 溶液反应
C.苯环上氢原子发生氯代时,一氯代物有 6 种
D.1mol 该分子最多与 8molH2 发生加成反应
7.B3N3H6(无机苯)的结构与苯类似,也有大π键。下列关于 B3N3H6 的说法错误的是
A.其熔点主要取决于所含化学键的键能
B.形成大π键的电子全部由 N 提供
C.分子中 B 和 N 的杂化方式相同
D.分子中所有原子共平面
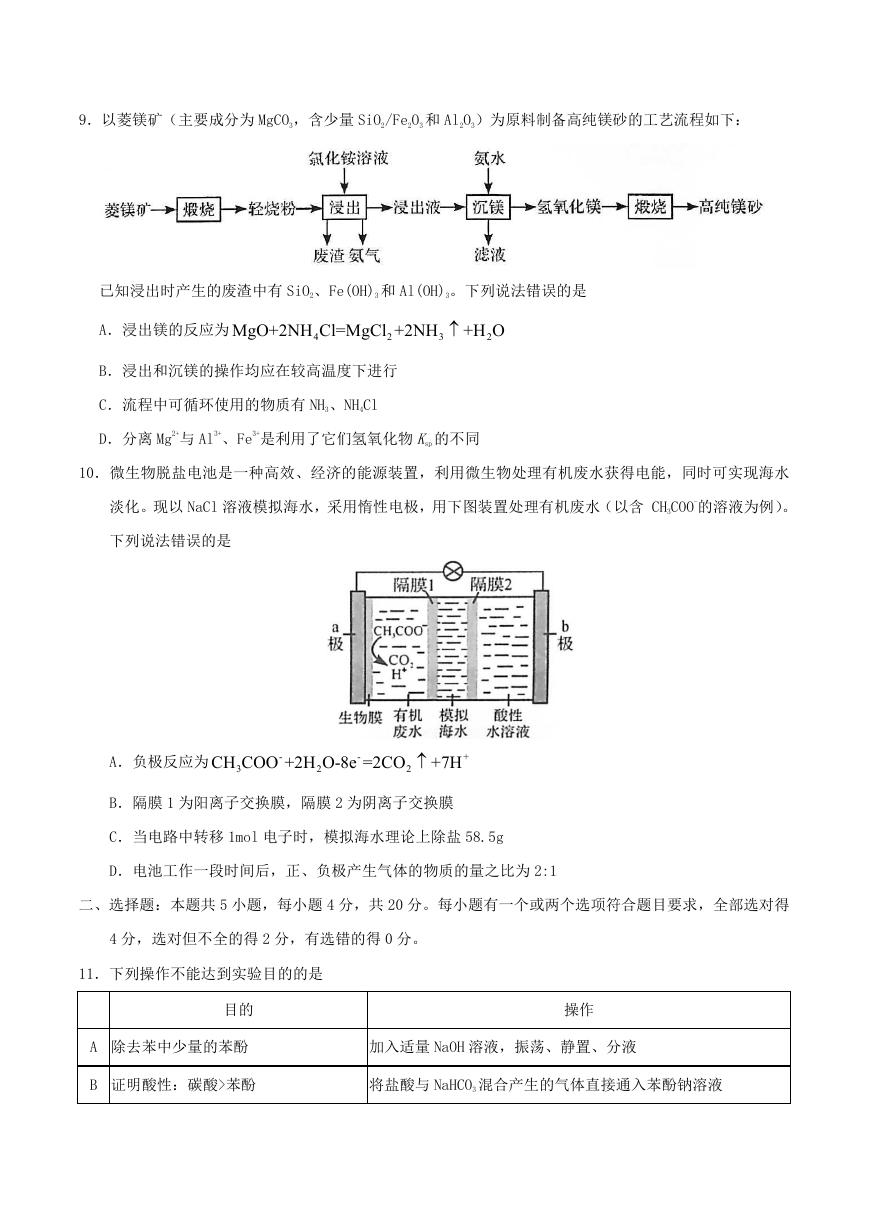
8.实验室分离 Fe3+和 Al3+的流程如下:
已知 Fe3+在浓盐酸中生成黄色配离子[FeCl4]-,该配离子在乙醚(Et2O,沸点 34.6℃)中生成缔合物
Et O H
﹒ ﹒[
2
+
FeCl
4
-
] 。下列说法错误的是
A.萃取振荡时,分液漏斗下口应倾斜向下
B.分液时,应先将下层液体由分液漏斗下口放出
C.分液后水相为无色,说明已达到分离目的
D.蒸馏时选用直形冷凝管
�
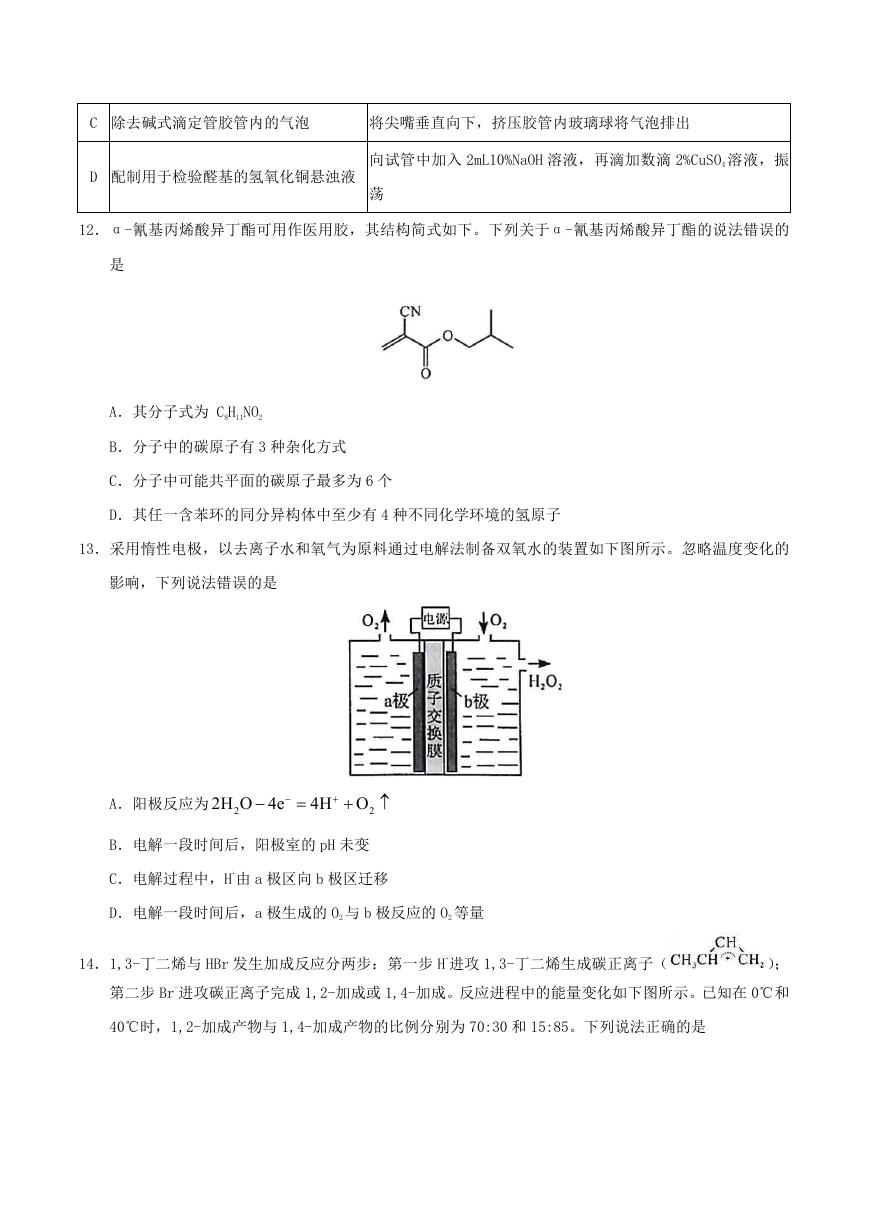
9.以菱镁矿(主要成分为 MgCO3,含少量 SiO2/Fe2O3 和 Al2O3)为原料制备高纯镁砂的工艺流程如下:
已知浸出时产生的废渣中有 SiO2、Fe(OH)3 和 Al(OH)3。下列说法错误的是
A.浸出镁的反应为
MgO+2NH Cl=MgCl +2NH
4
2
+H O
2
3
B.浸出和沉镁的操作均应在较高温度下进行
C.流程中可循环使用的物质有 NH3、NH4Cl
D.分离 Mg2+与 Al3+、Fe3+是利用了它们氢氧化物 Ksp 的不同
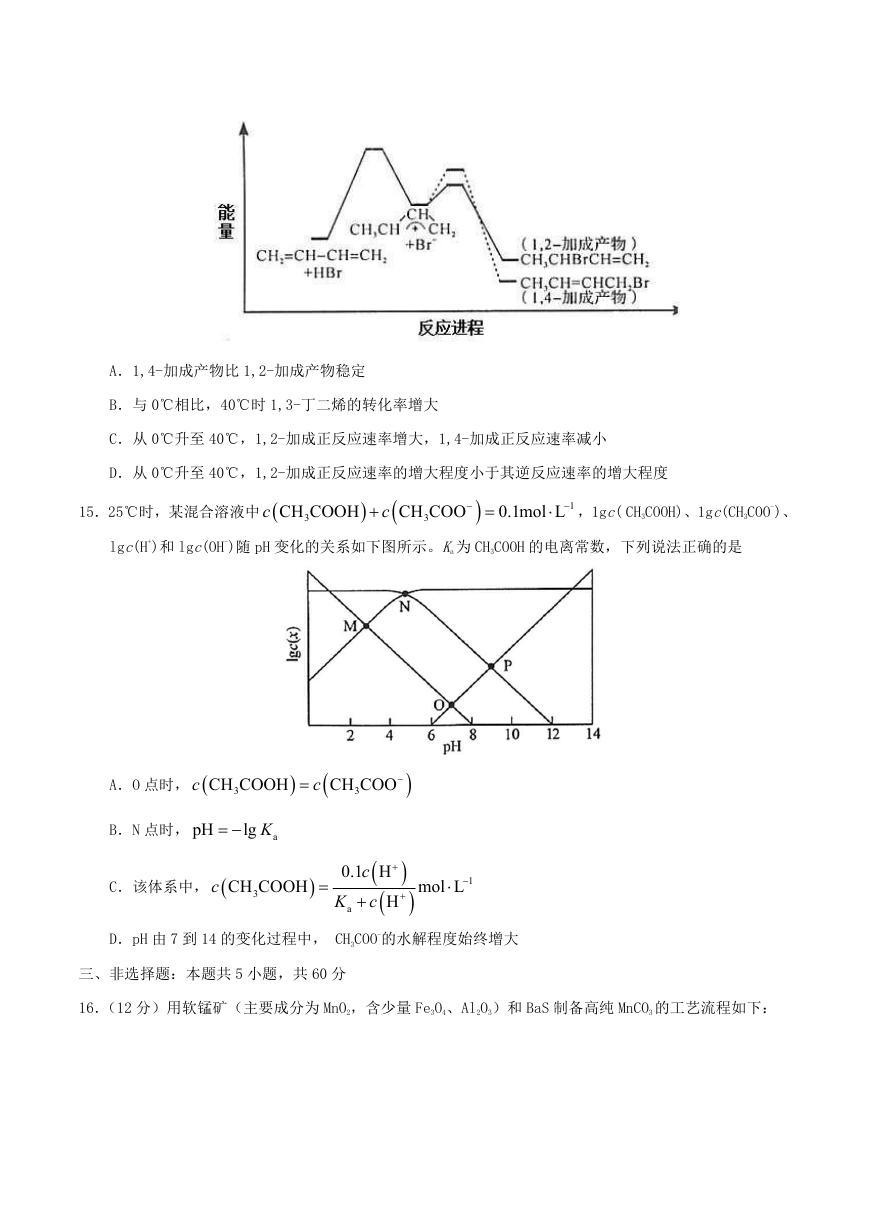
10.微生物脱盐电池是一种高效、经济的能源装置,利用微生物处理有机废水获得电能,同时可实现海水
淡化。现以 NaCl 溶液模拟海水,采用惰性电极,用下图装置处理有机废水(以含 CH3COO-的溶液为例)。
下列说法错误的是
A.负极反应为
CH COO +2H O-8e =2CO
-
-
3
2
+7H
+
2
B.隔膜 1 为阳离子交换膜,隔膜 2 为阴离子交换膜
C.当电路中转移 1mol 电子时,模拟海水理论上除盐 58.5g
D.电池工作一段时间后,正、负极产生气体的物质的量之比为 2:1
二、选择题:本题共 5 小题,每小题 4 分,共 20 分。每小题有一个或两个选项符合题目要求,全部选对得
4 分,选对但不全的得 2 分,有选错的得 0 分。
11.下列操作不能达到实验目的的是
目的
操作
A 除去苯中少量的苯酚
加入适量 NaOH 溶液,振荡、静置、分液
B 证明酸性:碳酸>苯酚
将盐酸与 NaHCO3 混合产生的气体直接通入苯酚钠溶液
�
C 除去碱式滴定管胶管内的气泡
将尖嘴垂直向下,挤压胶管内玻璃球将气泡排出
D 配制用于检验醛基的氢氧化铜悬浊液
荡
向试管中加入 2mL10%NaOH 溶液,再滴加数滴 2%CuSO4 溶液,振
12.α-氰基丙烯酸异丁酯可用作医用胶,其结构简式如下。下列关于α-氰基丙烯酸异丁酯的说法错误的
是
A.其分子式为 C8H11NO2
B.分子中的碳原子有 3 种杂化方式
C.分子中可能共平面的碳原子最多为 6 个
D.其任一含苯环的同分异构体中至少有 4 种不同化学环境的氢原子
13.采用惰性电极,以去离子水和氧气为原料通过电解法制备双氧水的装置如下图所示。忽略温度变化的
影响,下列说法错误的是
A.阳极反应为 2
2H O 4e
4H O
2
B.电解一段时间后,阳极室的 pH 未变
C.电解过程中,H+由 a 极区向 b 极区迁移
D.电解一段时间后,a 极生成的 O2 与 b 极反应的 O2 等量
14.1,3-丁二烯与 HBr 发生加成反应分两步:第一步 H+进攻 1,3-丁二烯生成碳正离子(
);
第二步 Br-进攻碳正离子完成 1,2-加成或 1,4-加成。反应进程中的能量变化如下图所示。已知在 0℃和
40℃时,1,2-加成产物与 1,4-加成产物的比例分别为 70:30 和 15:85。下列说法正确的是
�
A.1,4-加成产物比 1,2-加成产物稳定
B.与 0℃相比,40℃时 1,3-丁二烯的转化率增大
C.从 0℃升至 40℃,1,2-加成正反应速率增大,1,4-加成正反应速率减小
D.从 0℃升至 40℃,1,2-加成正反应速率的增大程度小于其逆反应速率的增大程度
15.25℃时,某混合溶液中
c
CH COOH
3
c
CH COO
3
0.1mol L
,1gc( CH3COOH)、1gc(CH3COO-)、
1
lgc(H+)和 lgc(OH-)随 pH 变化的关系如下图所示。Ka 为 CH3COOH 的电离常数,下列说法正确的是
A.O 点时,
c
CH COOH
3
c
CH COO
3
B.N 点时,
pH
lg K
a
C.该体系中,
c
CH COOH
3
0.1 H
c
H
c
K
a
mol L
1
D.pH 由 7 到 14 的变化过程中, CH3COO-的水解程度始终增大
三、非选择题:本题共 5 小题,共 60 分
16.(12 分)用软锰矿(主要成分为 MnO2,含少量 Fe3O4、Al2O3)和 BaS 制备高纯 MnCO3 的工艺流程如下:
�
已知:MnO2 是一种两性氧化物;25℃时相关物质的 Ksp 见下表。
物质
Fe(OH)2
Fe(OH)3
Al(OH)3
Mn(OH)2
Ksp
1 10
16.3
1 10
38.6
1 10
32.3
1 10
12.7
回答下列问题:
(1)软锰矿预先粉碎的目的是,MnO2 与 BaS 溶液反应转化为 MnO 的化学方程式为。
(2)保持 BaS 投料量不变,随 MnO2 与 BaS 投料比增大,S 的量达到最大值后无明显变化,而 Ba(OH)2
的量达到最大值后会减小,减小的原因是。
(3)滤液 I 可循环使用,应当将其导入到操作中(填操作单元的名称)。
(4)净化时需先加入的试剂 X 为(填化学式)。再使用氨水调溶液的 pH,则 pH 的理论最小值为_______(当
溶液中某离子浓度
c
1
1.0 10 mol L
5
时,可认为该离子沉淀完全)。
(5)碳化过程中发生反应的离子方程式为。
17.(12 分)CdSnAs2 是一种高迁移率的新型热电材料,回答下列问题:
(1)Sn 为ⅣA 族元素,单质 Sn 与干燥 Cl2 反应生成 SnCl4。常温常压下 SnCl4 为无色液体,SnCl4 空间
构型为,其固体的晶体类型为。
(2)NH3、PH3、AsH3 的沸点由高到低的顺序为(填化学式,下同),还原性由强到弱的顺序为,键角由
大到小的顺序为。
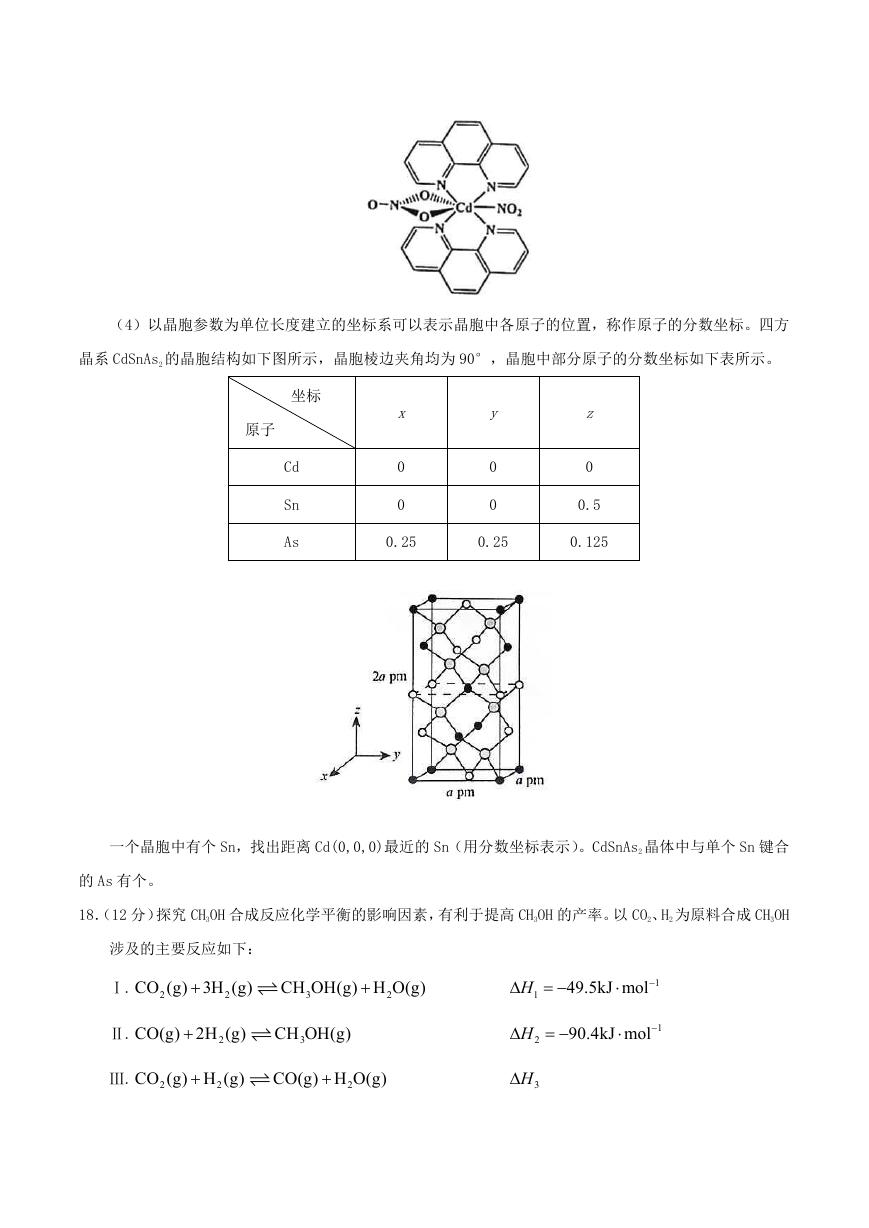
(3)含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。
一种 Cd2+配合物的结构如图所示, 1mol 该配合物中通过螯合作用形成的配位键有 mol,该螯合物中 N 的杂
化方式有种。
�
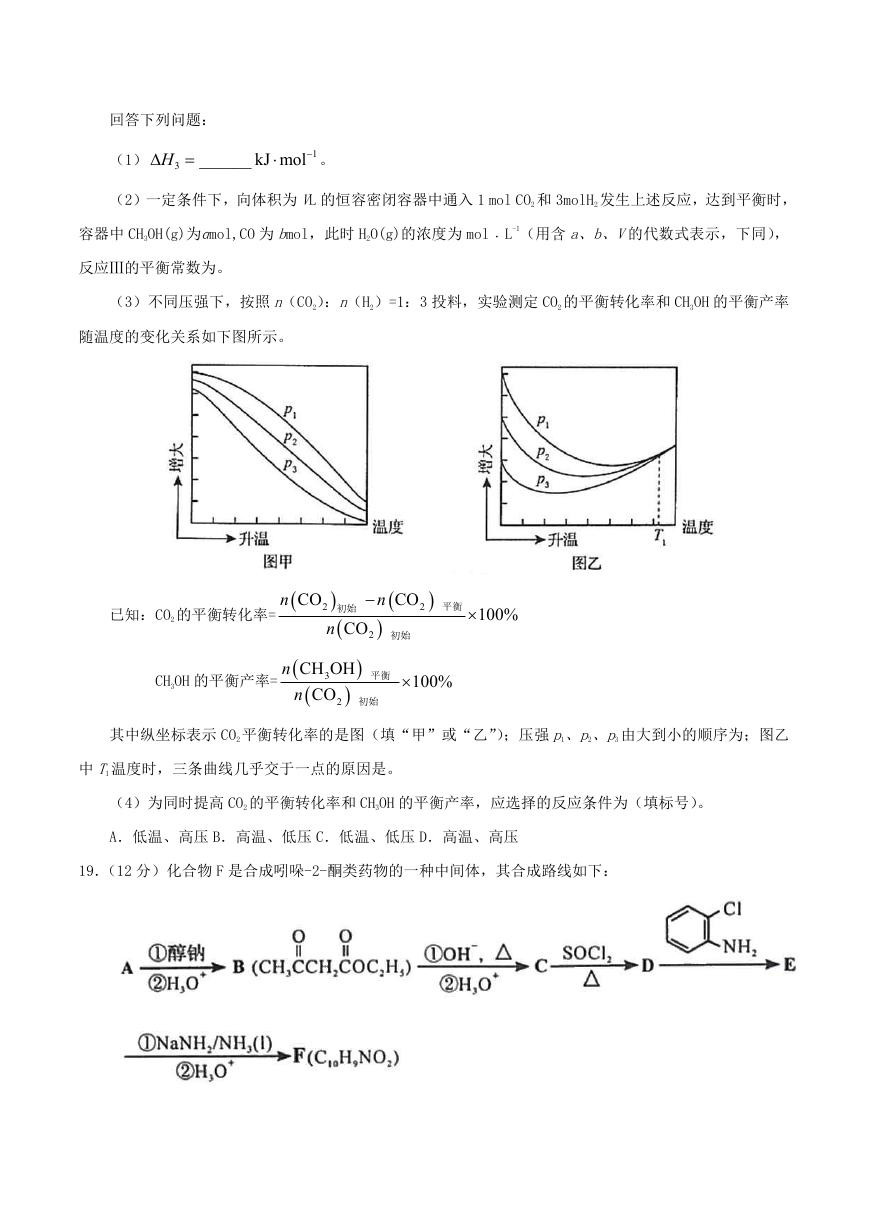
(4)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。四方
晶系 CdSnAs2 的晶胞结构如下图所示,晶胞棱边夹角均为 90°,晶胞中部分原子的分数坐标如下表所示。
坐标
原子
Cd
Sn
As
x
0
0
y
0
0
z
0
0.5
0.25
0.25
0.125
一个晶胞中有个 Sn,找出距离 Cd(0,0,0)最近的 Sn(用分数坐标表示)。CdSnAs2 晶体中与单个 Sn 键合
的 As 有个。
18.(12 分)探究 CH3OH 合成反应化学平衡的影响因素,有利于提高 CH3OH 的产率。以 CO2、H2 为原料合成 CH3OH
涉及的主要反应如下:
Ⅰ.
Ⅱ.
Ⅲ.
CO (g) 3H (g)
2
2
CH OH(g) H O(g)
3
2
CO(g) 2H (g)
2
CO (g) H (g)
2
2
CH OH(g)
3
CO(g) H O(g)
2
H
1
49.5kJ mol
1
H
2
90.4kJ mol
1
3H
�
回答下列问题:
(1)
H
3
______ kJ mol
1
。
(2)一定条件下,向体积为 VL 的恒容密闭容器中通入 1 mol CO2 和 3molH2 发生上述反应,达到平衡时,
容器中 CH3OH(g)为ɑmol,CO 为 bmol,此时 H2O(g)的浓度为 mol﹒L-1(用含 a、b、V的代数式表示,下同),
反应Ⅲ的平衡常数为。
(3)不同压强下,按照 n(CO2):n(H2)=1:3 投料,实验测定 CO2 的平衡转化率和 CH3OH 的平衡产率
随温度的变化关系如下图所示。
已知:CO2 的平衡转化率=
CH3OH 的平衡产率=
n
n
2
初始
CO
2
n
n
CO
CH OH
CO
n
平衡
2
初始
3
2
平衡
100%
CO
初始
100%
其中纵坐标表示 CO2 平衡转化率的是图(填“甲”或“乙”);压强 p1、p2、p3 由大到小的顺序为;图乙
中 T1 温度时,三条曲线几乎交于一点的原因是。
(4)为同时提高 CO2 的平衡转化率和 CH3OH 的平衡产率,应选择的反应条件为(填标号)。
A.低温、高压 B.高温、低压 C.低温、低压 D.高温、高压
19.(12 分)化合物 F 是合成吲哚-2-酮类药物的一种中间体,其合成路线如下:
�










 2023年江西萍乡中考道德与法治真题及答案.doc
2023年江西萍乡中考道德与法治真题及答案.doc 2012年重庆南川中考生物真题及答案.doc
2012年重庆南川中考生物真题及答案.doc 2013年江西师范大学地理学综合及文艺理论基础考研真题.doc
2013年江西师范大学地理学综合及文艺理论基础考研真题.doc 2020年四川甘孜小升初语文真题及答案I卷.doc
2020年四川甘孜小升初语文真题及答案I卷.doc 2020年注册岩土工程师专业基础考试真题及答案.doc
2020年注册岩土工程师专业基础考试真题及答案.doc 2023-2024学年福建省厦门市九年级上学期数学月考试题及答案.doc
2023-2024学年福建省厦门市九年级上学期数学月考试题及答案.doc 2021-2022学年辽宁省沈阳市大东区九年级上学期语文期末试题及答案.doc
2021-2022学年辽宁省沈阳市大东区九年级上学期语文期末试题及答案.doc 2022-2023学年北京东城区初三第一学期物理期末试卷及答案.doc
2022-2023学年北京东城区初三第一学期物理期末试卷及答案.doc 2018上半年江西教师资格初中地理学科知识与教学能力真题及答案.doc
2018上半年江西教师资格初中地理学科知识与教学能力真题及答案.doc 2012年河北国家公务员申论考试真题及答案-省级.doc
2012年河北国家公务员申论考试真题及答案-省级.doc 2020-2021学年江苏省扬州市江都区邵樊片九年级上学期数学第一次质量检测试题及答案.doc
2020-2021学年江苏省扬州市江都区邵樊片九年级上学期数学第一次质量检测试题及答案.doc 2022下半年黑龙江教师资格证中学综合素质真题及答案.doc
2022下半年黑龙江教师资格证中学综合素质真题及答案.doc