2021 年广东暨南大学无机化学考研真题
招生专业与代码:无机化学、分析化学、有机化学、物理化学、高分子化学与物理
考试科目名称及代码:710 无机化学
考生注意:所有答案必须写在答题纸(卷)上,写在本试题上一律不给分。
一、选择题(选择一个正确答案,每小题 2 分,20 题共 40 分)
1. 波函数用于描述( )
(A) 电子的能量
(B) 电子在核外空间的运动
(C) 电子的运动速度
(D) 电子在某一空间出现的概率密度
2. 下列化合物中,既有离子键又有共价键的是( )
(A) CaO
(B) CH4
(C) BaCl2
(D) NH4Cl
3. 下列物质中,不适宜作配体的是( )
(A)
2
3S O
2
(B) H2O
(C) NH4
+
(D) Cl
4. H3O 的杂化类型和空间构型分别为( )
(A) 等性 sp3 杂化,正四面体
(B) 等性 sp3 杂化,三角锥形
(C) 不等性 sp3 杂化,正四面体
(D) 不等性 sp3 杂化,三角锥形
5. NaF、NaCl、NaBr、NaI 中,熔点最低的是( )
(A) NaF
(B) NaCl
(C) NaBr
(D) NaI
6. 将 pH = 5 的强酸溶液与 pH = 13 的强碱溶液等体积混合,混合后溶液的 pH 值为( )
(A) 5.0
(B) 8.0
(C) 9.0
(D) 12.7
7. 某金属离子生成的两种八面体配合物的磁矩分别为 4.90 B.M 和 0 B.M,该离子可能是( )
(A) Cr3+
(B) Mn2+
(C) Mn3+
(D) Fe2+
8. 将固体 NH4NO3 溶于水中,溶液变冷,则该过程的ΔG、ΔH、ΔS的符号依次为( )
(A) +、 、
(B) +、+、
(C) 、+、
(D) 、+、+
9. 下列说法正确的是( )
(A) 两难溶电解质作比较时,Ksp 小的,溶解度一定小
(B) 欲使溶液中某离子沉淀完全,加入的沉淀剂越多越好
(C) 沉淀完全是指用沉淀剂将溶液中某一离子的浓度降为零
(D) 欲使 Ca2+沉淀完全,选择 Na2CO3 作沉淀剂效果比 Na2SO4 好
10. 下面叙述中正确的是( )
�
(A)
H2 的键能等于 H2 的解离能
(B)
C
C 键能是 C=C 键能的一半
(C) 原子核外有多少未成对电子,最多就能形成多少个共价键
(D) 直线型分子 X
Y
Z 是非极性分子
11. 下列核外电子的四个量子数不合理的一组是( )
(A) 3, 2, 2, 1/2
(B) 3, 1,
1, 1/2
(C) 1, 0, 0,
1/2
(D) 2,
1,
0, 1/2
12. 在某温度和体积下,反应 Sn (s) + 2 Cl2 (g)
SnCl4 (g) 达到平衡,已知该反
应自左向右进行是放热的,则下列措施中有利于提高 SnCl4 产量的是( )
(A) 升高温度
(B) 增加压强
(C) 减少 Sn 的量
(D) 通入 N2
13. 下列化合物属于路易斯酸的是( )
(A) AlCl3
(B) NH3
(C) CH3OH
(D) H2O
14. 多电子原子中决定核外电子能量的量子数是( )
(A) n
(B) n和 l
(C) n,l和 m
(D) l
15. 下列溶液中,pH 最小的是( )
(A) 0.010 mol/L HCl
(B) 0.010 mol/L H2SO4
(C) 0.010 mol/L HAc
(D) 0.010 mol/L H2C2O4
16. 将反应 Fe2+ + Ag+ → Fe3+ + Ag 构成原电池,正确的原电池符号为( )
(A) (
) Fe2+(c1)∣Fe3+(c2)‖Ag+(c3)∣Ag(s) (+)
(B) (
) Pt(s)∣Fe2+(c1)∣Fe3+(c2)‖Ag+(c3)∣Ag(s) (+)
(C) (
) Ag(s)∣Ag+(c3)‖Fe2+(c1), Fe3+(c2)∣Pt(s) (+)
(D) (
) Pt(s)∣Fe2+(c1), Fe3+(c2)‖Ag+(c3)∣Ag(s) (+)
17.
E (Sn4+ / Sn2+) = 0.14 V, E (Fe3+ / Fe2+) = 0.77 V,则不能共存的离子是( )
(A) Sn4+,Fe2+
(B) Fe3+,Sn2+
(C) Fe3+,Fe2+
(D) Sn4+,Sn2+
18. 下列几种物质中最稳定的是( )
(A) Co(NO3)3
(B) [Co(NH3)6](NO3)3
(C) [Co(NH3)6]Cl3
(D) [Co(en)3]Cl3
19. 乙醇胺(HOCH2CH2NH2,pKb
Ө = 4.5)和乙醇胺盐配制缓冲溶液的有效 pH 范围是( )
(A) 6 ~ 8
(B) 4 ~ 6
(C) 10 ~ 12
(D) 8 ~ 10
20. 某一级反应的半衰期 t1/2 是 30 min,则其反应速率常数 k 为( )
�
(A) 20.8 min 1
(B) 0.23 min 1
(C) 0.023 min 1
(D) 43.3 min 1
二、填空题(8 小题,每空 1 分,共 20 分)
1. 某元素原子序数为 27,其核外电子排布式为___________________,属第___________周
期,_____________族,元素符号为________。
2. HF 、 HCl 、 HBr 、 HI 中 , 色 散 力 最 大 的 是 ___________________ , 沸 点 最 低 的 是
_________________。
3. 乙烯(C2H4)分子中包含______个 键,_____个 键。
4. 根 据 价 层 电 子 对 互 斥 ( VSEPR ) 理 论 判 断 下 列 分 子 或 离 子 的 空 间 几 何 构 型 : SO3
____________、 2
3SO ____________、SF4 ____________。
5. 在 110 mL 浓度为 0.10 mol/L 的 HAc 溶液中,加入 10 mL 浓度为 0.10 mol/L 的 NaOH 溶
液,所得混合溶液的 pH 为________________。(pKa (HAc) = 4.75)
6. 根 据 酸 碱 质 子 理 论 , 两 性 化 合 物 NH3 的 共 轭 酸 和 共 轭 碱 分 别 是 ___________ 和
___________。
7. 相同温度下,PbSO4 在 KNO3 溶液中的溶解度比在纯水中的溶解度_____________,这种现
象 称 为 _____________ 效 应 。 PbSO4 在 Na2SO4 溶 液 中 的 溶 解 度 比 在 纯 水 中 的 溶 解 度
____________,这种现象称为_______________效应。
8. [Ni(CN)4]2 的几何构型为______________,具有_____________磁性。
三、计算题(3 小题,每题 10 分,共 30 分)
1. 现有 100 mL 溶液,其中含有 0.0020 mol KI 和 0.0020 mol Na2SO4,向其中逐滴加入 Pb(NO3)2
溶液,通过计算说明先生成的沉淀是什么?当 2
4SO 沉淀完全时(c < 1.0 10 5 mol/L),
溶液中的 I 的浓度是多少?(已知
spK (PbI2) = 8.0 10 9,
spK (PbSO4) = 1.8 10 8 )2.
已知:
CuS (s)
+
H2 (g) → Cu (s)
+
H2S (g)
f
mH / kJ mol 1
mS / J mol 1 K 1
53.1
0
0
20.6
66.5
130.57
33.15
205.7
试求:1)该反应正向自发进行的最低温度;2)该反应在 298 K 的标准平衡常数 K 。
3. 已知 E (MnO2/Mn2+) = 1.229 V, E (Cl2/Cl ) = 1.360 V。试通过计算判断反应
MnO2 (s) + 4 HCl (aq) → MnCl2 (aq) + Cl2 (g) + 2 H2O (l) 在 298 K 时的标准态下能否
�
正向自发进行。并通过计算说明实验室中为什么能用浓盐酸(c = 12 mol/L)来制取氯气。
四、论述题(8 分)
请选取你所熟悉的当今无机化学领域的某一研究方向,简要论述该方向的研究内容、最新进
展和研究意义。
五、简答题(3 小题,共 11 分)
1. 某 A3B 型离子化合物(A 代表阳离子,B 代表阴离子)由四种元素组成,一种为氢,另有
两种第二周期元素和一种第三周期元素。阴、阳离子分别由两种元素构成且均呈正四面体构
型。写出该化合物的化学式。(4 分)
2. 铁元素是地壳中含量次高的金属元素(仅次于铝)。在地球漫长的演化过程中,溶解在海
洋中 Fe2+被空气氧化转变成针铁矿 FeO(OH)而沉积。写出该反应配平的离子方程式。(3 分)
3.
Bi Cl 离子中铋原子的配位数为 5,每个铋中心采取四方锥几何构型。请画出该离子的
2
8
2
结构并指出 Bi 原子的杂化轨道类型。(4 分)
六、简答题(7 小题,共 21 分)
氮是自然界中最常见的非金属元素之一,绝大部分以单质的形式存在于大气中。自然界主要
通过含有固氮酶的微生物将大气中的氮气转化为氨,使氮元素进入氮循环。而现今的工业固
氮方法(哈伯法)是通过氮气与氢气在高温高压下的催化反应来直接合成氨气。
1. 试写出叠氮阴离子(N3 )两种可能的路易斯结构式。(4 分)
2. 叠氮酸(HN3)与氟气(F2)发生剧烈反应,生成某种拟卤素与卤素的互化物和一种常见
的盐。请写出配平的反应方程式。(4 分)
3. 含能纯氮物种属于超高能量密度材料,可用于制备炸药。1998 年,美国爱德华空军基地
实验室(AFRL)的科学家首次制备了“盐粒炸弹”,即含有 N5
+ 阳离子的盐,例如 N5AsF6。该
阳离子的键长和键角如下图所示,请画出其路易斯结构式,并说明中间三个氮原子的杂化轨
道类型。(4 分)
4. 最近,南京理工大学胡炳成教授团队在《Science》杂志报道了首个稳定存在、可大量制
备的含环状全氮阴离子(N5 )化合物(N5)n(H3O)3(NH4)4Cl。请判断该化学式中 n值的大小。(2
�
分)
5. 上述环状全氮阴离子 N5 具有很强的爆炸性,极易通过 1,3-偶极环加成的逆反应开环分
解生成一种阴离子,并放出一种无色无味的气体。请写出该分解反应的配平的方程式。(2
分)
6. 与全氮阴离子 N5 互为等电子体的环戊二烯基阴离子 C5H5 具有显著的芳香性,是有机金
属化学中一类常见的配体。请说明 C5H5 具有多少个离域共轭的 电子,并写出一种含有环
戊二烯基阴离子的过渡金属化合物。(2 分)
7. 很多含氮化合物由于其易爆性被列为危险化学品,在储存和运输过程中都需采取严格的
安全措施。2020 年 8 月 4 日,黎巴嫩贝鲁特港发生剧烈爆炸,爆炸产生的地震波相当于 3.3
级地震,视频显示爆炸发生时空中产生红棕色的蘑菇云。调查表明爆炸是由存放在港口的
2750 吨硝酸铵引起的。请写出在爆炸条件下硝酸铵分解反应(共 3 种产物)的配平反应方
程式。(3 分)
七、简答题(5 小题,共 20 分)
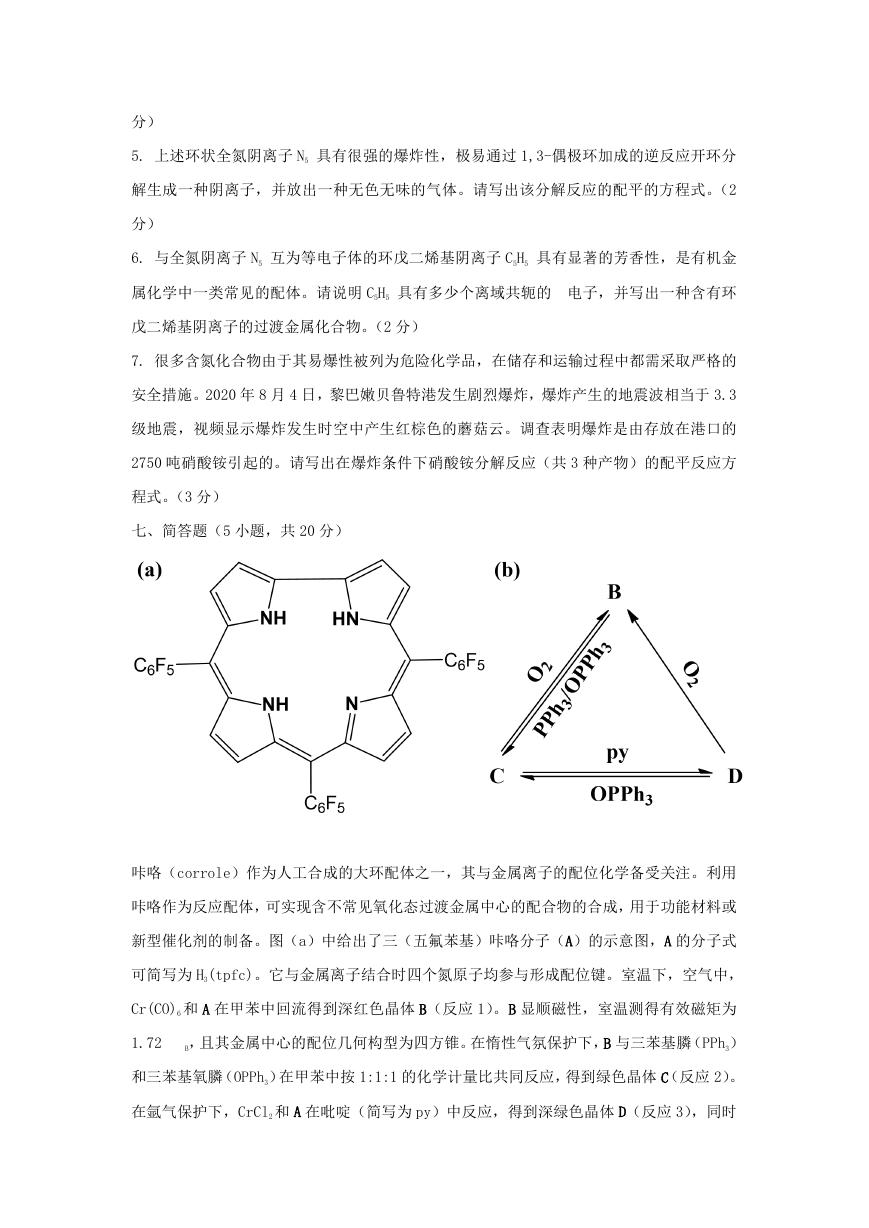
咔咯(corrole)作为人工合成的大环配体之一,其与金属离子的配位化学备受关注。利用
咔咯作为反应配体,可实现含不常见氧化态过渡金属中心的配合物的合成,用于功能材料或
新型催化剂的制备。图(a)中给出了三(五氟苯基)咔咯分子(A)的示意图,A 的分子式
可简写为 H3(tpfc)。它与金属离子结合时四个氮原子均参与形成配位键。室温下,空气中,
Cr(CO)6 和 A 在甲苯中回流得到深红色晶体 B(反应 1)。B 显顺磁性,室温测得有效磁矩为
1.72
B,且其金属中心的配位几何构型为四方锥。在惰性气氛保护下,B 与三苯基膦(PPh3)
和三苯基氧膦(OPPh3)在甲苯中按 1:1:1 的化学计量比共同反应,得到绿色晶体 C(反应 2)。
在氩气保护下,CrCl2 和 A 在吡啶(简写为 py)中反应,得到深绿色晶体 D(反应 3),同时
�
放出氢气。配合物 D 的金属中心采取八面体几何构型,且所有配位原子均为氮原子。在一定
条件下,B、C 和 D 之间可以相互转化,如图(b)所示,这一过程被认为可用于 O2 的活化。
1. 从图(a)中咔咯的分子结构判断,咔咯与金属中心结合时形成的阴离子配体通常带有几
个负电荷?(2 分)
2. 写出 B、C、D 的化学式(配体用简写符号表示)。(6 分)
3. 写出 B、C、D 三个配合物中金属中心的价电子组态(均用“ dn ”的形式表示)。(3 分)
4)分别写出制备化合物 B、C、D 的反应 1、2、3 的配平的化学反应方程式(配体用简写符
号表示,系数为最简整数比)。(6 分)
5)电化学研究表明,配合物 B 失去一个电子转化为 B+,且 B+仍表现出顺磁性。紫外可见光
谱分析表明,与咔咯配体相关的吸收峰位置发生了显著变化。请推测 B+中金属中心的价电子
组态(用“ dn ”的形式表示),并解释其显示顺磁性及光谱变化的原因。(3 分)
�











 2023年江西萍乡中考道德与法治真题及答案.doc
2023年江西萍乡中考道德与法治真题及答案.doc 2012年重庆南川中考生物真题及答案.doc
2012年重庆南川中考生物真题及答案.doc 2013年江西师范大学地理学综合及文艺理论基础考研真题.doc
2013年江西师范大学地理学综合及文艺理论基础考研真题.doc 2020年四川甘孜小升初语文真题及答案I卷.doc
2020年四川甘孜小升初语文真题及答案I卷.doc 2020年注册岩土工程师专业基础考试真题及答案.doc
2020年注册岩土工程师专业基础考试真题及答案.doc 2023-2024学年福建省厦门市九年级上学期数学月考试题及答案.doc
2023-2024学年福建省厦门市九年级上学期数学月考试题及答案.doc 2021-2022学年辽宁省沈阳市大东区九年级上学期语文期末试题及答案.doc
2021-2022学年辽宁省沈阳市大东区九年级上学期语文期末试题及答案.doc 2022-2023学年北京东城区初三第一学期物理期末试卷及答案.doc
2022-2023学年北京东城区初三第一学期物理期末试卷及答案.doc 2018上半年江西教师资格初中地理学科知识与教学能力真题及答案.doc
2018上半年江西教师资格初中地理学科知识与教学能力真题及答案.doc 2012年河北国家公务员申论考试真题及答案-省级.doc
2012年河北国家公务员申论考试真题及答案-省级.doc 2020-2021学年江苏省扬州市江都区邵樊片九年级上学期数学第一次质量检测试题及答案.doc
2020-2021学年江苏省扬州市江都区邵樊片九年级上学期数学第一次质量检测试题及答案.doc 2022下半年黑龙江教师资格证中学综合素质真题及答案.doc
2022下半年黑龙江教师资格证中学综合素质真题及答案.doc