2011 年吉林高考理科综合真题及答案
本是卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分第Ⅰ卷第 1 页至第 5 页,第Ⅱ卷第
6 页至第 12 页。全卷满分 300 分
1.答题前,考生务必将自己的准考证号、姓名填写在答题卡上。考生要认真核对答题卡上所
粘贴的条形码中“准考证号、姓名、考试科目”与考生本人准考证号、姓名是否一致。
2.答第Ⅰ卷时,每小题选出答案后,用 2B 铅笔把答题卡上对应题目的答案标号涂黑。如需
改动,用橡皮擦擦干净后,再选涂其他答案标号。答第Ⅱ卷卷时,必须使用 0.5 毫米的
黑色墨水签字笔在答题卡上书写,要求字体工整、笔迹清晰。作图题可先用铅笔在答题卡
规定的位置绘出,确认后再用 0.5 毫米的黑色墨水签字笔描清楚。必须在题号所指示的
答题区域作答,超出答题区域书写的答案无效,在试题卷、草稿纸上答题无效。
3.考试结束,监考员将将试题卷和答题一并收回。
第Ⅰ卷(选择题
共 120 分)
本试卷共 21 小题,每小题 6 分,共 126 分。合题目要求的。
以下数据可供解题时参考:
相对原子质量(原子量):H
40
C
64
B 11
12
14
N
1
O
16
Na
23
S
Cl
32
一、选择题:本大题共 13 小题,每小题 6 分。在每小题给出的四个选项中,只有一项是符合题目
35.5
Ca
Cu
要求的。
1.将人的红细胞放入 4℃蒸馏水中,一段时间后红细胞破裂,主要原因是
A.红细胞具有水溶性
C.蒸馏水大量进入红细胞
B.红细胞的液泡体积增大
D.低温时红细胞膜流动性增大
2.甲、乙两种酶用同一种蛋白酶处理,酶活性与处理时间的关系如下图所示。下列分析错误的是
A.甲酶能够抗该种蛋白酶降解
B.甲酶是不可能具有催化功能的 RNA
C.乙酶的化学本质为蛋白质
D.乙酶活性的改变是因为其分子结构的改变
3.番茄幼苗在缺镁的培养液中培养一段时间后,与对照组相比,其叶片光合作用强度下降,原因
是
A.光反应强度升高,暗反应强都降低
B.光反应强度降低,暗反应强都降低
C.反应强度不变,暗反应强都降低
D.反应强度降低,暗反应强都不变
4.取紫色洋葱外表皮,分为两份,假定两份外表皮细胞的大小、数目和生理状态一致,一份在完
全营养液中浸泡一段时间,浸泡后的外表皮称为甲组;另一份在蒸馏水中浸泡相同的时间,
�
浸泡后的外表皮称为乙组。然后,两组外表皮都用浓度为 0.3 g
ml 的蔗糖溶液里处理,一段
时间后外表皮细胞中的水分不再减少。此时甲、乙两组细胞水分渗出量的大小,以及水分运
出细胞的方式是
A.甲组细胞的水分渗出量与乙组细胞的相等,主动运输
B.甲组细胞的水分渗出量比乙组细胞的高,主动运输
C.甲组细胞的水分渗出量比乙组细胞的低,被动运输
D.甲组细胞的水分渗出量与乙组细胞的相等,被动运输
5.人在恐惧、紧张时,在内脏神经的支配下,肾上腺髓质释放的肾上腺素增多,该激素可用于心
脏,使心率加快。下列叙述错误的是
A.该肾上腺素作用的靶器官包括心脏
B.该实例包含神经调节和体液调节
C.该肾上腺素通过神经纤维运输到心脏
D.该实例中反射弧是实现神经调节的结构基础
6.下表是根据实验目的,所选用的试剂与预期的实验结果正确的是
实验目的
A 观察根尖分生组织细胞的
试剂
醋酸洋红
预期的实验结果
染色体被染成紫红色
有丝分裂
B 检测植物组织中的脂肪
C 检测植物组织中的葡萄糖 甲基绿
双缩脲试剂
D 观察 DNA 和 RNA 在细胞中
斐林试剂吡罗红
的分布
7.下列叙述正确的是
脂肪颗粒被染成红色
葡萄糖与甲基绿作用,生
成绿色沉淀
斐林试剂将 DNA 染成绿色,
吡罗红将 RNA 染成红色
NaCl 中含有 6.02×1023 个 NaCl 分子
NaCl 中,所有 Na+的最外层电子总数为 8×6.02×1023
A.1.00mol
B.1.00mol
C.欲配置 1.00L ,1.00mol.L-1 的 NaCl 溶液,可将 58.5g NaCl 溶于 1.00L 水中
D.电解 58.5g 熔融的 NaCl,能产生 22.4L 氯气(标准状况)、23.0g 金属钠
8.分子式为 C5H11Cl 的同分异构体共有(不考虑立体异构)
C. 8 种
A.6 种
B.7 种
9.下列反应中,属于取代反应的是
D.9 种
①CH3CH=CH2+Br2
CH3CHBrCH2Br
②CH3CH2OH
CH2=CH2+H2O
③CH3COOH+CH3CH2OH
CH3COOCH2CH3+H2O
④C6H6+HNO3
C6H5NO2+H2O
A. ①②
B.③④
C.①③
D.②④
10.将浓度为 0.1mol·L-1HF 溶液加水不断稀释,下列各量始终保持增大的是
�
A.c(H+)
B.K2(HF)
C.
-
Fc
)(
Hc
)(
D.
Hc
)(
HF
c
)(
11.铁镍蓄电池又称爱迪生电池,放电时的总反应为:
Fe+Ni2O3+3H2O=Fe(OH)2+2Ni(OH)2
下列有关该电池的说法不正确...的是
A.电池的电解液为碱性溶液,正极为 Ni2O3、负极为 Fe
B.电池放电时,负极反应为 Fe+2OH--2e-=Fe(OH)2
C.电池充电过程中,阴极附近溶液的 pH 降低
D.电池充电时,阳极反应为 2Ni(OH)2+2OH--2e-=Ni2O3+3H2O
12.能正确表示下列反应的离子方程式为
A.硫化亚铁溶于稀硝酸中:FeS+2H+=Fe2++H2S
B.NH4HCO3 溶于过量的 NaOH 溶液中:HCO3
C.少量 SO2 通入苯酚钠溶液中:C6H5O-+SO2+H2O=C6H5OH+HSO3
-+OH-=CO3
2-+H2O
-
D.大理石溶于醋酸中:CaCO3+2CH3COOH=Ca2++2CH3COO-+CO2 +H2O
13.短周期元素 W、X、Y 和 Z 的原子序数依次增大。元素 W 是制备一种高效电池的重要材料,X
原子的最外层电子数是内层电子数的 2 倍,元素 Y 是地壳中含量最丰富的金属元素,Z 原子的
最外层电子数是其电子层数的 2 倍。下列说法错误的是
A.元素 W、X 的氯化物中,各原子均满足 8 电子的稳定结构
B.元素 X 与氢形成的原子比为 1:1 的化合物有很多种
C.元素 Y 的单质与氢氧化钠溶液或盐酸反应均有氢气生成
D.元素 Z 可与元素 X 形成共价化合物 XZ2
二、选择题:本大题共 8 小题,每小题 6 分,在每小题给出的四个选项中,有的只有一项符合题
目要求,有的有多项符合题目要求。全部选对的得 6 分,选对但不全的得 3 分,有选错的得
0 分。
14.为了解释地球的磁性,19 世纪安培假设:地球的磁场是由绕过地心的轴的环形电流 I 引起的。
在下列四个图中,正确表示安培假设中环形电流方向的是
15.一质点开始时做匀速直线运动,从某时刻起受到一恒力作用。此后,该质点的动能可能
A.一直增大
B.先逐渐减小至零,再逐渐增大
C.先逐渐增大至某一最大值,再逐渐减小
D.先逐渐减小至某一非零的最小值,再逐渐增大
16.一蹦极运动员身系弹性蹦极绳从水面上方的高台下落,到最低点时距水面还有数米距离。假
定空气阻力可忽略,运动员可视为质点,下列说法正确的是
A.运动员到达最低点前重力势能始终减小
B.蹦极绳张紧后的下落过程中,弹性力做负功,弹性势能增加
C.蹦极过程中,运动员、地球和蹦极绳所组成的系统机械能守恒
�
D.蹦极过程中,重力势能的改变与重力势能零点的选取有关
17.如图,一理想变压器原副线圈的匝数比为 1:2;副线圈电路中接有灯泡,灯泡的额定电压为
220V,额定功率为 22W;原线圈电路中接有电压表和电流表。现闭合开关,灯泡正常发光。若
用 U 和 I 分别表示此时电压表和电流表的读数,则
A.
U
110 ,
V I
0.2
A
B.
U
110 ,
V I
0.05
A
C.
U
110 2 ,
V I
0.2
A
D.
U
110 2 ,
V I
0.2 2
A
18.电磁轨道炮工作原理如图所示。待发射弹体可在两平行轨道之间自由移动,并与轨道保持良
好接触。电流 I 从一条轨道流入,通过导电弹体后从另一条轨道流回。轨道电流可形成在弹
体处垂直于轨道面得磁场(可视为匀强磁场),磁感应强度的大小与 I 成正比。通电的弹体在
轨道上受到安培力的作用而高速射出。现欲使弹体的出射速度增加至原来的 2 倍,理论上可
采用的方法是
A.只将轨道长度 L 变为原来的 2 倍
B.只将电流 I 增加至原来的 2 倍
C.只将弹体质量减至原来的一半
D.将弹体质量减至原来的一半,轨道长度 L 变为原
来的 2 倍,其它量不变
19.卫星电话信号需要通地球同步卫星传送。如果你与同
学在地面上用卫星电话通话,则从你发出信号至对方接收到信号所需最短时间最接近于(可
能用到的数据:月球绕地球运动的轨道半径约为 3.8×105m/s,运行周期约为 27 天,地球半
径约为 6400km,无线电信号的传播速度为
3 10
8
/m s
)
A.0.1s
B..25s
C.0.5s
D.1s
20.一带负电荷的质点,在电场力作用下沿曲线 abc 从 a 运动到 c,已知质点的速率是递减的。
关于 b 点电场强度 E 的方向,下列图示中可能正确的是(虚线是曲线在 b 点的切线)
21.如图,在光滑水平面上有一质量为 m1 的足够长的木板, 其上叠放一质量为 m2 的木块。假定
木块和木板之间的最大静摩擦力和滑动摩擦力相等。现给木块施加一随时间 t 增大的水平力
F=kt(k 是常数),木板和木块加速度的大小分别为 a1 和 a2,下列反映 a1 和 a2 变化的图线中
正确的是
�
注意事项:
第Ⅱ卷
第 II 卷 11 页,须用黑色墨水签字笔在答题卡上书写作答,在试题卷上作答,答案无效。
三、非选择题:包括必考题和选考题两部分。第 22 题~第 32 题为必考题,每个试题考生都必须
作答。第 33 题~第 40 题为选考题,考生根据要求作答。
(一)必考题(11 题,共 129 分)
22.(5 分)
为了测量一微安表头 A 的内阻,某同学设计了如图所示的电路。图中,A0 是标准电流表,R0
和 RN 分别是滑动变阻器和电阻箱,S 和 S1 分别是单刀双掷开关和单刀开关,E 是电池。完成下列
实验步骤中的填空:
(1)将 S 拨向接点 1,接通 S1,调节________,使待测表头指针偏转到适当位置,记下此时
_____的读数 I;
(2)然后将 S 拨向接点 2,调节________,使________,记下此时 RN 的读数;
(3)多次重复上述过程,计算 RN 读数的________,此即为待测微安表头内阻的测量值。
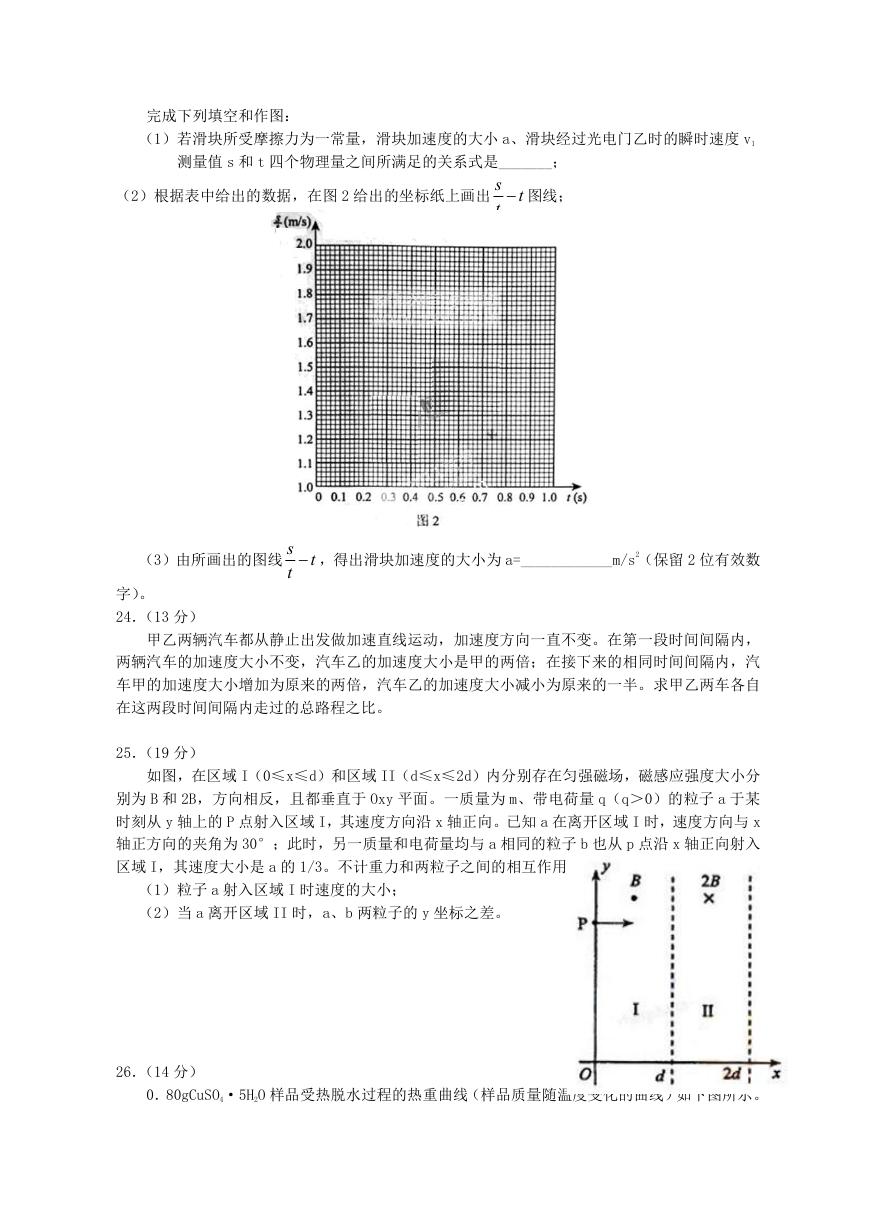
23.(10 分)
利用图 1 所示的装置可测量滑块在斜面上运动的加速度。一斜面上安装有两个光电门,其中
光电门乙固定在斜面上靠近底端处,光电门甲的位置可移动,当一带有遮光片的滑块自斜面上滑
下时,与两个光电门都相连的计时器可以显示出遮光片从光电门甲至乙所用的时间 t。改变光电
门甲的位置进行多次测量,每次都使滑块从同一点由静止开始下滑,并用米尺测量甲、乙之间的
距离 s,记下相应的 t 值;所得数据如下表所示。
s(m) 0.500
t(ms) 292.9
s/t
(m/s)
1.71
0.600
371.5
1.62
0.700
452.3
1.55
0.800
552.8
1.45
0.900
673.8
1.34
0.950
776.4
1.22
�
完成下列填空和作图:
(1)若滑块所受摩擦力为一常量,滑块加速度的大小 a、滑块经过光电门乙时的瞬时速度 v1
测量值 s 和 t 四个物理量之间所满足的关系式是_______;
(2)根据表中给出的数据,在图 2 给出的坐标纸上画出
s
t
图线;
t
(3)由所画出的图线
s
t
字)。
24.(13 分)
,得出滑块加速度的大小为 a=____________m/s2(保留 2 位有效数
t
甲乙两辆汽车都从静止出发做加速直线运动,加速度方向一直不变。在第一段时间间隔内,
两辆汽车的加速度大小不变,汽车乙的加速度大小是甲的两倍;在接下来的相同时间间隔内,汽
车甲的加速度大小增加为原来的两倍,汽车乙的加速度大小减小为原来的一半。求甲乙两车各自
在这两段时间间隔内走过的总路程之比。
25.(19 分)
如图,在区域 I(0≤x≤d)和区域 II(d≤x≤2d)内分别存在匀强磁场,磁感应强度大小分
别为 B 和 2B,方向相反,且都垂直于 Oxy 平面。一质量为 m、带电荷量 q(q>0)的粒子 a 于某
时刻从 y 轴上的 P 点射入区域 I,其速度方向沿 x 轴正向。已知 a 在离开区域 I 时,速度方向与 x
轴正方向的夹角为 30°;此时,另一质量和电荷量均与 a 相同的粒子 b 也从 p 点沿 x 轴正向射入
区域 I,其速度大小是 a 的 1/3。不计重力和两粒子之间的相互作用力。求
(1)粒子 a 射入区域 I 时速度的大小;
(2)当 a 离开区域 II 时,a、b 两粒子的 y 坐标之差。
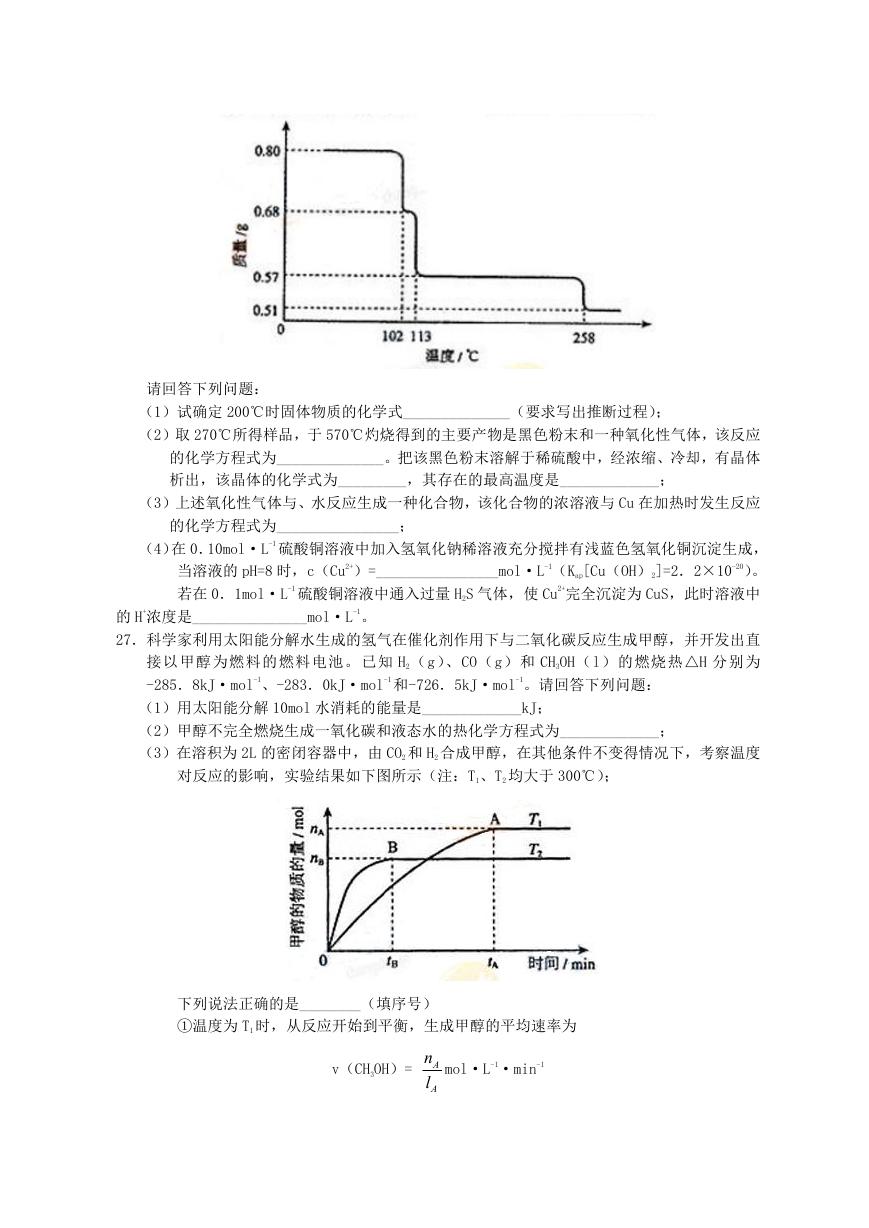
26.(14 分)
0.80gCuSO4·5H2O 样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如下图所示。
�
请回答下列问题:
(1)试确定 200℃时固体物质的化学式______________(要求写出推断过程);
(2)取 270℃所得样品,于 570℃灼烧得到的主要产物是黑色粉末和一种氧化性气体,该反应
的化学方程式为______________。把该黑色粉末溶解于稀硫酸中,经浓缩、冷却,有晶体
析出,该晶体的化学式为_________,其存在的最高温度是_____________;
(3)上述氧化性气体与、水反应生成一种化合物,该化合物的浓溶液与 Cu 在加热时发生反应
的化学方程式为________________;
(4)在 0.10mol·L-1 硫酸铜溶液中加入氢氧化钠稀溶液充分搅拌有浅蓝色氢氧化铜沉淀生成,
当溶液的 pH=8 时,c(Cu2+)=________________mol·L-1(Kap[Cu(OH)2]=2.2×10-20)。
若在 0.1mol·L-1 硫酸铜溶液中通入过量 H2S 气体,使 Cu2+完全沉淀为 CuS,此时溶液中
的 H+浓度是_______________mol·L-1。
27.科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直
接以甲醇为燃料的燃料电池。已知 H2(g)、CO(g)和 CH3OH(l)的燃烧热△H 分别为
-285.8kJ·mol-1、-283.0kJ·mol-1 和-726.5kJ·mol-1。请回答下列问题:
(1)用太阳能分解 10mol 水消耗的能量是_____________kJ;
(2)甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为_____________;
(3)在溶积为 2L 的密闭容器中,由 CO2 和 H2 合成甲醇,在其他条件不变得情况下,考察温度
对反应的影响,实验结果如下图所示(注:T1、T2 均大于 300℃);
下列说法正确的是________(填序号)
①温度为 T1 时,从反应开始到平衡,生成甲醇的平均速率为
v(CH3OH)=
A
mol·L-1·min-1
n
l
A
�
②该反应在 T 时的平衡常数比 T2 时的小
③该反应为放热反应
④处于 A 点的反应体系从 T1 变到 T2,达到平衡时
(
n H
)
(
n CH OH
2
3
增大
)
(4)在 T1 温度时,将 1molCO2 和 3molH2 充入一密闭恒容器中,充分反应达到平衡后,若 CO2
转化率为 a,则容器内的压强与起始压强之比为______;
(5)在直接以甲醇为燃料电池中,电解质溶液为酸性,负极的反应式为________、正极的反
应式为________。理想状态下,该燃料电池消耗 1mol 甲醇所能产生的最大电能为 702.1kj,
则该燃料电池的理论效率为________(燃料电池的理论效率是指电池所产生的最大电能
与燃料电池反应所能释放的全部能量之比)
28.(15 分)
氢化钙固体登山运动员常用的能源提供剂。某兴趣小组拟选用如下装置制备氢化钙。
请回答下列问题:
(1)请选择必要的装置,按气流方向连接顺序为________(填仪器接口的字母编号)
(2)根据完整的实验装置进行实验,实验步骤如下:检查装置气密性后,装入药品;打开分
液漏斗活塞_________(请按正确的顺序填入下列步骤的标号)。
A.加热反应一段时间
C.关闭分液漏斗活塞
B.收集气体并检验其纯度
D.停止加热,充分冷却
(3)实验结束后,某同学取少量产物,小心加入水中,观察到有气泡冒出,溶液中加入酚酞
后显红色,该同学据此断,上述实验确有 CaH2 生成。__________________
①写出 CaH2 与水反应的化学方程式 ___________________
②该同学的判断不正确,原因是_________________
(4)请你设计一个实验,用化学方法区分钙与氢化钙,写出实验简要步骤及观察到的现象
___________。
(5)登山运动员常用氢化钙作为能源提供剂,与氢气相比,其优点是____________。
29.(9 分)
在光照等适宜条件下,将培养在 CO2 浓度为 1%环境中的某植物迅速转移到 CO2 浓度为 0.003%
的环境中,其叶片暗反应中 C3 和 C5 化合物微摩尔浓度的变化趋势如下图。
�













 2023年江西萍乡中考道德与法治真题及答案.doc
2023年江西萍乡中考道德与法治真题及答案.doc 2012年重庆南川中考生物真题及答案.doc
2012年重庆南川中考生物真题及答案.doc 2013年江西师范大学地理学综合及文艺理论基础考研真题.doc
2013年江西师范大学地理学综合及文艺理论基础考研真题.doc 2020年四川甘孜小升初语文真题及答案I卷.doc
2020年四川甘孜小升初语文真题及答案I卷.doc 2020年注册岩土工程师专业基础考试真题及答案.doc
2020年注册岩土工程师专业基础考试真题及答案.doc 2023-2024学年福建省厦门市九年级上学期数学月考试题及答案.doc
2023-2024学年福建省厦门市九年级上学期数学月考试题及答案.doc 2021-2022学年辽宁省沈阳市大东区九年级上学期语文期末试题及答案.doc
2021-2022学年辽宁省沈阳市大东区九年级上学期语文期末试题及答案.doc 2022-2023学年北京东城区初三第一学期物理期末试卷及答案.doc
2022-2023学年北京东城区初三第一学期物理期末试卷及答案.doc 2018上半年江西教师资格初中地理学科知识与教学能力真题及答案.doc
2018上半年江西教师资格初中地理学科知识与教学能力真题及答案.doc 2012年河北国家公务员申论考试真题及答案-省级.doc
2012年河北国家公务员申论考试真题及答案-省级.doc 2020-2021学年江苏省扬州市江都区邵樊片九年级上学期数学第一次质量检测试题及答案.doc
2020-2021学年江苏省扬州市江都区邵樊片九年级上学期数学第一次质量检测试题及答案.doc 2022下半年黑龙江教师资格证中学综合素质真题及答案.doc
2022下半年黑龙江教师资格证中学综合素质真题及答案.doc