2021 年河北普通高中学业水平选择性考试化学真题及答案
注意事项:
1.答卷前,考生务必将自己的姓名、考生号、考场号、座位号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑.如需改动,用橡皮擦干
净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上。写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H-1
Li-7
B-11
C-12
O-16
Na-23
P-31
S-32
C1-35.5
K-39
Pb-207
一、单项选择题:本题共 9 小题,每小题 3 分,共 27 分。在每小题给出的四个选项中,只有一项是符合题
目要求的。
1. “灌钢法”是我国古代劳动人民对钢铁冶炼技术的重大贡献,陶弘景在其《本草经集注》中提到“钢铁
是杂炼生鍒作刀镰者”。“灌钢法”主要是将生铁和熟铁(含碳量约 0.1%)混合加热,生铁熔化灌入熟铁,
再锻打成钢。下列说法错误的是
A. 钢是以铁为主的含碳合金
B. 钢的含碳量越高,硬度和脆性越大
C. 生铁由于含碳量高,熔点比熟铁高
D. 冶炼铁的原料之一赤铁矿的主要成分为 Fe2O3
2. 高分子材料在生产生活中应用广泛。下列说法错误的是
A. 芦苇可用于制造黏胶纤维,其主要成分为纤维素
B. 聚氯乙烯通过加聚反应制得,可用于制作不粘锅的耐热涂层
C. 淀粉是相对分子质量可达几十万的天然高分子物质
D. 大豆蛋白纤维是一种可降解材料
3. 下列操作规范且能达到实验目的的是
A. 图甲测定醋酸浓度
B. 图乙测定中和热
�
C. 图丙稀释浓硫酸
D. 图丁萃取分离碘水中的碘
4. 硫和氮及其化合物对人类生存和社会发展意义重大,但硫氧化物和氮氧化物造成的环境问题也日益受到
关注,下列说法正确的是
A. NO2 和 SO2 均为红棕色且有刺激性气味的气体,是酸雨的主要成因
B. 汽车尾气中的主要大气污染物为 NO、SO2 和 PM2.5
C. 植物直接吸收利用空气中的 NO 和 NO2 作为肥料,实现氮的固定
D. 工业废气中的 SO2 可采用石灰法进行脱除
5. 用中子轰击 N
Z X 原子产生α粒子(即氮核 4
2 He)的核反应为: N
Z X+ 1
0 n→ 7
p Y+ 4
2 He。已知元素 Y 在化合物中呈
+1 价。下列说法正确的是
A. H3XO3 可用于中和溅在皮肤上的 NaOH 溶液
B. Y 单质在空气中燃烧的产物是 Y2O2
C. X 和氢元素形成离子化合物
D. 6Y 和 7Y 互 为 同素异形体
6. BiOCl 是一种具有珠光泽的材料,利用金属 Bi 制备 BiOCl 的工艺流程如图:
下列说法错误的是
A. 酸浸工序中分次加入稀 HNO3 可降低反应剧烈程度
B. 转化工序中加入稀 HCl 可抑制生成 BiONO3
C. 水解工序中加入少量 CH3COONa(s)可提高 Bi3+水解程度
D. 水解工序中加入少量 NH4NO3(s)有利于 BiOCl 的生成
7. NA 是阿伏加德罗常数的值,下列说法错误的是
A. 22.4L(标准状况)氟气所含的质子数为 18NA
B. 1mol 碘蒸气和 1mol 氢气在密闭容器中充分反应,生成的碘化氢分子数小于 2NA
C. 电解饱和食盐水时,若阴阳两极产生气体的总质量为 73g,则转移电子数为 NA
D. 1L1mol•L-1 溴化铵水溶液中 NH 4
与 H+离子数之和大于 NA
8. 苯并降冰片烯是一种重要的药物合成中间体,结构简式如图。关于该化合物,下列说法正确的是
�
A. 是苯的同系物
B. 分子中最多 8 个碳原子共平面
C. 一氯代物有 6 种(不考虑立体异构)
D. 分子中含有 4 个碳碳双键
9. K—O2 电池结构如图,a 和 b 为两个电极,其中之一为单质钾片。关于该电池,下列说法错误的是
A. 隔膜允许 K+通过,不允许 O2 通过
B. 放电时,电流由 b 电极沿导线流向 a 电极;充电时,b 电极为阳极
C. 产生 1Ah 电量时,生成 KO2 的质量与消耗 O2 的质量比值约为 2.22
D. 用此电池为铅酸蓄电池充电,消耗 3.9g 钾时,铅酸蓄电池消耗 0.9g 水
二、不定项选择题:本题共 4 小题,每小题 4 分,共 16 分。在每小题给出的四个选项中,有一项或两项符
合题目要求。若正确答案只包括一个选项,多选时,该小题得 0 分;若正确答案包括两个选项,只选一个
且正确的得 2 分,选两个且都正确的得 4 分,但只要选错一个,该小题得 0 分。
10. 关于非金属含氧酸及其盐的性质,下列说法正确的是
A. 浓 H2SO4 具有强吸水性,能吸收糖类化合物中的水分并使其炭化
B. NaClO、KClO3 等氯的含氧酸盐的氧化性会随溶液的 pH 减小而增强
C. 加热 NaI 与浓 H3PO4 混合物可制备 HI,说明 H3PO4 比 HI 酸性强
D. 浓 HNO3 和稀 HNO3 与 Cu 反应的还原产物分别为 NO2 和 NO,故稀 HNO3 氧化性更强
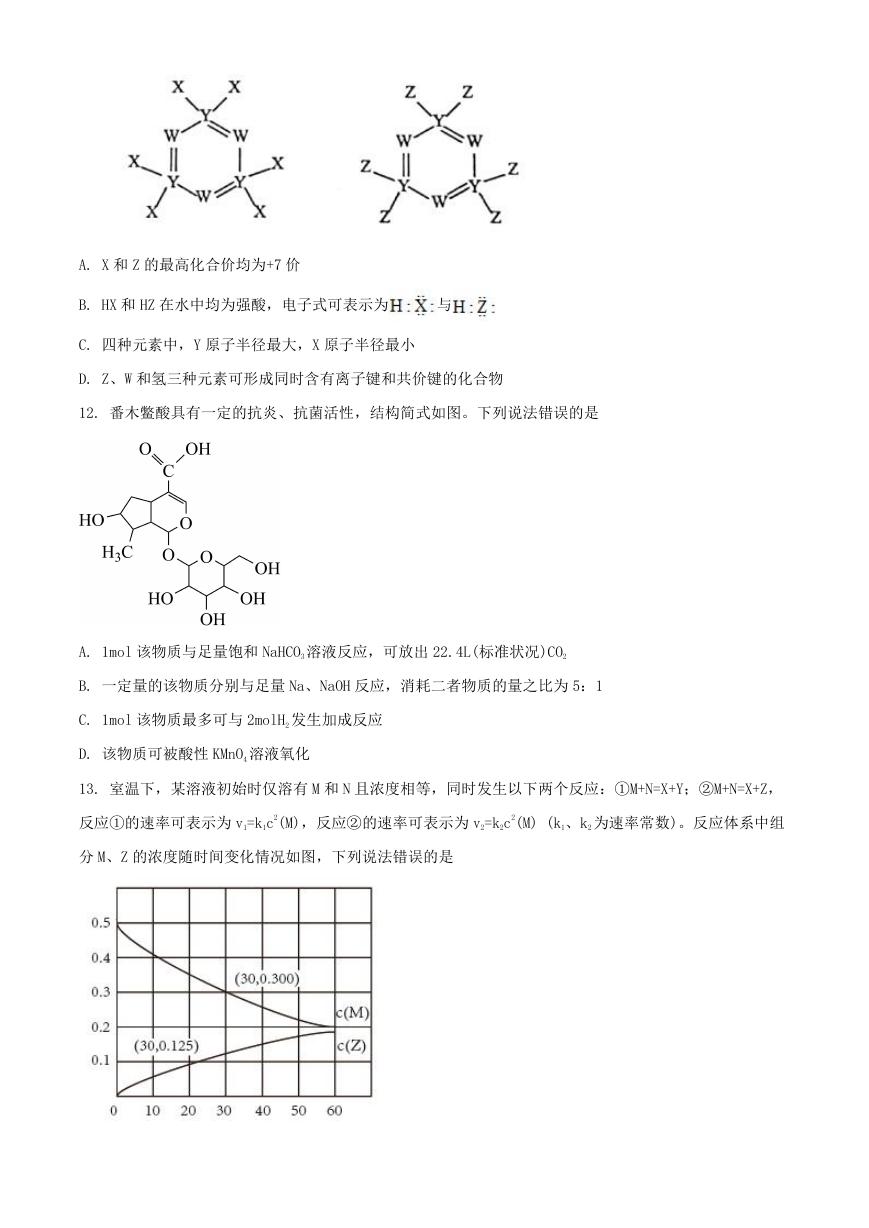
11. 如图所示的两种化合物可应用于阻燃材料和生物材料的合成。其中 W、X、Y、Z 为原子序数依次增大的
短周期元素,X 和 Z 同主族,Y 原子序数为 W 原子价电子数的 3 倍。下列说法正确的是
�
A. X 和 Z 的最高化合价均为+7 价
B. HX 和 HZ 在水中均为强酸,电子式可表示为
与
C. 四种元素中,Y 原子半径最大,X 原子半径最小
D. Z、W 和氢三种元素可形成同时含有离子键和共价键的化合物
12. 番木鳖酸具有一定的抗炎、抗菌活性,结构简式如图。下列说法错误的是
A. 1mol 该物质与足量饱和 NaHCO3 溶液反应,可放出 22.4L(标准状况)CO2
B. 一定量的该物质分别与足量 Na、NaOH 反应,消耗二者物质的量之比为 5:1
C. 1mol 该物质最多可与 2molH2 发生加成反应
D. 该物质可被酸性 KMnO4 溶液氧化
13. 室温下,某溶液初始时仅溶有 M 和 N 且浓度相等,同时发生以下两个反应:①M+N=X+Y;②M+N=X+Z,
反应①的速率可表示为 v1=k1c2(M),反应②的速率可表示为 v2=k2c2(M) (k1、k2 为速率常数)。反应体系中组
分 M、Z 的浓度随时间变化情况如图,下列说法错误的是
�
A. 0~30min 时间段内,Y 的平均反应速率为 6.67×10-8mol•L-1•min-1
B. 反应开始后,体系中 Y 和 Z 的浓度之比保持不变
C. 如果反应能进行到底,反应结束时 62.5%的 M 转化为 Z
D. 反应①的活化能比反应②的活化能大
三、非选择题:共 57 分,第 14~16 题为必考题,每个试题考生都必须作答。第 17~18 题为选考题,考生根
据要求作答。
14. 化工专家侯德榜发明的侯氏制碱法为我国纯碱工业和国民经济发展做出了重要贡献,某化学兴趣小组
在实验室中模拟并改进侯氏制碱法制备 NaHCO3,进一步处理得到产品 Na2CO3 和 NH4Cl,实验流程如图:
回答下列问题:
(1)从 A~E 中选择合适的仪器制备 NaHCO3,正确的连接顺序是___(按气流方向,用小写字母表示)。为使 A
中分液漏斗内的稀盐酸顺利滴下,可将分液漏斗上部的玻璃塞打开或___。
A.
B.
C.
D.
E.
(2)B 中使用雾化装置的优点是__。
(3)生成 NaHCO3 的总反应的化学方程式为___。
(4)反应完成后,将 B 中 U 形管内的混合物处理得到固体 NaHCO3 和滤液:
�
①对固体 NaHCO3 充分加热,产生的气体先通过足量浓硫酸,再通过足量 Na2O2,Na2O2 增重 0.14g,则固体 NaHCO3
的质量为___g。
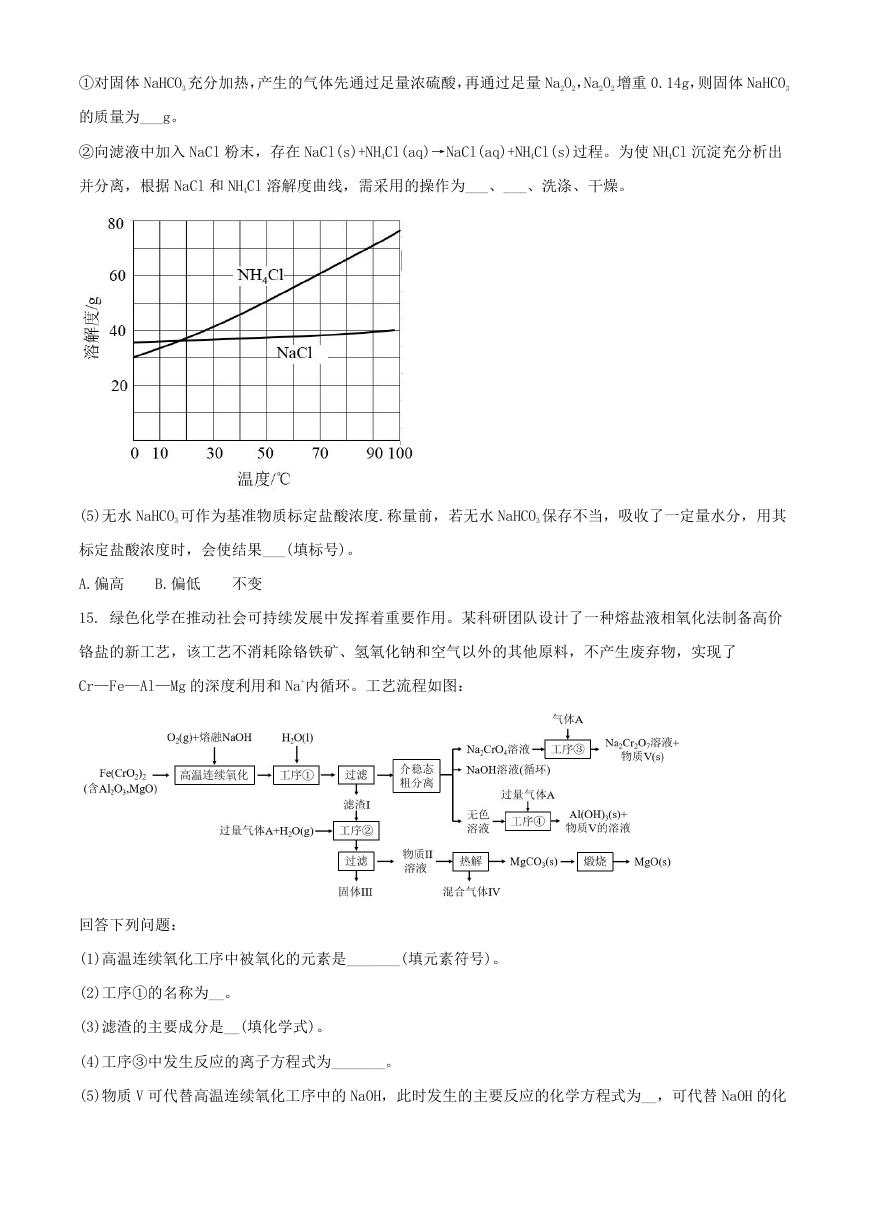
②向滤液中加入 NaCl 粉末,存在 NaCl(s)+NH4Cl(aq)→NaCl(aq)+NH4Cl(s)过程。为使 NH4Cl 沉淀充分析出
并分离,根据 NaCl 和 NH4Cl 溶解度曲线,需采用的操作为___、___、洗涤、干燥。
(5)无水 NaHCO3 可作为基准物质标定盐酸浓度.称量前,若无水 NaHCO3 保存不当,吸收了一定量水分,用其
标定盐酸浓度时,会使结果___(填标号)。
A.偏高
B.偏低
不变
15. 绿色化学在推动社会可持续发展中发挥着重要作用。某科研团队设计了一种熔盐液相氧化法制备高价
铬盐的新工艺,该工艺不消耗除铬铁矿、氢氧化钠和空气以外的其他原料,不产生废弃物,实现了
Cr—Fe—Al—Mg 的深度利用和 Na+内循环。工艺流程如图:
回答下列问题:
(1)高温连续氧化工序中被氧化的元素是_______(填元素符号)。
(2)工序①的名称为__。
(3)滤渣的主要成分是__(填化学式)。
(4)工序③中发生反应的离子方程式为_______。
(5)物质 V 可代替高温连续氧化工序中的 NaOH,此时发生的主要反应的化学方程式为__,可代替 NaOH 的化
�
学试剂还有_______(填化学式)。
(6)热解工序产生的混合气体最适宜返回工序_______(填“①”或“②”或“③”或“④”)参与内循环。
(7)工序④溶液中的铝元素恰好完全转化为沉淀的 pH 为__。(通常认为溶液中离子浓度小于 10-5mol•L-1 为沉
淀完全;A1(OH)3+OH-⇌Al(OH) 4
:K=100.63,Kw=10-14,Ksp[A1(OH)3]=10-33)
16. 当今,世界多国相继规划了碳达峰、碳中和的时间节点。因此,研发二氧化碳利用技术,降低空气中
二氧化碳含量成为研究热点。
(1)大气中的二氧化碳主要来自于煤、石油及其他含碳化合物的燃烧。已知 25℃时,相关物质的燃烧热数据
如表:
物质
H2(g)
C(石墨,s)
C6H6(l)
燃烧热△H(kJ•mol-1)
-285.8
-393.5
-3267.5
(1)则 25℃时 H2(g)和 C(石墨,s)生成 C6H6(l)的热化学方程式为________。
(2)雨水中含有来自大气的 CO2,溶于水中的 CO2 进一步和水反应,发生电离:
①CO2(g)=CO2(aq)
②CO2(aq)+H2O(l)=H+(aq)+HCO 3
(aq)
25℃时,反应②的平衡常数为 K2。
溶液中 CO2 的浓度与其在空气中的分压成正比(分压=总压×物质的量分数),比例系数为 ymol•L-1•kPa-1,当
大气压强为 pkPa,大气中 CO2(g)的物质的量分数为 x 时,溶液中 H+浓度为________mol•L-1(写出表达式,考
虑水的电离,忽略 HCO 3
的电离)
(3)105℃时,将足量的某碳酸氢盐(MHCO3)固体置于真空恒容容器中,存在如下平衡:
2MHCO3(s) Δ M2CO3(s)+H2O(g)+CO2(g)。上述反应达平衡时体系的总压为 46kPa。
保持温度不变,开始时在体系中先通入一定量的 CO2(g),再加入足量 MHCO3(s),欲使平衡时体系中水蒸气
的分压小于 5kPa,CO2(g)的初始压强应大于________kPa。
(4)我国科学家研究 Li—CO2 电池,取得了重大科研成果,回答下列问题:
①Li—CO2 电池中,Li 为单质锂片,则该电池中的 CO2 在___(填“正”或“负”)极发生电化学反应。研究表
明,该电池反应产物为碳酸锂和单质碳,且 CO2 电还原后与锂离子结合形成碳酸锂按以下 4 个步骤进行,写
出步骤Ⅲ的离子方程式。
Ⅰ.2CO2+2e-=C2O 2
4
Ⅱ.C2O 2
4
=CO2+CO 2
2
Ⅲ.__________
Ⅳ.CO 2
3
+2Li+=Li2CO3
�
②研究表明,在电解质水溶液中,CO2 气体可被电化学还原。
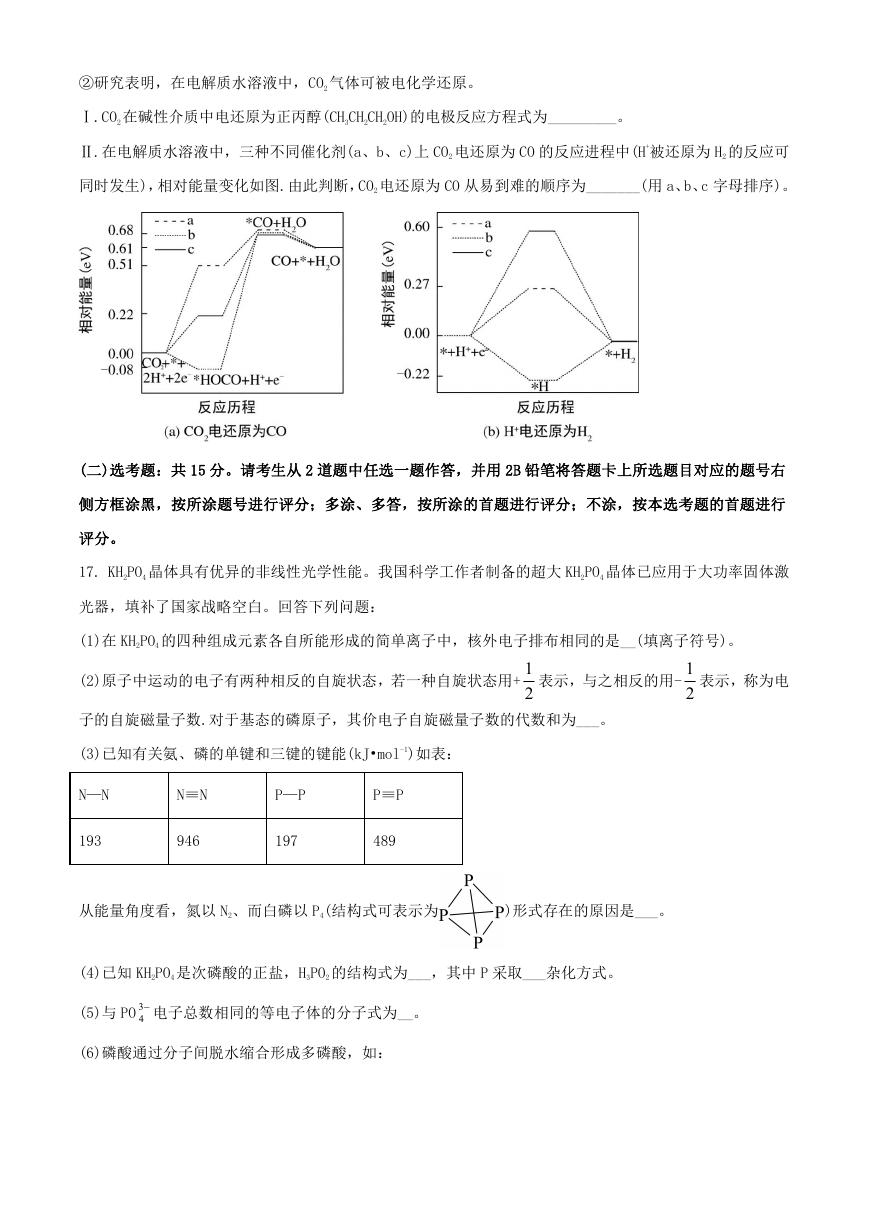
Ⅰ.CO2 在碱性介质中电还原为正丙醇(CH3CH2CH2OH)的电极反应方程式为_________。
Ⅱ.在电解质水溶液中,三种不同催化剂(a、b、c)上 CO2 电还原为 CO 的反应进程中(H+被还原为 H2 的反应可
同时发生),相对能量变化如图.由此判断,CO2 电还原为 CO 从易到难的顺序为_______(用 a、b、c 字母排序)。
(二)选考题:共 15 分。请考生从 2 道题中任选一题作答,并用 2B 铅笔将答题卡上所选题目对应的题号右
侧方框涂黑,按所涂题号进行评分;多涂、多答,按所涂的首题进行评分;不涂,按本选考题的首题进行
评分。
17. KH2PO4 晶体具有优异的非线性光学性能。我国科学工作者制备的超大 KH2PO4 晶体已应用于大功率固体激
光器,填补了国家战略空白。回答下列问题:
(1)在 KH2PO4 的四种组成元素各自所能形成的简单离子中,核外电子排布相同的是__(填离子符号)。
(2)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用+
1
2
表示,与之相反的用-
1
2
表示,称为电
子的自旋磁量子数.对于基态的磷原子,其价电子自旋磁量子数的代数和为___。
(3)已知有关氨、磷的单键和三键的键能(kJ•mol-1)如表:
N—N
N≡N
P—P
P≡P
193
946
197
489
从能量角度看,氮以 N2、而白磷以 P4(结构式可表示为
)形式存在的原因是___。
(4)已知 KH2PO4 是次磷酸的正盐,H3PO2 的结构式为___,其中 P 采取___杂化方式。
(5)与 PO 3
电子总数相同的等电子体的分子式为__。
4
(6)磷酸通过分子间脱水缩合形成多磷酸,如:
�













 2023年江西萍乡中考道德与法治真题及答案.doc
2023年江西萍乡中考道德与法治真题及答案.doc 2012年重庆南川中考生物真题及答案.doc
2012年重庆南川中考生物真题及答案.doc 2013年江西师范大学地理学综合及文艺理论基础考研真题.doc
2013年江西师范大学地理学综合及文艺理论基础考研真题.doc 2020年四川甘孜小升初语文真题及答案I卷.doc
2020年四川甘孜小升初语文真题及答案I卷.doc 2020年注册岩土工程师专业基础考试真题及答案.doc
2020年注册岩土工程师专业基础考试真题及答案.doc 2023-2024学年福建省厦门市九年级上学期数学月考试题及答案.doc
2023-2024学年福建省厦门市九年级上学期数学月考试题及答案.doc 2021-2022学年辽宁省沈阳市大东区九年级上学期语文期末试题及答案.doc
2021-2022学年辽宁省沈阳市大东区九年级上学期语文期末试题及答案.doc 2022-2023学年北京东城区初三第一学期物理期末试卷及答案.doc
2022-2023学年北京东城区初三第一学期物理期末试卷及答案.doc 2018上半年江西教师资格初中地理学科知识与教学能力真题及答案.doc
2018上半年江西教师资格初中地理学科知识与教学能力真题及答案.doc 2012年河北国家公务员申论考试真题及答案-省级.doc
2012年河北国家公务员申论考试真题及答案-省级.doc 2020-2021学年江苏省扬州市江都区邵樊片九年级上学期数学第一次质量检测试题及答案.doc
2020-2021学年江苏省扬州市江都区邵樊片九年级上学期数学第一次质量检测试题及答案.doc 2022下半年黑龙江教师资格证中学综合素质真题及答案.doc
2022下半年黑龙江教师资格证中学综合素质真题及答案.doc