2021 年北京高考化学试题及答案
可能用到的相对原子质量:H1
C12
N14
O16
第一部分
本部分共 14 题,每题 3 分,共 42 分。在每题列出的四个选项中,选出最符合题目要求的
一项。
1.我国科研人员发现中药成分黄芩素能明显抑制新冠病毒的活性。下列关于黄芩素的说法
不正确...的是
A.分子中有 3 种官能团
B.能与 Na2CO3 溶液反应
C. 在空气中可发生氧化反应
D.能和 Br2 发生取代反应和加成反应
2.下列有关放射性核素氚( 3
1 H)的表述不正确...的是
A. 3
C. 3
1
1 H 原子核外电子数为 1
2H 与 H2 化学性质基本相同
B. 3
D. 3
1
1 H 原子核内中子数为 3
2H O 具有放射性
3.下列化学用语或图示表达不正确...的是
A.N2 的结构式:N≡N
B.Na+的结构示意图:
C.溴乙烷的分子模型:
D.CO2 的电子式:
4.下列性质的比较,不能用元素周期律解释的是
A.酸性:HClO4>H2SO3>H2SiO3
B.碱性:KOH>NaOH>LiOH
C.热稳定性:H2O>H2S>PH3
D.非金属性:F>O>N
5.实验室制备下列气体所选试剂、制备装置及收集方法均正确的是
气体
O2
试剂
KMnO4
制备装置
收集方法
a
d
A
学科 网(北 京)股 份有限 公司
�
B
C
D
H2
NO
CO2
Zn+稀 H2SO4
Cu+稀 HNO3
CaCO3+稀 H2SO4
b
b
b
e
c
c
6.室温下,1 体积的水能溶解约 40 体积的 SO2。用试管收集 SO2 后进行如下实验。对实验现
象的分析正确的是
A.试管内液面上升,证明 SO2 与水发生了反应
-
3HSO ,
2-
3SO
7.下列方程式不能准确解释相应实验现象的是
B.试管中剩余少量气体,是因为 SO2 的溶解已达饱和
-
3HSO⇌H++
C.取出试管中的溶液,立即滴入紫色石蕊试液,溶液显红色,原因是:SO2+H2O⇌H2SO3,
H2SO3⇌H++
A.酚酞滴入醋酸钠溶液中变为浅红色:CH3COO-+H2O⇌CH3COOH+OH-
D.取出试管中溶液,在空气中放置一段时间后 pH 下降,是由于 SO2 挥发
B.金属钠在空气中加热生成淡黄色固体:4Na+O2=2Na2O
C.铝溶于氢氧化钠溶液,有无色气体产生:2Al+2OH-+2H2O=2
2AlO +3H2↑
D.将二氧化硫通入氢硫酸中产生黄色沉淀:2H2S+ SO2=3S↓+2H2O
8.使用如图装置(搅拌装置略)探究溶液离子浓度变化,灯光变化不可能...出现“亮→暗(或
灭)→亮”现象的是
A
B
C
D
试剂 a
CuSO4
NH4HCO3
H2SO4
CH3COOH
试剂 b
Ba(OH)2
Ca(OH)2
Ba(OH)2
NH3·H2O
9.用电石(主要成分为 CaC2,含 CaS 和 Ca3P2 等)制取乙炔时,常用 CuSO4 溶液除去乙炔中
的杂质。反应为:
学科 网(北 京)股 份有限 公司
�
①H2S + CuSO4 =CuS↓+H2SO4
②24CuSO4+11PH3+12H2O=8Cu3P↓+3H3PO4+24H2SO4
下列分析不正确...的是
A.CaS、Ca3P2 发生水解反应的化学方程式:CaS+2H2O= H2S↑+ Ca(OH)2、
Ca3P2+6H2O=2PH3↑+3Ca(OH)2
B.不能依据反应①比较硫酸与氢硫酸的酸性强弱
C.反应②中每 24 mol CuSO4 氧化 11 mol PH3
D.用酸性 KMnO4 溶液验证乙炔还原性时,H2S 和 PH3 有干扰
10.NO2 和 N2O4 存在平衡:2NO2(g)⇌N2O4(g) ΔH<0。下列分析正确的是
A.1 mol 平衡混合气体中含 1 mol N 原子
B.断裂 2 mol NO2 中的共价键所需能量小于断裂 1 mol N2O4 中的共价键所需能量
C.恒温时,缩小容积,气体颜色变深,是平衡正向移动导致的
D.恒容时,水浴加热,由于平衡正向移动导致气体颜色变浅
11.可生物降解的高分子材料聚苯丙生(L)的结构片段如下图。
已知:R1COOH+R2COOH
+H2O
下列有关 L 的说法不正确...的是
A.制备 L 的单体分子中都有两个羧基
B.制备 L 的反应是缩聚反应
C.L 中的官能团是酯基和醚键
D.m、n、p和 q的大小对 L 的降解速率有影响
12.下列实验中,均产生白色沉淀。
下列分析不正确...的是
A.Na2CO3 与 NaHCO3 溶液中所含微粒种类相同
B.CaCl2 能促进 Na2CO3、NaHCO3 水解
学科 网(北 京)股 份有限 公司
�
C.Al2(SO4)3 能促进 Na2CO3、NaHCO3 水解
D.4 个实验中,溶液滴入后,试管中溶液 pH 均降低
13.有科学研究提出:锂电池负极材料(Li)由于生成 LiH 而不利于电池容量的保持。一定温
度下,利用足量重水(D2O)与含 LiH 的 Li 负极材料反应,通过测定 n(D2)/n(HD)可以获知
n(Li)/n(LiH)。
已知:①LiH+H2O=LiOH+H2↑
②2Li(s)+H2(g)⇌2LiH(s) ΔH<0
下列说法不正确...的是
A.可用质谱区分 D2 和 HD
B.Li 与 D2O 的反应:2Li+2D2O=2LiOD+D2↑
C.若 n(Li)/n(LiH)越大,则 n(D2)/n(HD)越小
D.80℃反应所得 n(D2)/n(HD)比 25℃反应所得 n(D2)/n(HD)大
14.丙烷经催化脱氢可制丙烯:C3H8 C3H6+H2。600℃,将一定浓度的 CO2 与固定浓度的 C3H8
通过含催化剂的恒容反应器,经相同时间,流出的 C3H6、CO 和 H2 浓度随初始 CO2 浓度的变
化关系如图。
已知:
①C3H8(g)+5O2(g)=3CO2(g)+4H2O(l) ΔH -2220 kJ·mol−1
②C3H6(g)+9/2O2(g)=3CO2(g)+3H2O(l) ΔH =-1926.1 kJ·mol−1
③H2(g)+1/2O2(g)=H2O(l) ΔH =-286 kJ·mol−1
下列说法不正确...的是
A.C3H8(g)=C3H6(g)+H2(g) ΔH =+124 kJ·mol−1
B.c(H2)和 c(C3H6)变化差异的原因:CO2+H2 CO+H2O
C.其他条件不变,投料比 c(C3H8)/c(CO2)越大,C3H8 转化率越大
D.若体系只有 C3H6、CO、H2 和 H2O 生成,则初始物质浓度 c0 与流出物质浓度 c之间一定存在:
3c0(C3H8)+c0(CO2)=c(CO)+c(CO2)+3c(C3H8)+3c(C3H6)
学科 网(北 京)股 份有限 公司
�
本部分共 5 题,共 58 分。
第二部分
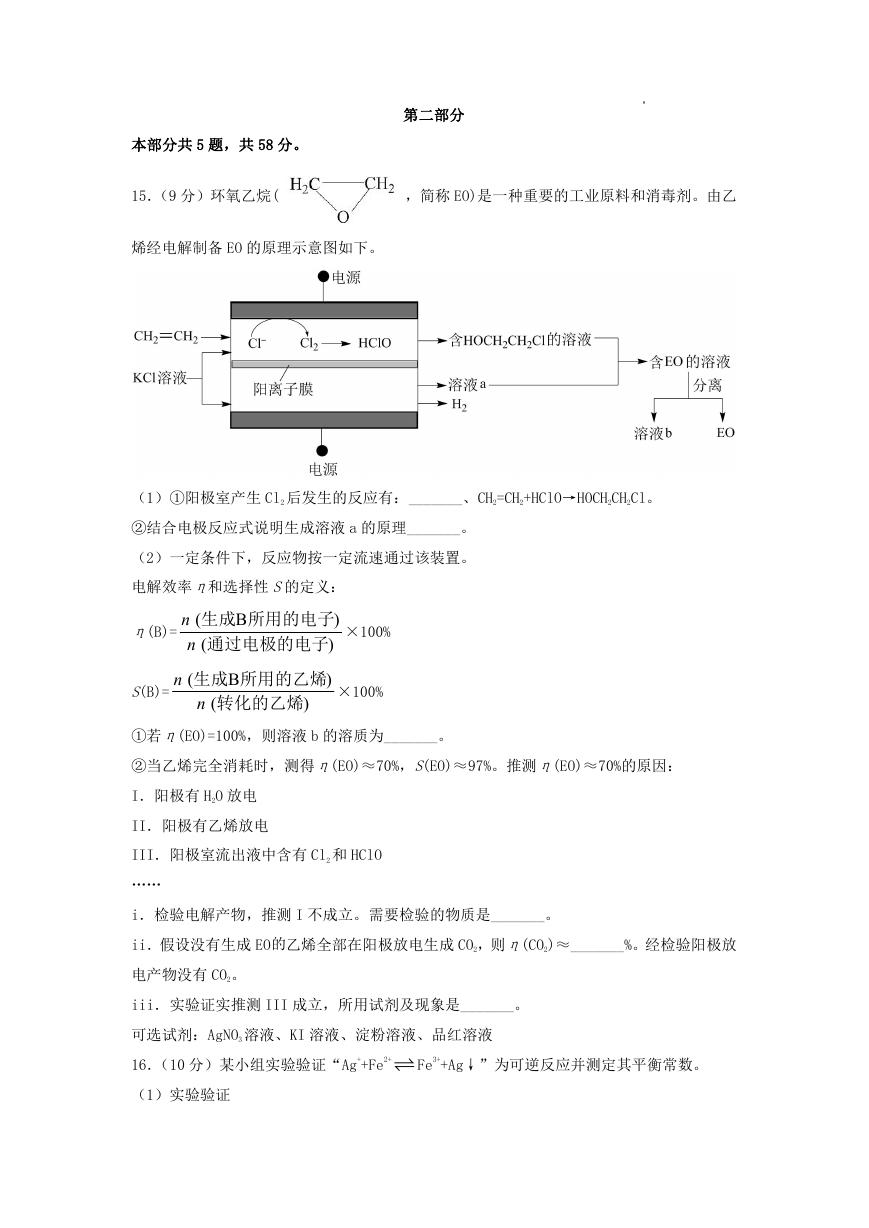
15.(9 分)环氧乙烷(
,简称 EO)是一种重要的工业原料和消毒剂。由乙
烯经电解制备 EO 的原理示意图如下。
(1)①阳极室产生 Cl2 后发生的反应有:_______、CH2=CH2+HClO→HOCH2CH2Cl。
②结合电极反应式说明生成溶液 a 的原理_______。
(2)一定条件下,反应物按一定流速通过该装置。
电解效率η和选择性 S的定义:
η(B)=
n
S(B)=
B
)
(
n
生成 所用的电子
)
(
n
通过电极的电子
)
(
生成 所用的乙烯
n
B
)
(
转化的乙烯
×100%
×100%
①若η(EO)=100%,则溶液 b 的溶质为_______。
②当乙烯完全消耗时,测得η(EO)≈70%,S(EO)≈97%。推测η(EO)≈70%的原因:
I.阳极有 H2O 放电
II.阳极有乙烯放电
III.阳极室流出液中含有 Cl2 和 HClO
……
i.检验电解产物,推测 I 不成立。需要检验的物质是_______。
ii.假设没有生成 EO的乙烯全部在阳极放电生成 CO2,则η(CO2)≈_______%。经检验阳极放
电产物没有 CO2。
iii.实验证实推测 III 成立,所用试剂及现象是_______。
可选试剂:AgNO3 溶液、KI 溶液、淀粉溶液、品红溶液
16.(10 分)某小组实验验证“Ag++Fe2+ Fe3++Ag↓”为可逆反应并测定其平衡常数。
(1)实验验证
学科 网(北 京)股 份有限 公司
�
实验 I.将 0.0100 mol·L−1 Ag2SO4 溶液与 0.0400 mol·L−1 FeSO4 溶液(pH=1)等体积混合,
产生灰黑色沉淀,溶液呈黄色。
实验 II.向少量 Ag 粉中加入 0.0100 mol·L−1Fe2(SO4)3 溶液(pH=1),固体完全溶解。
①取 I 中沉淀,加入浓硝酸,证实沉淀为 Ag。现象是_______。
②II 中溶液选用 Fe2(SO4)3,不选用 Fe(NO3)3 的原因是_______。
综合上述实验,证实“Ag++Fe2+ Fe3++Ag↓”为可逆反应。
③小组同学采用电化学装置从平衡移动角度进行验证。补全电化学装置示意图,写出操作及
现象_______。
(2)测定平衡常数
实验Ⅲ.一定温度下,待实验Ⅰ中反应达到平衡状态时,取 v mL 上层清液,用 c1 mol·L−1
KSCN 标准溶液滴定 Ag+,至出现稳定的浅红色时消耗 KSCN 标准溶液 v1 mL。
资料:Ag++SCN- AgSCN↓(白色) K=1012
Fe3++SCN- FeSCN2+(红色) K=102.3
①滴定过程中 Fe3+的作用是_______。
②测得平衡常数 K=_______。
(3)思考问题
①取实验 I 的浊液测定 c(Ag+),会使所测 K值_______(填“偏高”“偏低”或“不受影
响”)。
②不用实验 II 中清液测定 K的原因是_______。
17.(14 分)治疗抑郁症的药物帕罗西汀的合成路线如下。
学科 网(北 京)股 份有限 公司
�
已知:
i.R1CHO+CH2(COOH)2 +
①吡啶,Δ
②H
R1CH=CHCOOH
ii.R2OH
CH SO Cl
三乙胺
3
2
3R OH
NaH R2OR3
(1)A 分子含有的官能团是_______。
(2)已知:B 为反式结构。下列有关 B 的说法正确的是(填序号)_______。
a.核磁共振氢谱有 5 组峰
b.能使酸性 KMnO4 溶液褪色
c.存在 2 个六元环的酯类同分异构体
d.存在含苯环和碳碳三键的羧酸类同分异构体
(3)E→G 的化学方程式是_______。
(4)J 分子中有 3 个官能团,包括 1 个酯基。J 的结构简式是_______。
(5)L 的分子式为 C7H6O3。L 的结构简式是_______。
(6)从黄樟素经过其同分异构体 N 可制备 L。
已知:
i.R1CH=CHR2
ii.
3
①
O
Zn H O
② ,
2
R1CHO+R2CHO
写出制备 L 时中间产物 N、P、Q 的结构简式:_______、_______、_______。
18.(12 分)铁黄是一种重要的化工产品。由生产钛白粉废渣制备铁黄的过程如下。
资料:
i.钛白粉废渣成分:主要为 FeSO4·H2O,含少量 TiOSO4 和不溶物
学科 网(北 京)股 份有限 公司
�
ii.TiOSO4+(x+1)H2O⇌TiO2·xH2O↓+H2SO4
iii.0.1 mol·L−1 Fe2+生成 Fe(OH)2,开始沉淀时 pH=6.3,完全沉淀时 pH=8.3
0.1 mol·L−1 Fe3+生成 FeOOH,开始沉淀时 pH=1.5,完全沉淀时 pH=2.8
(1)纯化
①加入过量铁粉的目的是_______。
②充分反应后,分离混合物的方法是_______。
(2)制备晶种
为制备高品质铁黄产品,需先制备少量铁黄晶种。过程及现象是:向一定浓度 FeSO4 溶液中
加入氨水,产生白色沉淀,并很快变成灰绿色。滴加氨水至 pH 为 6.0 时开始通空气并记录
pH 变化(如下图)。
①产生白色沉淀的离子方程式是_______。
②产生白色沉淀后的 pH 低于资料 iii 中的 6.3。原因是:沉淀生成后 c(Fe2+)_______0.1
mol·L−1(填“>”“=”或“<”)。
③0-t1 时段,pH 几乎不变;t1-t2 时段,pH 明显降低。结合方程式解释原因:_______。
④pH≈4 时制得铁黄晶种。若继续通入空气,t3 后 pH 几乎不变,此时溶液中 c(Fe2+)仍降低,
但 c(Fe3+)增加,且 c(Fe2+)降低量大于 c(Fe3+)增加量。结合总方程式说明原因:_______。
(3)产品纯度测定
铁黄纯度可以通过产品的耗酸量确定。
H SO
2
W g 铁黄
4
标准溶液
加热溶解
溶液 b
Na C O 溶液
2 2 4
溶液 c
NaOH
标准溶液
酚酞
滴定
资料:Fe3++3
2-
4C O =Fe(C2O4) 3-
2
3 ,Fe(C2O4) 3-
3 不与稀碱液反应
Na2C2O4 过量,会使测定结果_______(填“偏大”“偏小”或“不受影响”)。
19.(13 分)某小组探究卤素参与的氧化还原反应,从电极反应角度分析物质氧化性和还原
性的变化规律。
(1)浓盐酸与 MnO2 混合加热生成氯气。氯气不再逸出时,固液混合物 A 中仍存在盐酸和 MnO2。
学科 网(北 京)股 份有限 公司
�















 2023年江西萍乡中考道德与法治真题及答案.doc
2023年江西萍乡中考道德与法治真题及答案.doc 2012年重庆南川中考生物真题及答案.doc
2012年重庆南川中考生物真题及答案.doc 2013年江西师范大学地理学综合及文艺理论基础考研真题.doc
2013年江西师范大学地理学综合及文艺理论基础考研真题.doc 2020年四川甘孜小升初语文真题及答案I卷.doc
2020年四川甘孜小升初语文真题及答案I卷.doc 2020年注册岩土工程师专业基础考试真题及答案.doc
2020年注册岩土工程师专业基础考试真题及答案.doc 2023-2024学年福建省厦门市九年级上学期数学月考试题及答案.doc
2023-2024学年福建省厦门市九年级上学期数学月考试题及答案.doc 2021-2022学年辽宁省沈阳市大东区九年级上学期语文期末试题及答案.doc
2021-2022学年辽宁省沈阳市大东区九年级上学期语文期末试题及答案.doc 2022-2023学年北京东城区初三第一学期物理期末试卷及答案.doc
2022-2023学年北京东城区初三第一学期物理期末试卷及答案.doc 2018上半年江西教师资格初中地理学科知识与教学能力真题及答案.doc
2018上半年江西教师资格初中地理学科知识与教学能力真题及答案.doc 2012年河北国家公务员申论考试真题及答案-省级.doc
2012年河北国家公务员申论考试真题及答案-省级.doc 2020-2021学年江苏省扬州市江都区邵樊片九年级上学期数学第一次质量检测试题及答案.doc
2020-2021学年江苏省扬州市江都区邵樊片九年级上学期数学第一次质量检测试题及答案.doc 2022下半年黑龙江教师资格证中学综合素质真题及答案.doc
2022下半年黑龙江教师资格证中学综合素质真题及答案.doc