2023 年四川高考化学真题及答案
可能用到的相对原子质量:F 19
Al 27
一、选择题:本题共 13 小题,每小题 6 分,共 78 分。在每小题给出的四个选项中,只有一项是符合题目
要求的。(化学部分为第 7~13 题)
1. 化学与生活密切相关,下列说法正确的是
A. 苯甲酸钠可作为食品防腐剂是由于其具有酸性
B. 豆浆能产生丁达尔效应是由于胶体粒子对光线的散射
C. SO2 可用于丝织品漂白是由于其能氧化丝织品中有色成分
D. 维生素 C 可用作水果罐头的抗氧化剂是由于其难以被氧化
2. 藿香蓟具有清热解毒功效,其有效成分结构如下。下列有关该物质的说法错误的是
A. 可以发生水解反应
B. 所有碳原子处于同一平面
C. 含有 2 种含氧官能团
D. 能与溴水发生加成反应
3. 实验室将粗盐提纯并配制
0.1000mol L
1
的 NaCl 溶液。下列仪器中,本实验必须用到的有
①天平 ②温度计 ③坩埚 ④分液漏斗 ⑤容量瓶 ⑥烧杯 ⑦滴定管 ⑧酒精灯
A. ①②④⑥
B. ①④⑤⑥
C. ②③⑦⑧
D. ①⑤⑥⑧
4.
AN 为阿伏伽德罗常数的值。下列叙述正确的是
A. 0.50mol 异丁烷分子中共价键的数目为
6.5N
A
B. 标准状况下,
2.24LSO 中电子的数目为
3
4.00N
A
C. 1.0LpH 2 的 2
H SO 溶液中 H 的数目为
4
0.02N
A
D.
1.0L1.0mol L 的 2
Na CO 溶液中 2
3CO 的数目为
1
3
1.0N
A
5. W、X、Y、Z 为短周期主族元素,原子序数依次增大,最外层电子数之和为 19。Y 的最外层电子数与其 K
层电子数相等,WX2 是形成酸雨的物质之一。下列说法正确的是
A. 原子半径: X W
C. Y 与 X 可形成离子化合物
B. 简单氢化物的沸点: X Z
D. Z 的最高价含氧酸是弱酸
�
6. 用可再生能源电还原 2CO 时,采用高浓度的 K 抑制酸性电解液中的析氢反应来提高多碳产物(乙烯、乙
醇等)的生成率,装置如下图所示。下列说法正确的是
A. 析氢反应发生在 IrO Ti
x 电极上
B. Cl 从 Cu 电极迁移到 IrO Ti
x 电极
C. 阴极发生的反应有:
2CO 12H 12e
2
C H 4H O
2
4
2
D. 每转移1mol 电子,阳极生成11.2L 气体(标准状况)
7. 下图为
Cu(OH) 在水中达沉淀溶解平衡时的 pM pH 关系图
2
3
和
、
Fe(OH) Al(OH)
1
;
c
3
pM lg M / mol L
c
(
M 10 mol L
可认为 M 离子沉淀完全)。下列叙述正确的是
5
1
A. 由 a 点可求得
K
sp
Fe(OH)
3
8.5
10
B. pH 4 时
Al(OH) 的溶解度为
3
10
10 mol L
3
1
C. 浓度均为
0.01mol L
的 3Al 和 3Fe 可通过分步沉淀进行分离
1
�
D.
Al
3
、 混合溶液中
c
Cu
2
Cu
2
1
0.2mol L
时二者不会同时沉淀
二、非选择题:本题共 4 小题,共 58 分。(必做题:26~28 题,选做题:35~36 题)
8.
BaTiO 是一种压电材料。以
3
BaSO 为原料,采用下列路线可制备粉状
4
BaTiO 。
3
回答下列问题:
(1)“焙烧”步骤中碳粉的主要作用是_______。
(2)“焙烧”后固体产物有
BaCl 、易溶于水的 BaS 和微溶于水的 CaS 。“浸取”时主要反应的离子方
2
程式为_______。
(3)“酸化”步骤应选用的酸是_______(填标号)。
a.稀硫酸
b.浓硫酸
c.盐酸
d.磷酸
(4)如果焙烧后的产物直接用酸浸取,是否可行?_______,其原因是_______。
(5)“沉淀”步骤中生成
BaTiO C O 的化学方程式为_______。
2
4 2
(6)“热分解”生成粉状钛酸钡,产生的
n
2CO
CO:
n
=
_______。
9. 钴配合物
Co NH
3
Cl
溶于热水,在冷水中微溶,可通过如下反应制备:
3
6
2CoCl
2
2NH Cl 10NH H O
3
2
4
活性炭
2
2 Co NH
6
Cl
3
3
2H O
2
。
具体步骤如下:
Ⅰ.称取
2.0gNH Cl ,用5mL 水溶解。
4
Ⅱ.分批加入
3.0gCoCl 6H O
2
2
后,将溶液温度降至10℃以下,加入1g 活性炭、7mL 浓氨水,搅拌下逐
滴加入10mL6% 的双氧水。
Ⅲ.加热至 55 ~ 60℃反应 20min 。冷却,过滤。
Ⅳ.将滤得的固体转入含有少量盐酸的 25mL 沸水中,趁热过滤。
Ⅴ.滤液转入烧杯,加入 4mL 浓盐酸,冷却、过滤、干燥,得到橙黄色晶体。
回答下列问题:
(1)步骤Ⅰ中使用的部分仪器如下。
�
仪器 a 的名称是_______。加快 NH4Cl 溶解的操作有_______。
(2)步骤Ⅱ中,将温度降至 10℃以下以避免_______、_______;可选用_______降低溶液温度。
(3)指出下列过滤操作中不规范之处:_______。
(4)步骤Ⅳ中,趁热过滤,除掉的不溶物主要为_______。
(5)步骤Ⅴ中加入浓盐酸的目的是_______。
10. 甲烷选择性氧化制备甲醇是一种原子利用率高的方法。回答下列问题:
(1)已知下列反应的热化学方程式:
①
3O g
2
2O g
3
1K
1Δ
H
285kJ mol
1
②
2CH g O g
2
4
2CH OH l
3
2K
2Δ
H
329kJ mol
1
反应③
CH g O g
3
4
CH OH l O g
3
2
的 3ΔH _______
kJ mol
1
,平衡常数 3K _______(用
K K、 表示)。
1
2
(2)电喷雾电离等方法得到的M ( Fe Co Ni
、 、 等)与 3O 反应可得 MO 。MO 与 4CH 反应能高选择
性地生成甲醇。分别在300K 和 310K 下(其他反应条件相同)进行反应
MO CH M CH OH
4
3
,结
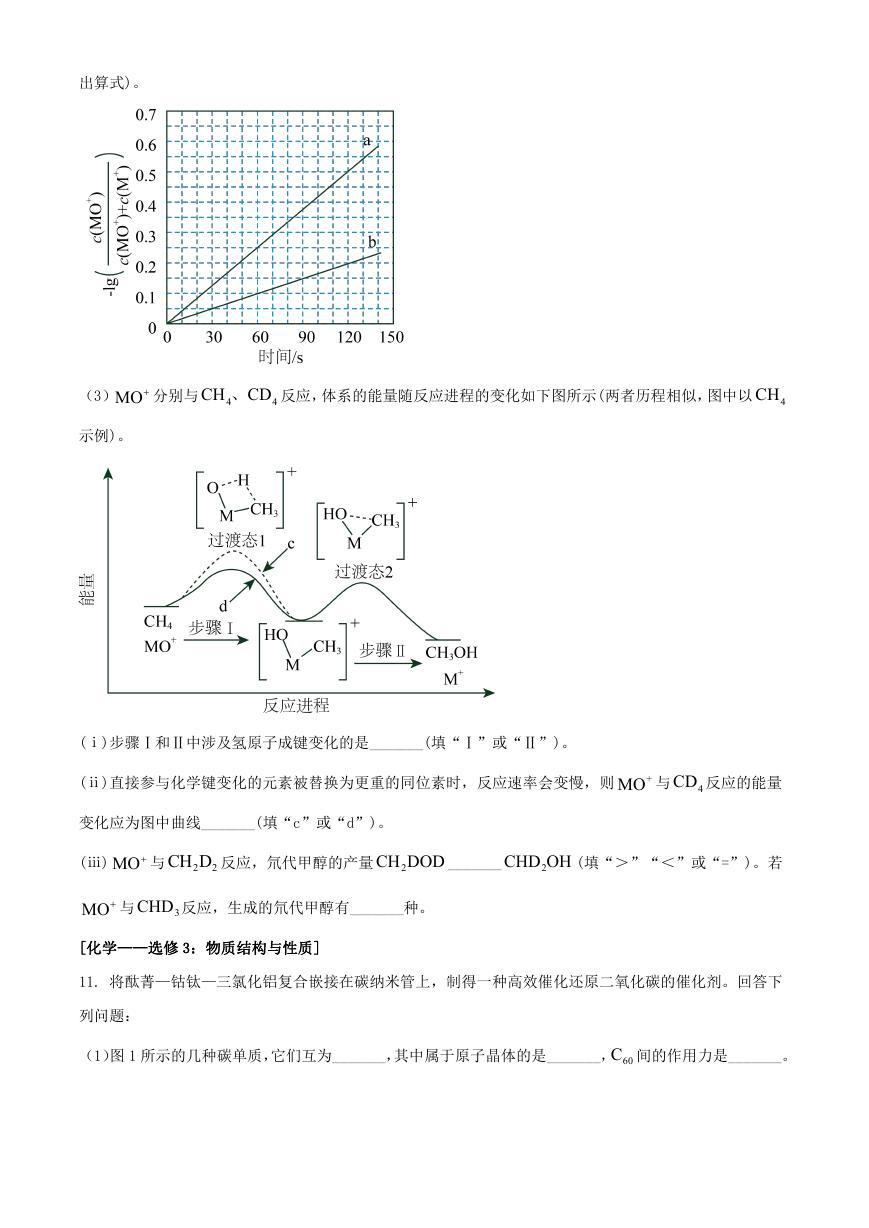
果如下图所示。图中300K 的曲线是_______(填“a”或“b”。300K 、60s 时 MO 的转化率为_______(列
�
出算式)。
(3)MO 分别与 4
CH CD、 反应,体系的能量随反应进程的变化如下图所示(两者历程相似,图中以 4CH
4
示例)。
(ⅰ)步骤Ⅰ和Ⅱ中涉及氢原子成键变化的是_______(填“Ⅰ”或“Ⅱ”)。
(ⅱ)直接参与化学键变化的元素被替换为更重的同位素时,反应速率会变慢,则
+MO 与 4CD 反应的能量
变化应为图中曲线_______(填“c”或“d”)。
(ⅲ) MO 与 2
CH D 反应,氘代甲醇的产量 2CH DOD _______
2
CHD OH (填“>”“<”或“=”)。若
2
MO 与
CHD 反应,生成的氘代甲醇有_______种。
3
[化学——选修 3:物质结构与性质]
11. 将酞菁—钴钛—三氯化铝复合嵌接在碳纳米管上,制得一种高效催化还原二氧化碳的催化剂。回答下
列问题:
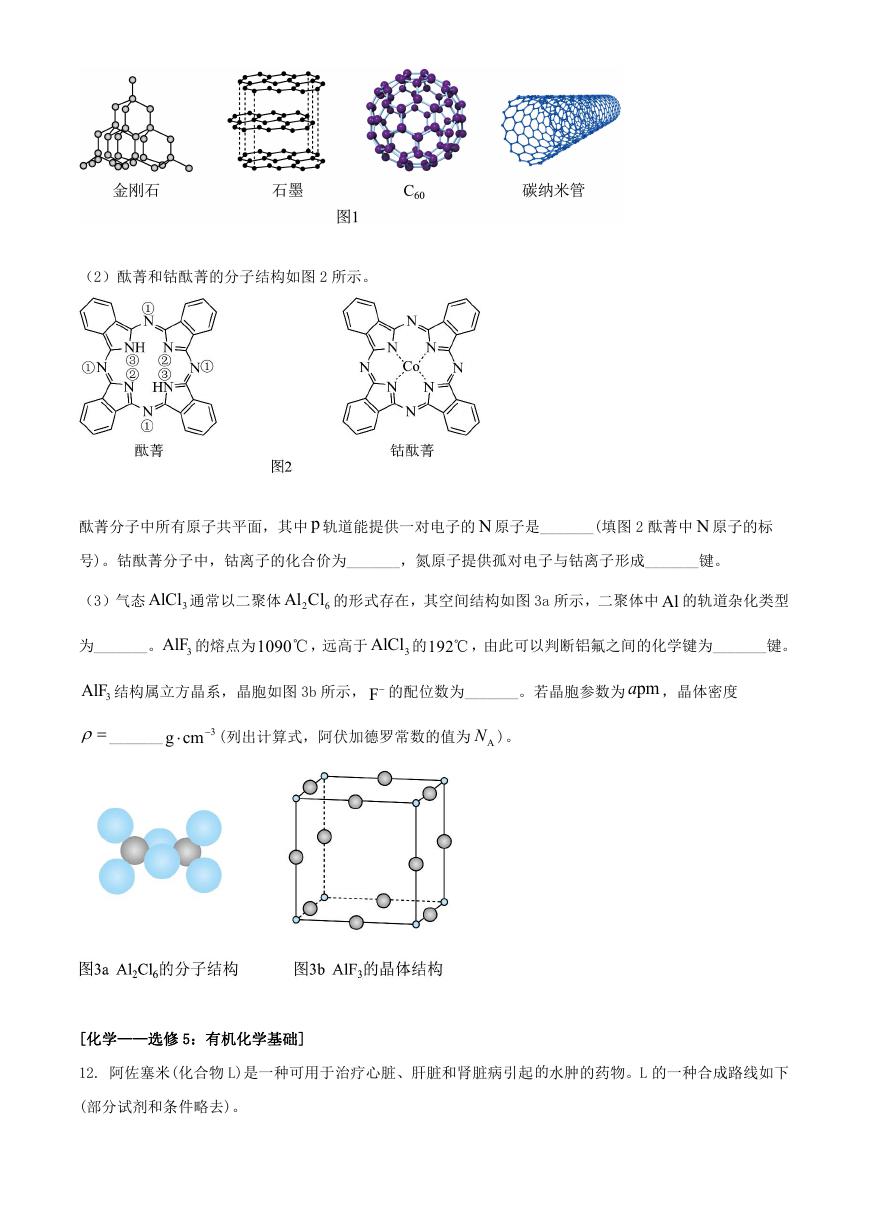
(1)图 1 所示的几种碳单质,它们互为_______,其中属于原子晶体的是_______, 60C 间的作用力是_______。
�
(2)酞菁和钴酞菁的分子结构如图 2 所示。
酞菁分子中所有原子共平面,其中 p 轨道能提供一对电子的 N 原子是_______(填图 2 酞菁中 N 原子的标
号)。钴酞菁分子中,钴离子的化合价为_______,氮原子提供孤对电子与钴离子形成_______键。
(3)气态
3AlCl 通常以二聚体 2
Al Cl 的形式存在,其空间结构如图 3a 所示,二聚体中 Al 的轨道杂化类型
6
为_______。 3AlF 的熔点为1090℃,远高于
3AlCl 的192℃,由此可以判断铝氟之间的化学键为_______键。
3AlF 结构属立方晶系,晶胞如图 3b 所示, F 的配位数为_______。若晶胞参数为 pma ,晶体密度
_______
g cm
3
(列出计算式,阿伏加德罗常数的值为 AN )。
[化学——选修 5:有机化学基础]
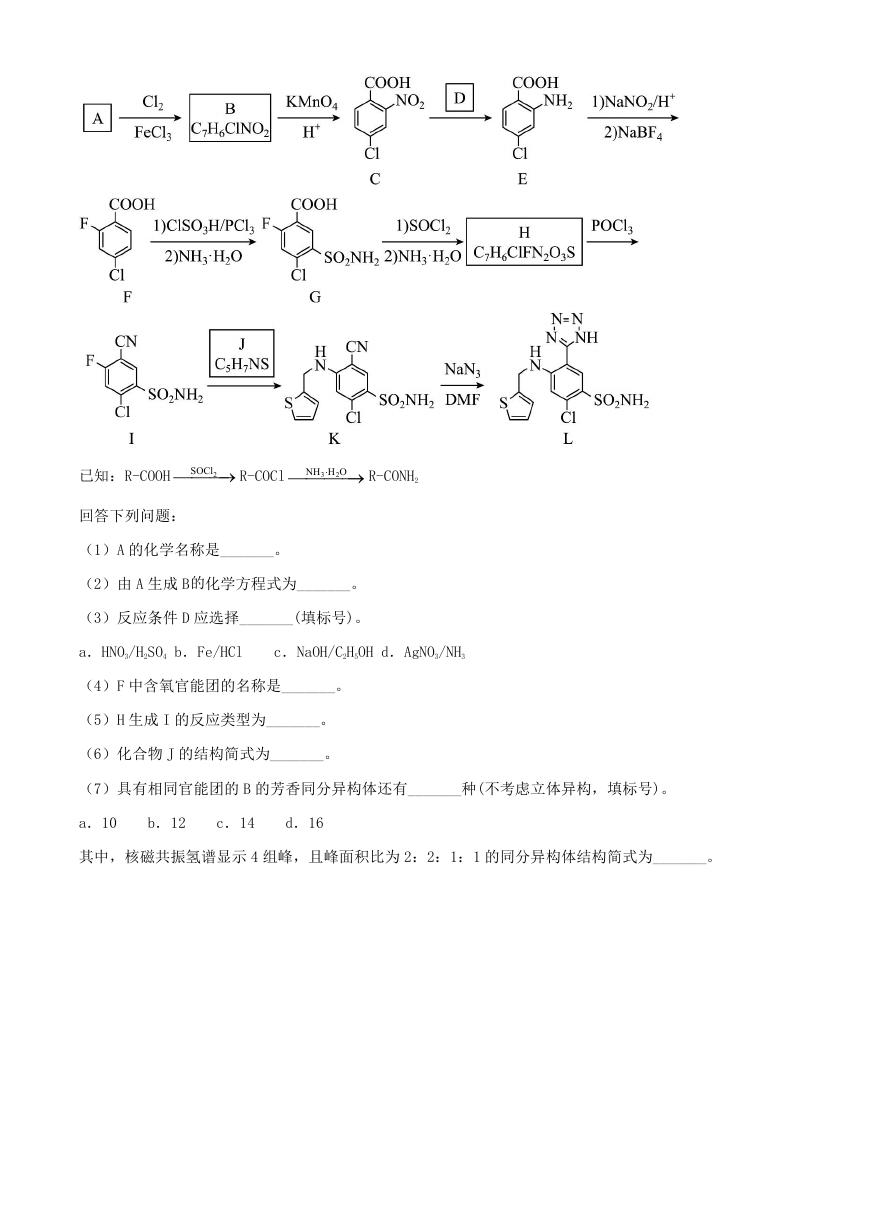
12. 阿佐塞米(化合物 L)是一种可用于治疗心脏、肝脏和肾脏病引起的水肿的药物。L 的一种合成路线如下
(部分试剂和条件略去)。
�
NH H O R-CONH2
3
2
已知:R-COOH
SOCl R-COCl
2
回答下列问题:
(1)A 的化学名称是_______。
(2)由 A 生成 B的化学方程式为_______。
(3)反应条件 D 应选择_______(填标号)。
a.HNO3/H2SO4 b.Fe/HCl
c.NaOH/C2H5OH d.AgNO3/NH3
(4)F 中含氧官能团的名称是_______。
(5)H 生成 I 的反应类型为_______。
(6)化合物 J 的结构简式为_______。
(7)具有相同官能团的 B 的芳香同分异构体还有_______种(不考虑立体异构,填标号)。
a.10
b.12
c.14
d.16
其中,核磁共振氢谱显示 4 组峰,且峰面积比为 2:2:1:1 的同分异构体结构简式为_______。
�
可能用到的相对原子质量:F 19
Al 27
理科综合能力测试化学部分(解析)
一、选择题:本题共 13 小题,每小题 6 分,共 78 分。在每小题给出的四个选项中,只有
一项是符合题目要求的。(化学部分为第 7~13 题)
1. 化学与生活密切相关,下列说法正确的是
A. 苯甲酸钠可作为食品防腐剂是由于其具有酸性
B. 豆浆能产生丁达尔效应是由于胶体粒子对光线的散射
C. SO2 可用于丝织品漂白是由于其能氧化丝织品中有色成分
D. 维生素 C 可用作水果罐头的抗氧化剂是由于其难以被氧化
【答案】B
【解析】
【详解】A.苯甲酸钠属于强碱弱酸盐,其水溶液呈碱性,因此,其可作为食品防腐剂不是
由于其具有酸性,A 说法不正确;
B.胶体具有丁达尔效应,是因为胶体粒子对光线发生了散射;豆浆属于胶体,因此,其能
产生丁达尔效应是由于胶体粒子对光线的散射,B 说法正确;
C. 2SO 可用于丝织品漂白是由于其能与丝织品中有色成分化合为不稳定的无色物质,C 说
法不正确;
D.维生素 C 具有很强的还原性,因此,其可用作水果罐头的抗氧化剂是由于其容易被氧气
氧化,从而防止水果被氧化,D 说法不正确;
综上所述,本题选 B。
2. 藿香蓟具有清热解毒功效,其有效成分结构如下。下列有关该物质的说法错误的是
A. 可以发生水解反应
C. 含有 2 种含氧官能团
【答案】B
【解析】
B. 所有碳原子处于同一平面
D. 能与溴水发生加成反应
【详解】A.藿香蓟的分子结构中含有酯基,因此其可以发生水解反应,A 说法正确;
B.藿香蓟的分子结构中的右侧有一个饱和碳原子连接着两个甲基,类比甲烷分子的空间构
型可知,藿香蓟分子中所有碳原子不可能处于同一平面,B 说法错误;
�













 2023年江西萍乡中考道德与法治真题及答案.doc
2023年江西萍乡中考道德与法治真题及答案.doc 2012年重庆南川中考生物真题及答案.doc
2012年重庆南川中考生物真题及答案.doc 2013年江西师范大学地理学综合及文艺理论基础考研真题.doc
2013年江西师范大学地理学综合及文艺理论基础考研真题.doc 2020年四川甘孜小升初语文真题及答案I卷.doc
2020年四川甘孜小升初语文真题及答案I卷.doc 2020年注册岩土工程师专业基础考试真题及答案.doc
2020年注册岩土工程师专业基础考试真题及答案.doc 2023-2024学年福建省厦门市九年级上学期数学月考试题及答案.doc
2023-2024学年福建省厦门市九年级上学期数学月考试题及答案.doc 2021-2022学年辽宁省沈阳市大东区九年级上学期语文期末试题及答案.doc
2021-2022学年辽宁省沈阳市大东区九年级上学期语文期末试题及答案.doc 2022-2023学年北京东城区初三第一学期物理期末试卷及答案.doc
2022-2023学年北京东城区初三第一学期物理期末试卷及答案.doc 2018上半年江西教师资格初中地理学科知识与教学能力真题及答案.doc
2018上半年江西教师资格初中地理学科知识与教学能力真题及答案.doc 2012年河北国家公务员申论考试真题及答案-省级.doc
2012年河北国家公务员申论考试真题及答案-省级.doc 2020-2021学年江苏省扬州市江都区邵樊片九年级上学期数学第一次质量检测试题及答案.doc
2020-2021学年江苏省扬州市江都区邵樊片九年级上学期数学第一次质量检测试题及答案.doc 2022下半年黑龙江教师资格证中学综合素质真题及答案.doc
2022下半年黑龙江教师资格证中学综合素质真题及答案.doc