中国科技论文在线
http://www.paper.edu.cn
钯催化的 C−H 活化合成富勒烯螺茚
周典兵,王官武**
(中国科学技术大学化学系,安徽合肥,230026)
5 摘要:钯催化的[60]富勒烯与 2-芳基 1,3-环己二酮反应合成了新颖的富勒烯螺茚产物,该反
应涉及到芳基的 sp2 C−H 活化和烷基的 sp3 C−H 官能团化。反应底物兼容性好,一系列不
同的 2-芳基 1,3-环己二酮都能很好地参与反应。我们也提出了一个钯催化的烯醇导向的 C−H
活化环化机理。
关键词:富勒烯; 钯催化; 碳氢键活化; 2-芳基 1,3-环己二酮
中图分类号:O625.4
10
Synthesis of [60]Fullerene-Fused Spiroindanes via
Palladium-Catalyzed C−H Activation
(Department of Chemistry, University of Science and Technology of China, Hefei, Anhui 230026,
ZHOU Dianbing, WANG Guanwu
15
20
P. R. China)
Abstract: A convenient palladium-catalyzed C−H activation of 2-arylcyclohexane-1,3-diones with
[60]fullerene has been exploited to synthesize the novel [60]fullerene-fused spiroindanes for the
first time. This reaction demonstrates broad substrate scope to provide diverse products. A
plausible reaction mechanism involving palladium-catalyzed enolate-directed C−H activation and
cyclization has been proposed.
Key words: Fullerene; Palladium-Catalyzed; C−H Activation; 2-Arylcyclohexane-1,3-diones
25
0 引言
自从 1985 年发现[60]富勒烯(C60)以来,它的结构、性质以及潜在的应用已经吸引了
广泛的注意。合成在材料科学和生物医学有潜在应用的新颖富勒烯衍生物是大家积极探索的
方向。在过去的几十年,已经发展了许多合成富勒烯衍生物的方法,包括:环加成反应、自
由基反应、亲核反应以及多加成反应等等[1-7]。然而,高效方便地合成富勒烯衍生物的方法
是十分有限的。我们组在 2009 年首次把钯催化的 C–H 方法引入富勒烯化学,使用乙酰苯胺
作为导向基,成功地合成了[60]富勒烯并二氢吲哚产物[8]。随后,N-取代的苯甲酰胺、N-磺
酰基的 2-芳基苯胺、磺酸、N-苄基的磺酰胺、苯乙醇以及苄醇和 N-苯乙基磺酰胺导向的 C–H
键活化也被用于与 C60 反应,合成了新颖的[60]富勒烯并四氢异喹啉酮[9]、氮杂七元环[10]、
磺酸内酯[11]、四氢异喹啉[12]、庚醚以及异色满[13]和四氢苯并氮杂卓[14]。尽管已经合成了如
此多的富勒烯产物,但仍然需要合成更多的富勒烯衍生物作为前体供材料学家和生物学家研
究。钯催化的 C–H 键活化是非常有用的合成方法,可以合成许多以前无法合成的产物。
另一方面,最近 Lam 小组报道了钯和钌催化的 2-芳基 1,3-二羰基化合物与炔烃的环化
反应合成了螺茚产物[15-18]。我们想能否用相似的方法实现 2-芳基 1,3-环己二酮与 C60 的反应
合成新颖的富勒烯螺茚产物。富勒烯茚产物早有报道,Saunders 等人在 1994 年就实现了
3He@C60 与环丙基[d]萘发生双自由基的加成合成了富勒烯茚的产物[19]。之后,我们课题组
合成了许多富勒烯茚衍生物。在 2011 年,我们报道了醋酸锰促进的 α-苯基取代的丙二酸酯
作者简介:周典兵(1989-)男,博士研究生在读,富勒烯化学
通信联系人:王官武(1966-),男,教授,富勒烯化学与绿色有机合成. E-mail: gwang@ustc.edu.cn
30
35
40
- 1 -
�
45
50
55
60
中国科技论文在线
http://www.paper.edu.cn
与 C60 的反应合成了富勒烯茚产物[20]。随后,我们通过布朗斯特酸促进的富勒烯并四氢异喹
啉或者富勒烯并四氢氮杂䓬的重排反应也合成了不同取代的富勒烯茚产物[12,14]。在 2013 年,
我们组也报道了机械研磨条件下 FeCl3 促进的 C60 与二苯甲基磺酰胺的环化反应合成了富勒
烯茚产物[21]。尽管已经合成了这么多的富勒烯茚产物,富勒烯螺茚的产物并没有被合成出
来。我们通过钯催化的烯醇导向的 C–H 活化方法实现了 C60 与 2-芳基 1,3-环己二酮的氧化环
化反应合成了一系列不同的富勒烯螺茚产物。
1 结果与讨论
1.1 反应条件的优化
我们首先使用 2-苯基 5,5-二甲基 1,3-环己二酮作为底物去优化反应条件。当 Pd(OAc)2
作为催化剂,使用 BQ 作为氧化剂,对甲苯磺酸作添加剂,邻二氯苯作为溶剂在 100 oC 条
件下反应 24 小时,以 10%的产率得到目标产物 2a。进一步筛选其它钯催化剂,Pd(TFA)2
和 PdCl2 催化效果与 Pd(OAc)2 相当,都生成 10%左右产率的 2a。令我们高兴的是,当
Pd(CH3CN)2Cl2 和 Pd(PhCN)2Cl2 作为催化剂时,我们分别得到了 27%和 33%产率的 2a。离
子型的钯催化剂 Pd(OTf)2(MeCN)4 降低产物产率到 22%。接下来我们又对氧化剂进行了筛
选,包括 Na2S2O8、NFSI、oxone、Cu(OAc)2 和 AgOAc 等,没有获得更高的产率。其它的
酸性添加剂效果都略低于 PTSA,不加酸性添加剂也能生成 27%产率的 2a。当向反应体系加
入 0.5mL 的苯甲腈作为共溶剂时,我们仅仅观察到极少量的产物。在碱性条件下,反应完
全不发生。
表 1 反应条件的优化 a
+
O
1a
O
Pd (10 mol %)
Oxidant (2 equiv)
Additive (1 equiv)
ODCB (4 mL)
100 oC, 24 h
编号
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17c
催化剂
Pd(OAc)2
Pd(TFA)2
PdCl2
Pd(CH3CN)2Cl2
Pd(PhCN)2Cl2
Pd(OTf)2(MeCN)4
Pd(PhCN)2Cl2
Pd(PhCN)2Cl2
Pd(PhCN)2Cl2
Pd(PhCN)2Cl2
Pd(PhCN)2Cl2
Pd(PhCN)2Cl2
Pd(PhCN)2Cl2
Pd(PhCN)2Cl2
Pd(PhCN)2Cl2
Pd(PhCN)2Cl2
Pd(PhCN)2Cl2
氧化剂
BQ
BQ
BQ
BQ
BQ
BQ
Na2S2O8
NFSI
oxone
Cu(OAc)2
AgOAc
BQ
BQ
BQ
BQ
BQ
BQ
- 2 -
O
O
产率 b
10 (37)
10 (31)
11 (37)
27 (59)
33 (58)
22 (58)
17 (39)
20 (39)
8 (20)
trace
trace
31 (49)
26 (65)
23 (55)
28 (56)
27 (52)
trace
2a
添加剂
PTSA
PTSA
PTSA
PTSA
PTSA
PTSA
PTSA
PTSA
PTSA
PTSA
PTSA
D-CSA
TFA
HOTf
PivOH
\
PTSA
�
中国科技论文在线
http://www.paper.edu.cn
18d
19d
Pd(PhCN)2Cl2
Pd(PhCN)2Cl2
BQ
BQ
NaOAc
K2CO3
NP
NP
a 反应条件: C60 (0.05 mmol), 1a (0.10 mmol), 10 mol%的钯催化剂, 2 倍当量的氧化剂,1 倍当量的添加剂,
邻二氯苯 4 mL, 24 h。b 分离产率,括号里面是基于回收 C60 的产率。c 添加 0.5 mL 的苯甲腈。d 2 倍当量
的添加剂。
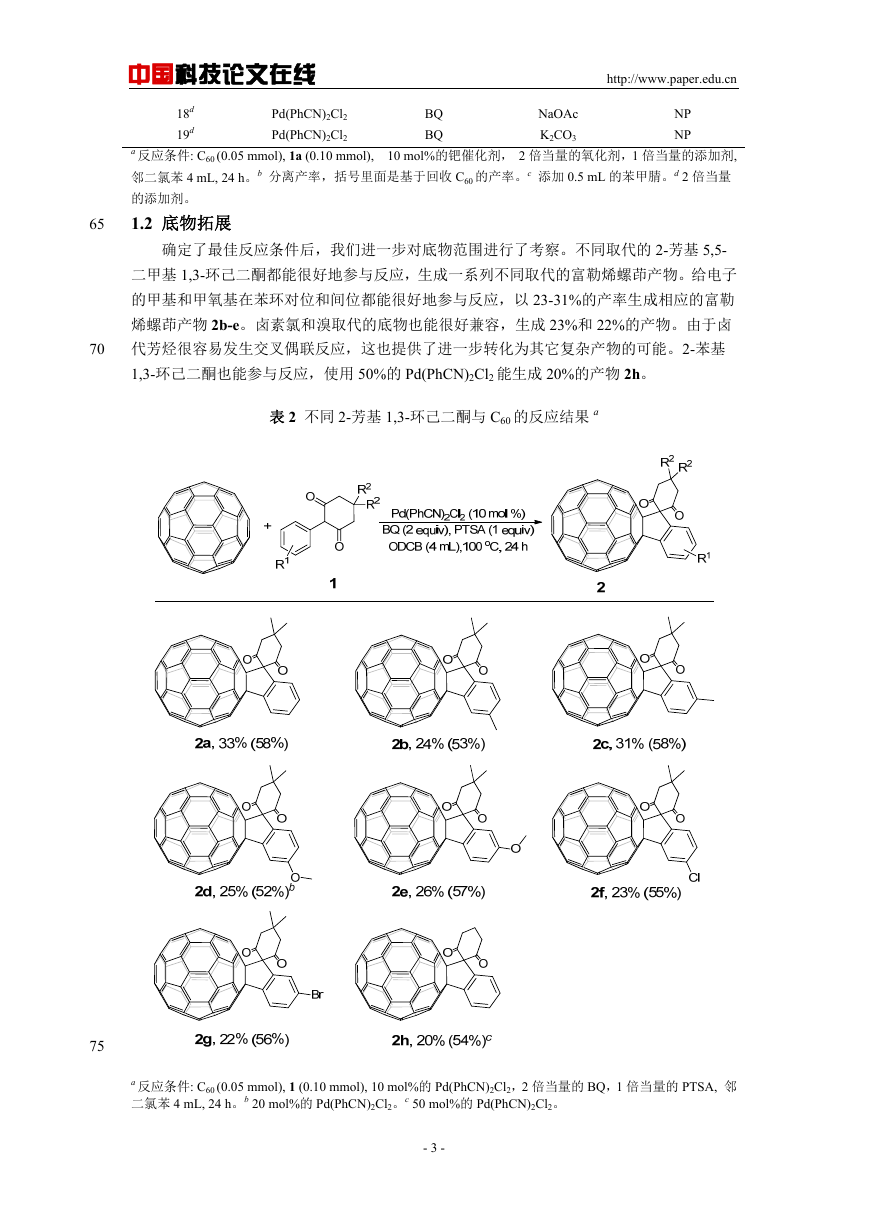
1.2 底物拓展
确定了最佳反应条件后,我们进一步对底物范围进行了考察。不同取代的 2-芳基 5,5-
二甲基 1,3-环己二酮都能很好地参与反应,生成一系列不同取代的富勒烯螺茚产物。给电子
的甲基和甲氧基在苯环对位和间位都能很好地参与反应,以 23-31%的产率生成相应的富勒
烯螺茚产物 2b-e。卤素氯和溴取代的底物也能很好兼容,生成 23%和 22%的产物。由于卤
代芳烃很容易发生交叉偶联反应,这也提供了进一步转化为其它复杂产物的可能。2-苯基
1,3-环己二酮也能参与反应,使用 50%的 Pd(PhCN)2Cl2 能生成 20%的产物 2h。
65
70
表 2 不同 2-芳基 1,3-环己二酮与 C60 的反应结果 a
75
a 反应条件: C60 (0.05 mmol), 1 (0.10 mmol), 10 mol%的 Pd(PhCN)2Cl2,2 倍当量的 BQ,1 倍当量的 PTSA, 邻
二氯苯 4 mL, 24 h。b 20 mol%的 Pd(PhCN)2Cl2。c 50 mol%的 Pd(PhCN)2Cl2。
- 3 -
�
中国科技论文在线
1.3 谱图分析
http://www.paper.edu.cn
80
85
90
我们使用 ESI MS, 1H NMR, 13C NMR, FT-IR 和 UV-vis 谱鉴定了富勒烯螺茚的结构。所
有产物的 ESI MS 谱给出正确的分子离子峰,他们的 1H NMR 谱给出合理的化学位移以及耦
合常数。2a-h 的碳谱,富勒烯笼在 134−155 ppm 区间不超过 30 条谱线,与 Cs 对称性一致。
两个 sp3-碳的化学位移在 75−77 ppm,也与结构相符合。产物的紫外在 430 nm 有特征吸收
峰,这与报道的 1,2-加成物的富勒烯吸收位置相近。
1.4 反应机理
根据实验结果和以前的钯催化的反应文献报道[2,3],我们认为机理涉及到钯催化的烯醇
导向的 C−H 活化环化过程。我们以 2-苯基 5,5-二甲基 1,3-环己二酮 1a 作为代表性底物来说
明反应机理。由于 1a 在溶液中存在酮式-烯醇式平衡,反应可能首先经历钯催化的烯醇导向
的邻位 C−H 活化生成钯环中间体 A,随后与 C60 发生插入反应生成钯环中间体 B,B 经过烯
丙基钯中间体 C 重排转化为钯环 D,最后钯环 D 发生还原消除生成富勒烯螺茚产物和 Pd(0)。
Pd(0)在氧化剂 BQ 的作用下氧化成 Pd(II)完成催化循环。
95
100
Scheme 1. 可能的反应机理
2 实验部分
2.1 实验步骤
将 0.05 mmol 的 C60, 0.10 mmol 的 1, 0.005 mmol 的 Pd(PhCN)2Cl2, 0.10 mmol 的 BQ,
和 0.05 mmol 的 PTSA 溶解在 4mL 的邻二氯苯中,在 100 oC 下搅拌 24 个小时。然后用硅胶
过滤掉不溶的盐,减压去除有机溶剂,使用 CS2 作为淋洗剂过柱分离得到未反应完的 C60,
之后用 CS:CH2Cl2 = 1:1 作为淋洗剂得到产物 2。
- 4 -
�
中国科技论文在线
2.2 产物结构的表征
http://www.paper.edu.cn
2a: 1H NMR (400 MHz, CS2/CDCl3) δ 8.14 (d, J = 7.7 Hz, 1H), 7.64 (t, J = 7.4 Hz, 1H), 7.55 (t,
J = 7.5 Hz, 1H), 7.27 (d, J = 7.8 Hz, 1H), 3.12 (d, J = 15.0 Hz, 2H), 2.91 (d, J = 15.0 Hz, 2H),
1.33 (s, 3H), 1.26 (s, 3H); 13C NMR (100 MHz, CS2/DMSO-d6, all 2C unless indicated) δ 204.57
(C=O), 153.96, 150.52, 147.04 (1C), 146.58 (1C), 145.74, 145.59, 145.46, 145.44, 145.12, 144.85,
144.80, 144.69, 144.62, 144.56, 144.43 (1C, aryl C), 144.13, 143.69, 143.55, 142.59, 142.17,
142.12, 141.68, 141.61, 141.55, 141.37, 141.18, 141.03, 140.31, 139.14 (1C, aryl C), 138.36,
137.71, 134.28, 128.70 (1C, aryl C), 128.22 (1C, aryl C), 127.40 (1C, aryl C), 124.71 (1C, aryl C),
84.90 (1C), 76.28 (1C, sp3-C of C60), 76.14 (1C, sp3-C of C60), 55.09, 30.56 (1C), 29.43 (1C),
27.02 (1C); FT-IR ν/cm-1 (KBr) 2952, 1728, 1696, 1454, 1423, 1375, 1313, 1194, 1097, 745, 559,
529; UV-vis (CHCl3) λmax nm (log ε) 257 (5.05), 316 (4.61), 430 (3.68); HRMS (ESI-FT-ICR) m/z
calcd for C74H14O2 [M]+ 934.0988, found 934.0975.
2b: 1H NMR (400 MHz, CS2/CDCl3) δ 7.92 (s, 1H), 7.36 (d, J = 8.0 Hz, 1H), 7.14 (d, J = 8.0
Hz, 1H), 3.10 (d, J = 14.9 Hz, 2H), 2.89 (d, J = 14.9 Hz, 2H), 2.55 (s, 3H), 1.31 (s, 3H), 1.25 (s,
3H); 13C NMR (100 MHz, CS2/DMSO-d6, all 2C unless indicated) δ 204.73 (C=O), 154.07,
150.67, 147.06 (1C), 146.60 (1C), 145.75, 145.60, 145.47, 145.45, 145.15, 144.86, 144.81 (4C),
144.63, 144.59 (1C, aryl C), 144.56, 144.15, 143.75, 143.58, 142.60, 142.18, 142.13, 141.70,
141.66, 141.57, 141.38, 141.19, 141.06, 140.27, 138.68 (1C, aryl C), 138.38, 137.73, 136.25 (1C,
aryl C), 134.26, 129.42 (1C, aryl C), 127.15 (1C, aryl C), 125.21 (1C, aryl C), 84.59 (1C), 76.45
(1C, sp3-C of C60), 76.19 (1C, sp3-C of C60), 55.16, 30.57 (1C), 29.43 (1C), 27.03 (1C), 21.27 (1C);
FT-IR ν/cm-1 (KBr) 2952, 1724, 1696, 1498, 1458, 1426, 1374, 1320, 1233, 1192, 1102, 568, 528;
UV-vis (CHCl3) λmax nm (log ε) 257 (5.07), 315 (4.66), 430 (3.70); HRMS (ESI-FT-ICR) m/z
calcd for C75H16O2 [M]+ 948.1145, found 948.1124.
2c: 1H NMR (400 MHz, CS2/DMSO-d6) δ 7.93 (d, J = 7.9 Hz, 1H), 7.40 (d, J = 7.9 Hz, 1H),
6.97 (s, 1H), 3.02 (d, J = 14.9 Hz, 2H), 2.83 (d, J = 14.9 Hz, 2H), 2.53 (s, 3H), 1.29 (s, 3H), 1.22
(s, 3H); 13C NMR (100 MHz, CS2/DMSO-d6, all 2C unless indicated) δ 205.06 (C=O), 154.10,
150.70, 146.96 (1C), 146.52 (1C), 145.66, 145.50, 145.38, 145.37, 145.04, 144.78, 144.71, 144.65,
144.53, 144.45, 144.06, 143.72, 143.51, 142.50, 142.07, 142.03, 141.82, 141.58 (4C), 141.49,
141.29, 141.12, 140.93 (1C, aryl C), 140.21, 139.24 (1C, aryl C), 138.30 (1C, aryl C), 138.06,
137.58, 134.09, 129.81 (1C, aryl C), 127.55 (1C, aryl C), 124.41 (1C, aryl C), 84.75 (1C), 76.40
(1C, sp3-C of C60), 75.94 (1C, sp3-C of C60), 55.03, 30.39 (1C), 29.43 (1C), 27.13 (1C), 21.14 (1C);
FT-IR ν/cm-1 (KBr) 2952, 1724, 1697, 1498, 1456, 1425, 1366, 1321, 1215, 1186, 1151, 563, 527;
UV-vis (CHCl3) λmax nm (log ε) 259 (4.96), 317 (4.61), 431 (3.81); HRMS (ESI-FT-ICR) m/z
calcd for C75H16O2 [M]+ 948.1145, found 948.1124.
2d: 1H NMR (400 MHz, CS2/DMSO-d6) δ 7.26 (s, 1H), 6.81 (s, 2H), 3.69 (s, 3H), 2.81 (d, J =
14.6 Hz, 2H), 2.59 (d, J = 14.6 Hz, 2H), 1.05 (s, 3H), 1.02 (s, 3H); 13C NMR (100 MHz,
CS2/DMSO-d6, all 2C unless indicated) δ 205.12 (C=O), 160.55 (1C, aryl C), 154.12, 150.87,
147.31 (1C), 146.87 (1C), 146.00, 145.91 (1C, aryl C), 145.87, 145.72, 145.70, 145.40, 145.11,
145.07, 144.98, 144.89, 144.84, 144.38, 144.01, 143.84, 142.86, 142.45, 142.39, 141.94, 141.89,
141.84, 141.63, 141.44, 141.32, 140.58, 138.64, 137.94, 134.62, 130.72 (1C, aryl C), 128.35 (1C,
aryl C), 116.53 (1C, aryl C), 108.67 (1C, aryl C), 84.49 (1C), 76.87 (1C, sp3-C of C60), 76.47 (1C,
sp3-C of C60), 55.49, 55.01 (1C), 30.84 (1C), 29.68 (1C), 27.32 (1C); FT-IR ν/cm-1 (KBr) 2951,
1722, 1694, 1608, 1499, 1458, 1424, 1382, 1317, 1279, 1235, 1190, 1159, 1044, 882, 711, 607,
553, 527; UV-vis (CHCl3) λmax nm (log ε) 257 (5.02), 317 (4.57), 430 (3.59); HRMS (ESI-FT-ICR)
m/z calcd for C75H16O3 [M]+ 964.1094, found 964.1071.
105
110
115
120
125
130
135
140
145
- 5 -
�
中国科技论文在线
http://www.paper.edu.cn
2e: 1H NMR (400 MHz, CS2/DMSO-d6) δ 7.70 (d, J = 8.6 Hz, 1H), 6.90 (dd, J = 8.6, 2.2 Hz,
1H), 6.36 (d, J = 2.2 Hz, 1H), 3.67 (s, 3H), 2.81 (d, J = 14.9 Hz, 2H), 2.59 (d, J = 14.9 Hz, 2H),
1.07 (s, 3H), 1.02 (s, 3H); 13C NMR (100 MHz, CS2/DMSO-d6, all 2C unless indicated) δ 204.50
(C=O), 159.52 (1C, aryl C), 154.05, 150.68, 147.04 (1C), 146.57 (1C), 145.73, 145.53, 145.44,
145.42, 145.10, 144.83, 144.77, 144.57 (4C), 144.49, 144.14, 143.64, 143.55, 142.57, 142.14,
142.10, 141.72, 141.64, 141.53, 141.38, 141.17, 140.97, 140.30, 140.28 (1C, aryl C), 138.29,
137.86, 136.67 (1C, aryl C), 134.11, 125.22 (1C, aryl C), 115.36 (1C, aryl C), 111.87 (1C, aryl C),
84.74 (1C), 76.69 (1C, sp3-C of C60), 75.55 (1C, sp3-C of C60), 55.06, 54.61 (1C), 30.54 (1C),
29.39 (1C), 27.06 (1C); FT-IR ν/cm-1 (KBr) 2949, 1724, 1693, 1605, 1500, 1457, 1424, 1321,
1279, 1217, 1184, 1158, 1104, 1034, 900, 741, 585, 554, 524; UV-vis (CHCl3) λmax nm (log ε) 257
(5.06), 317 (4.61), 431 (3.62); HRMS (ESI-FT-ICR) m/z calcd for C75H16O3 [M]+ 964.1094, found
964.1089.
2f:1H NMR (400 MHz, CS2/DMSO-d6) δ 7.83 (d, J = 1.9 Hz, 1H), 7.25 (dd, J = 8.4, 1.9 Hz,
1H), 6.89 (d, J = 8.4 Hz, 1H), 2.84 (d, J = 14.8 Hz, 2H), 2.61 (d, J = 14.8 Hz, 2H), 1.06 (s, 3H),
1.03 (s, 3H); 13C NMR (100 MHz, CS2/DMSO-d6, all 2C unless indicated) δ 204.23 (C=O),
153.23, 149.97, 147.08 (1C), 146.61 (1C), 146.36 (1C, aryl C), 145.77, 145.63, 145.50, 145.46,
145.06, 144.88, 144.82, 144.69, 144.67, 144.40, 144.11, 143.54 (4C), 142.59, 142.19, 142.15,
141.70, 141.54, 141.50, 141.44, 141.19, 141.01, 140.39, 138.41, 137.62, 137.42 (1C, aryl C),
135.27 (1C, aryl C), 134.41, 128.61 (1C, aryl C), 128.39 (1C, aryl C), 124.83 (1C, aryl C), 84.40
(1C), 76.32 (1C, sp3-C of C60), 75.70 (1C, sp3-C of C60), 54.98, 30.49 (1C), 29.43 (1C), 27.01 (1C);
FT-IR ν/cm-1 (KBr) 2952, 1726, 1697, 1593, 1474, 1423, 1320, 1244, 1197, 1084, 876, 807, 772,
605, 573, 528; UV-vis (CHCl3) λmax nm (log ε) 256 (5.07), 317 (4.62), 431 (3.61); HRMS
(ESI-FT-ICR) m/z calcd for C74H13
35ClO2 [M]+ 968.0599, found 968.0590.
2g:1H NMR (400 MHz, CS2/DMSO-d6) δ 7.75 (d, J = 8.3 Hz, 1H), 7.49 (dd, J = 8.3, 1.6 Hz,
1H), 7.06 (d, J = 1.6 Hz, 1H), 2.84 (d, J = 14.8 Hz, 2H), 2.63 (d, J = 14.8 Hz, 2H), 1.09 (s, 3H),
1.04 (s, 3H); 13C NMR (100 MHz, CS2/DMSO-d6, all 2C unless indicated) δ 204.28 (C=O),
153.56, 150.17, 147.26 (1C), 146.81 (1C), 145.96, 145.82, 145.68, 145.67, 145.26, 145.09, 145.01,
144.85, 144.82, 144.60, 144.29, 143.80 (1C, aryl C), 143.74 (4C), 142.80, 142.39, 142.35, 141.86,
141.75, 141.72, 141.60, 141.40, 141.40 (1C, aryl C), 141.18, 140.55, 138.60, 137.86, 134.57,
132.10 (1C, aryl C), 130.37 (1C, aryl C), 126.12 (1C, aryl C), 122.79 (1C, aryl C), 84.86 (1C),
76.38 (1C, sp3-C of C60), 75.77 (1C, sp3-C of C60), 55.12, 30.71 (1C), 29.65 (1C), 27.31 (1C);
FT-IR ν/cm-1 (KBr) 2952, 1726, 1698, 1621, 1543, 1508, 1466, 1424, 1321, 1254, 1185, 1067,
886, 712, 619, 554, 525; UV-vis (CHCl3) λmax nm (log ε) 257 (5.06), 317 (4.62), 431 (3.58);
HRMS (ESI-FT-ICR) m/z calcd for C74H13
79BrO2 [M]+ 1012.0093, found 1012.0066.
2h:1H NMR (400 MHz, CS2/DMSO-d6) δ 7.85 (d, J = 7.7 Hz, 1H), 7.38 (t, J = 7.4 Hz, 1H),
7.28 (t, J = 7.4 Hz, 1H), 6.89 (d, J = 7.7 Hz, 1H), 2.86-2.74 (m, 4H), 2.23-2.13 (m, 1H), 2.02-1.89
(m, 1H); 13C NMR (100 MHz, CS2/DMSO-d6, all 2C unless indicated) δ 205.26 (C=O), 154.43,
151.35, 147.57 (1C), 147.13 (1C), 146.24, 146.15, 146.00, 145.94, 145.66, 145.37, 145.30 (4C),
145.16, 145.14, 144.74 (1C, aryl C), 144.66, 144.14, 144.08, 143.15, 142.69, 142.62, 142.20,
142.15, 142.07, 141.86, 141.69, 141.60, 140.77, 140.68 (1C, aryl C), 138.94, 138.38, 135.05,
129.31 (1C, aryl C), 129.09 (1C, aryl C), 127.66 (1C, aryl C), 125.39 (1C, aryl C), 86.41 (1C),
76.96 (1C, sp3-C of C60), 76.82 (1C, sp3-C of C60), 42.11, 17.94 (1C); FT-IR ν/cm-1 (KBr) 2921,
1697, 1644, 1533, 1518, 1484, 1459, 1425, 1313, 1270, 1181, 1087, 1038, 881, 807, 743, 705, 577,
524; UV-vis (CHCl3) λmax nm (log ε) 256 (5.07), 316 (4.58), 428 (3.48); HRMS (ESI-FT-ICR) m/z
calcd for C72H10O2 [M]+ 906.0675, found 906.0656.
150
155
160
165
170
175
180
185
190
- 6 -
�
中国科技论文在线
http://www.paper.edu.cn
3 结论
195
我们成功实现了钯催化的 C60 与 2-芳基 1,3-环己二酮的环化反应。反应条件简单,一步
就合成一系列新颖的富勒烯螺茚产物。结合实验结果和文献,我们提出了一个钯催化的烯醇
导向的 C–H 活化机理。
致谢
感谢国家自然科学基金重点项目(21132007)和教育部高等学校博士学科点专项科研基
金课题优先发展领域项目(20123402130011)的经费支持。
200
[参考文献] (References)
205
210
215
220
225
230
235
240
245
[1] Nakamura, E.; Isobe, H. Functionalized Fullerenes in Water. The First 10 Years of Their Chemistry, Biology,
and Nanoscience [J]. Acc. Chem. Res. 2003, 36, 807.
[2] Thilgen, C.; Diederich, F. Structural Aspects of Fullerene Chemistrys-A Journey through Fullerene Chirality[J].
Chem. Rev. 2006, 106, 5049.
[3] Giacalone, F.; Martín, N. Fullerene Polymers: Synthesis and Properties [J]. Chem. Rev. 2006, 106, 5136.
[4] Matsuo, Y.; Nakamura, E. Selective Multiaddition of Organocopper Reagents to Fullerenes [J]. Chem. Rev.
2008, 108, 3016.
[5] Guldi, D. M.; Illescas, B. M.; Atienza, C. M.; Wielopolski, M.; Martín, N. Fullerene for Organic Electronics [J].
Chem. Soc. Rev. 2009, 38, 1587.
[6] Tzirakis, M. D.; Orfanopoulos, M. Radical Reactions of Fullerenes: From Synthetic Organic Chemistry to
Materials Science and Biology [J]. Chem. Rev. 2013, 113, 5262.
[7] Zhu, S.-E; Li, F.; Wang, G.-W. Mechanochemistry of Fullerenes and Related Materials [J]. Chem. Soc. Rev.
2013, 42, 7535.
[8] Zhu, B.; Wang, G.-W. Palladium-Catalyzed Heteroannulation of [60]Fullerene with Anilides via C-H Bond
Activation[J]. Org. Lett. 2009, 11, 4334.
[9] Chuang, S.-C.; Rajeshkumar, V.; Cheng, C.-A.; Deng, J.-C.; Wang, G.-W. Annulation of Benzamides with
[60]Fullerene through Palladium(II)-Catalyzed C-H Bond Activation[J]. J. Org. Chem. 2011, 76, 1599.
[10] Rajeshkumar, V.; Chan, F.-W.; Chuang, S.-C. Palladium-Catalyzed and Hybrid Acids-Assisted Synthesis of
[60]Fulleroazepines in One Pot under Mild Conditions: Annulation of N-Sulfonyl-2-aminobiaryls with
[60]Fullerene through Sequential C-H Bond Activation, C-C and C-N Bond Formation[J]. Adv. Synth. Catal. 2012,
354, 2473.
[11] Li, F.; Liu, T.-X.; Wang, G.-W. Synthesis of [60]Fullerene-Fused Sultones via Sulfonic Acid Group-Directed
C-H Bond Activation[J]. Org. Lett. 2012, 14, 2176.
[12] Su, Y.-T.; Wang, Y.-L.; Wang, G.-W. Palladium-Catalysed Heteroannulation of [60]Fullerene with N-Benzyl
Sulfonamides and Subsequent Functionalisation[J]. Chem. Commun. 2012, 48, 8132.
[13] Zhai, W.-Q.; Peng, R.-F.; Jin, B.; Wang, G.-W. Synthesis of [60]Fullerene-Fused Tetrahydrobenzooxepine
and Isochroman Derivatives via Hydroxyl-Directed C−H Activation/C−O Cyclization[J]. Org. Lett. 2014, 16, 1638.
[14] Su, Y.-T.; Wang, Y.-L.; Wang, G.-W. Palladium-Catalyzed Heteroannulation of [60] Fullerene with
N-(2-arylethyl) Sulfonamides via C-H Bond Activation[J]. Org. Chem. Front. 2014, 1, 689.
[15] Chidipudi, S. R.; Khan, I.; Lam, H. W. Functionalization of C(sp3)-H and C(sp2)-H Bonds: Synthesis of
Spiroindenes by Enolate-Directed Ruthenium-Catalyzed Oxidative Annulation of Alkynes with
2-Aryl-1,3-dicarbonyl Compounds[J]. Angew. Chem., Int. Ed. 2012, 51, 12115.
[16] Dooley, J. D.; Chidipudi, S. R.; Lam, H. W. Catalyst-Controlled Divergent C−H Functionalization of
Unsymmetrical 2-Aryl Cyclic 1,3-Dicarbonyl Compounds with Alkynes and Alkenes[J]. J. Am. Chem. Soc. 2013,
135, 10829.
[17] Khan, I.; Chidipudi, S. R.; Lam, H. W. Synthesis of Spiroindanes by Palladium-Catalyzed Oxidative
Annulation of Non- or Weakly Activated 1,3-Dienes involving C-H Functionalization[J]. Chem. Commun. 2015,
51, 2613.
[18] Chidipudi, S. R.; Burns, D. J.; Khan, I.; Lam, H. W. Enantioselective Synthesis of Spiroindenes by
Enol-Directed Rhodium(III)-Catalyzed C-H Functionalization and Spiroannulation[J]. Angew. Chem., Int. Ed.
2015, 54, 13975.
[19] Saunders, M.; Jiménez-Vázquez, H. A.; Cross, R. J.; Billips, E.; Gesenberg, C.; McCord, D. J. Reaction of
Cyclopropa[b]naphthalene with 3He@C60[J]. Tetrahedron. Lett. 1994, 35, 3869.
[20] Liu, T.-X.; Li, F.-B.; Wang, G.-W. Synthesis of [60]Fullerene-Fused Tetrahydronaphthalene and Indane
Derivatives via a Pathway Switched by Aluminum Chloride[J]. Org. Lett. 2011, 13, 6130.
[21] Su, Y.-T.; Wang, G.-W. FeCl3-Mediated Cyclization of [60]Fullerene with N-Benzhydryl Sulfonamides
under High-Speed Vibration Milling Conditions[J]. Org. Lett. 2013, 15, 3408.
- 7 -
�













 2023年江西萍乡中考道德与法治真题及答案.doc
2023年江西萍乡中考道德与法治真题及答案.doc 2012年重庆南川中考生物真题及答案.doc
2012年重庆南川中考生物真题及答案.doc 2013年江西师范大学地理学综合及文艺理论基础考研真题.doc
2013年江西师范大学地理学综合及文艺理论基础考研真题.doc 2020年四川甘孜小升初语文真题及答案I卷.doc
2020年四川甘孜小升初语文真题及答案I卷.doc 2020年注册岩土工程师专业基础考试真题及答案.doc
2020年注册岩土工程师专业基础考试真题及答案.doc 2023-2024学年福建省厦门市九年级上学期数学月考试题及答案.doc
2023-2024学年福建省厦门市九年级上学期数学月考试题及答案.doc 2021-2022学年辽宁省沈阳市大东区九年级上学期语文期末试题及答案.doc
2021-2022学年辽宁省沈阳市大东区九年级上学期语文期末试题及答案.doc 2022-2023学年北京东城区初三第一学期物理期末试卷及答案.doc
2022-2023学年北京东城区初三第一学期物理期末试卷及答案.doc 2018上半年江西教师资格初中地理学科知识与教学能力真题及答案.doc
2018上半年江西教师资格初中地理学科知识与教学能力真题及答案.doc 2012年河北国家公务员申论考试真题及答案-省级.doc
2012年河北国家公务员申论考试真题及答案-省级.doc 2020-2021学年江苏省扬州市江都区邵樊片九年级上学期数学第一次质量检测试题及答案.doc
2020-2021学年江苏省扬州市江都区邵樊片九年级上学期数学第一次质量检测试题及答案.doc 2022下半年黑龙江教师资格证中学综合素质真题及答案.doc
2022下半年黑龙江教师资格证中学综合素质真题及答案.doc