2000 年广东高考化学真题及答案
第Ⅰ卷 (选择题共 84 分)
可能用到的原子量:H 1
C 12
Ag
108
N 14
I 127
O 16
CL 35.5
Fe 56
Br
80
一、 选择题(本题包括 11 小题,每小题 4 分,共 44 分。每小题只有一个选项符合题意。)
1.1999 年新发现的 114 号元素的同位素,其子数为 184,该同位素原子的质量数为
A.70
B.114
C.228
D.298
2.下列气体不能用浓 H2SO4 干燥的是
C.SO2
A.CO2
B.H2S
D.HCl
3.室温时,下列液体的密度纯水密度大的是
A.硝基苯
B.浓氛水
C.乙醇
D.汽油
4.只含有一种元素的物质
A.可能是纯净物也可能是混合物
B.可能是单质也可能是化合物
C.一定是纯净物
D.一定是一种单质
5.可以判断油脂皂化反应基本完成的现象是
A. 反应液使红色石蕊试纸变蓝色
B.反应液使蓝色石蕊试纸变红色
C.反应后静置,反应液分为两层
D.反应后静置,反应液不分层
6.在周期表中,第三、四、五、六周期元素的数目分别是
A.8、18、32、32
C、8、18、18、18
B、8、18、18、32
D、8、8、18、18
7.PH=7 的盐酸和 PH=9 的氢氧化纳溶液以体积比 11:9 混合,混合液的 pH
A.为 7.2
B.为 8
C.为 6
D.无法计算
8.在 C2H9N 中,N 原子以三个单键与其他原子相连接,它具有的同分异构体数目为
A.1
B.2
C.3
D.4
9.把表面有氧化物的相同大小的铜片和铁片一起放入盐酸中充分反应,所得溶液中的金属离
子
A.是 Fe3+和 Cu2+
C.是 Fe2-和 Fe3+
B.是 Fe2+和 Cu2+
D.只有 Fe2+
10.某种解热镇痛药的结构简式为
当它完全水解时,可得到的产物有
A.2 种
B.3 种
C.4 种
D.5 种
11.把 a g 铁铝合金粉末溶于足量盐酸中,加入过量 NaOH 溶液。过滤出沉淀,经洗涤、干
燥、灼烧,得到红棕色粉末的质量仍为 a g,则原合金中铁的质量分数为
A.70%
参考答案:
1.D
C.47.6%
B.52.4%
D.30%
5.D
6.B
7.C
3.A
4.A
2.B
8.D
9.D
10.C
11.A
�
二.选择题(本题包括 10 小题,第小题 4 分,共 40 分。每小题有一个或两个选项符合题意。
若正确答案只包括一选项,多选时,该题为 0 分;若正确答案包括两个选项,只选一个
且正确的给 2 分,选两个且都正确的给 4 分,但只要选借一个,该小题就为 0 分。)
12.右图装置可用于
加热无水醋酸钠和 石灰混合物,制取甲烷
A.
B. 加热硝酸铅制取二氧化氮
C. 加热氯酸钾和少量二氧化锰,制取氧气
D.
加热氯化铵和消石灰混合物,制取氨气
13.下列说法不正确的是
A.
B.
C.
D.
硫是一种淡黄色的能溶于水的晶体
硫的化合物常存在于山火喷出的气体中和矿泉水里
硫与氧属于同一主族
硫在空气中的燃烧产物是二氧化硫,在纯氧中的燃烧产物是三氧化硫
14.室温时,若 0.1mod·L-1 的元弱碱的电离度为 1%,则下列廉洁正确的是
A.
B.
C.
D.
该溶液的 pH=11
该溶液的 pH=3
加入等体积 0.1mol·L-1HCL 后所得溶液的 pH=7
加入等体积 0.1mol·L-1HCl 后所得溶液的 pH>7
15.用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率加大的是
A.加热
C.滴加少量 CuSO4 溶液
B.不用稀硫酸,改用 98%浓硫酸
16.某溶液中含有大量 Fe2+、Fe3+、Mg2+和 NH+
D.不用铁片,改用铁粉
4,其[H+]=10-2mol·L-1,在该溶液中可以大量存在
的阴离子是
A.
2
4SO
B.
3No
C.
SCN
D.
2
3CO
17.在甲酸溶液中加入一定量 NaOH 溶液,恰好完全反应,对于生成的溶液,下列判断一定正
确的是
A.[HCOO-]<[Na
+]
C.[OH-]>[HCOO-]
B.[HCOO-]>[Na+]
D.[OH-]<[HCOO-]
18.下列反就的离子方程式书写正确的是
A.
向氢氧化钠溶液中通入少量 CO2
OH-+CO2=
3HCO
B. 用氨水吸收少量 SO2
2NH3·H2O+SO2=2
4NH +
2
SO +H2O
3
C. 硝酸铝溶液中加入过量氨水 Al3-+4NH2·H2O=
ALO +4
2
4NH +2H2O
D. 向 Fe2(SO4)3 的酸性溶液中通入足量 H2S
Fe3++H2S=Fe2++S↓+2H+
�
19.同温同压下两个容积相等的贮气瓶,一个装有 C2H4,另一个装有 C2H2 和 C2H6 的混合气体,
两瓶内的气体一定具有相同的
A.质量
B.原子总数
C.碳原子数
D.密度
20.同温同压下,当反应物分解了 8%时,总体积也增加 8%的是
A. 2NH3(g)
A. 2NO(g)
B. 2N2O5(g)
C. 2NO2(g)
N2(g)+3H2(g)
N2(g)+O2(g)
4NO2(g)+O2(g)
2NO(g)+O2(g)
21.用铂电极(情性)电解下列溶液时,阴极和阳极上的主要产物分别是 H2 和 O2 的是
A. 稀 NaOH 溶液
B. HCl 溶液
C. 酸性 MgSO4 溶液
D 酸性 AgNO3
参考答案:
12.A、C
18.B
13.A、D
19.C
14.A
20.A
15.B
16.A
17.A、D
21.A、C
三、题共两小题,16 分。
22.(4 分)
(1)在进行沉淀反应的实验时,如何认定沉淀已经完全?
答________________________________________________
(2)中学化学实验中,在过滤器上洗涤沉淀的操作是
23.(12 分)某液态卤代烷 RX(R 是烷基,X 是某种卤素原子)的密度是 a g·cm-3。该 RX 可
以跟稀碱发生水解反应生成 ROH(能跟水互溶)和 HX。为了测定 RX 的分子量,拟定的
实验步骤如下:
1 准确量取该卤代烷 b mL,放入锥形瓶中。
2 在锥形瓶中加入过量稀 NaOH 溶液,塞上带有长玻璃管的塞子,加热,发生反反
应。
3 反应完成后,冷却溶液,加稀 NaOH 溶液,塞上带有长玻璃的塞子,加热,发生
反应。
4 过滤、洗涤、干燥后称重,得到固体 c g。
回答问题:
(1) 装置中长玻璃管的作用是________________。
(2) 步骤④中,洗涤的目的是为了除去沉淀上吸附的________离子。
(3) 该卤代烷中所含卤素的名称是____________,判断的依据是_____________。
(4) 该卤代烷的分子量是_____________(列出算式)。
(5) 如果在步聚③中,加 HNO3 的量不足,没有将溶液酸化,则步骤④中测得的 c
值(填下列选项代码)_______。
B.偏小
C.不变
A.偏大
参考答案:
22.(1)在上层清液中(或取少量上层清液置于小试管中),滴加沉淀剂,如果不再产
D.大小不定
生沉淀,说明沉淀完全。
�
(2)向漏斗里注入蒸馏水,使水面没过沉淀物,等水流完后,重复操作数次。
23.(1)防止卤代烷挥发(或答 冷疑)
(2)Ag+,Na+和
3NO
(3)氯(1 分);得到的卤化银沉淀是白色的(2 分)
(4)
143
ba 5.
c
(5)A
四、本题共两小题, 20 分
24.(10 分)
(1)分别写出由氧在一定条件下生成下列物质的化学议程式(必须注明反应条件)
①O3:_____________________.
②Na2O2____________________________。
③指出氧在下列各物质中的化合价:
O3___________;Na2O2___________;Na2O_________。
(2)KO2 能吸收 CO2 生丰收 K2CO3 和 O2,故可用作特殊情况下的氧气源,试写出该反应的化学
方程式____________________________。
(3)KO2 能吸收 CO2 生成 K2CO3 和 O2,故可用作特殊情况下的气氧气源,试写出该反应的化学
方程式___________________。
(4)人体内
2O 离子对健康有害,使人过早衰老,但在催化剂 SOD 存在下可发生如下反应,
请完成该反应的离子方程式:
2O +
H2O
H2O2
+
O2+
25.(10 分)(1)下列结构图中,代表原子序数从 1 到 10 的元素的原子实(原子实是原子除去
最外层电子后剩余的部分),不黑点代表未用于形成共价键的最外层电子,短线代表价键,
根据各图表示的结构特点,写出该分子的化学式:
A:________
(2)在分子的结构式中,由一个原子提供成键电子对而形成的共价键用→表示,例
B:_________
C:________
D:________
如:硫酸
,
硝基甲烷
,
写出三硝酸甘油酯的结构式:________________。
参考答案:
放电
�
24.(1)①3O2
2O3
②2Na+O2
Na2O2
③4Na+O2===2Na2O
(2)0; -1; -2,
(3)4KO2+2CO2===2K2CO3+3O2
(4) 2
2O + 2H2O=== H2O2+O2+ 2OH-
25.(1)A:NH3
B:HCN
C:CO(NH2)2
D.BF3
(2)
五.(本题包括 2 小题,共 14 分)
26.(8 分)(1)今有 A、B、C 3 种二甲苯;将它们分别进行一硝化反应,得到的产物分子
式都是 C8H9NO2,但 A 得到两种产物,B 得到 3 种产物,C 只得到一种产物。由此可以判断
A、B、C 各是下列哪一结构,请将字母填入结构式后面的括号中。
(2)请写出一个化合物的结构式。它的分子式是 C8H9NO2,分子中有苯环,苯环上有三个取代
基,其中之一为羧基,但并非上述二甲笨的硝化产物。请任写一个:
27.(6 分)已知溴乙烷跟氰化钠反应再水解可以得到丙酸
CH3CH2Br NaCN
CH3CH2CN OH 2
CH3CH2COOH,
产物分子比原化合物分子多了一个碳原子,增长了碳链。请根据以下框图回答问题
F 分子中含有 8 个原子组成的环状结构。
�
(1)反应①②③中属于取代反应的是__________(填反应代号)。
(2)写出结构简式:E_____________,F__________。
参考答案:
26.(1)(C)(A)(B)
27.(1)②;③
(2)CH3—CHCOOH
CH2COOH
CH3CH—COOCH—CH3
CH3CH—COOCH2
CH2—COOCH2
CH2—COOCH—CH3
六.(本题包括 2 小题,共 16 分)
28.(5 分)在 1.00L 1.00mol·L-1NaOH 溶液中通入 16.8L 标准状况下的 CO2,计算所得溶液
中含有的 NaHCO3 和 Na2CO3 的物质的量。
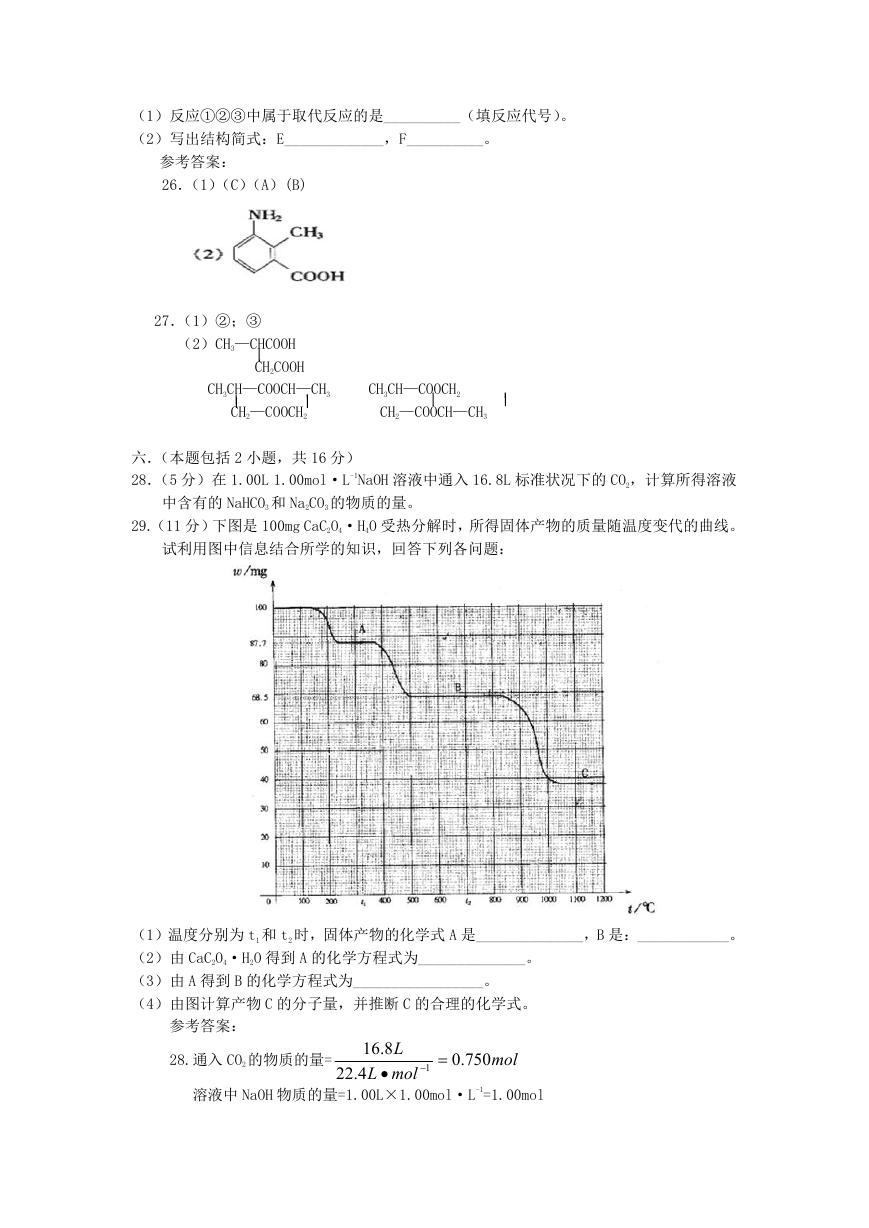
29.(11 分)下图是 100mg CaC2O4·H4O 受热分解时,所得固体产物的质量随温度变代的曲线。
试利用图中信息结合所学的知识,回答下列各问题:
(1)温度分别为 t1 和 t2 时,固体产物的化学式 A 是______________,B 是:____________。
(2)由 CaC2O4·H2O 得到 A 的化学方程式为______________。
(3)由 A 得到 B 的化学方程式为_________________。
(4)由图计算产物 C 的分子量,并推断 C 的合理的化学式。
参考答案:
28.通入 CO2 的物质的量=
8.16
L
L
mol
4.22
1
.0
750
mol
溶液中 NaOH 物质的量=1.00L×1.00mol·L-1=1.00mol
�
根据 2NaOH+CO2=Na2CO3+H2O
2
1
该反应中 CO2 过量:0.750mol-
Na2CO3+CO2+H2O=2NaHCO3
1
:
1
:
2
00.1 mol
2
=0.250mol
反应中 NaCO3 过量,生成的 NaHCO3 为 n(反应 CO2)×2=0.500mol
溶液中剩余的 Na2CO3 为 0.500mol-0.250mol=0.250mol
29.(1)CaC2O4
CaCO3
(2)CaC2O4·H2O
CaC2O4+H2O↑
(3)CaC2O4
CaCO3+CO↑
(4)由图读得分解产物 C 的质量约为 38mg
38
=56
146
100
56
)
C 的分子量=
(或=
38
100
5.68
由此推断 C 的化学式是 CaO
�













 2023年江西萍乡中考道德与法治真题及答案.doc
2023年江西萍乡中考道德与法治真题及答案.doc 2012年重庆南川中考生物真题及答案.doc
2012年重庆南川中考生物真题及答案.doc 2013年江西师范大学地理学综合及文艺理论基础考研真题.doc
2013年江西师范大学地理学综合及文艺理论基础考研真题.doc 2020年四川甘孜小升初语文真题及答案I卷.doc
2020年四川甘孜小升初语文真题及答案I卷.doc 2020年注册岩土工程师专业基础考试真题及答案.doc
2020年注册岩土工程师专业基础考试真题及答案.doc 2023-2024学年福建省厦门市九年级上学期数学月考试题及答案.doc
2023-2024学年福建省厦门市九年级上学期数学月考试题及答案.doc 2021-2022学年辽宁省沈阳市大东区九年级上学期语文期末试题及答案.doc
2021-2022学年辽宁省沈阳市大东区九年级上学期语文期末试题及答案.doc 2022-2023学年北京东城区初三第一学期物理期末试卷及答案.doc
2022-2023学年北京东城区初三第一学期物理期末试卷及答案.doc 2018上半年江西教师资格初中地理学科知识与教学能力真题及答案.doc
2018上半年江西教师资格初中地理学科知识与教学能力真题及答案.doc 2012年河北国家公务员申论考试真题及答案-省级.doc
2012年河北国家公务员申论考试真题及答案-省级.doc 2020-2021学年江苏省扬州市江都区邵樊片九年级上学期数学第一次质量检测试题及答案.doc
2020-2021学年江苏省扬州市江都区邵樊片九年级上学期数学第一次质量检测试题及答案.doc 2022下半年黑龙江教师资格证中学综合素质真题及答案.doc
2022下半年黑龙江教师资格证中学综合素质真题及答案.doc