2018 年海南高考化学真题及答案
一、单选题
1.下列食品添加剂中,常用作防腐剂的是
A.碘酸钾
B.碳酸氢钠
C.苯甲酸钠
D.磷酸氢钠
2.某工业废气所含氮氧化物(NxOy)的氮氧质量比为 7∶4,该 NxOy 可表示为
A.N2O
B.NO
C.N2O3
D.NO2
3.用浓硫酸配制稀硫酸时,不必要的个人安全防护用品是
A.实验服
B.橡胶手套
C.护目镜
D.防毒面罩
4.下列化合物中,能与 Na2CO3 溶液反应生成沉淀且沉淀可溶于 NaOH 溶液的是
A.MgCl2
B.Ca(NO3)2
C.FeSO4
D.AlCl3
5.化学与生产生活密切相关,下列说法错误的是
A.Na2O2 可与 CO2 反应放出氧气,可用于制作呼吸面具
B.SiO2 具有导电性,可用于制作光导纤维和光电池
C.聚四氟乙烯耐酸碱腐蚀,可用作化工反应器的内壁涂层
D.氯水具有较强的氧化性,可用于漂白纸张.织物等
6.某温度下向含 AgCl 固体的 AgCl 饱和溶液中加少量稀盐酸,下列说法正确的是
A.AgCl 的溶解度、Ksp 均减小
B.AgCl 的溶解度、Ksp 均不变
C.AgCl 的溶解度减小、Ksp 不变
D.AgCl 的溶解度不变、Ksp 减小
7.下列分离方法正确的是
A.回收水溶液中的 I2:加入乙酸,分液,蒸发
B.回收含有 KCl 的 MnO2:加水溶解,过滤,干燥
C.除去氨气中的水蒸气:通过盛有 P2O5 的干燥管
D.除去乙醇中的水,加入无水氯化钙,蒸馏。
8.NA 代表阿伏加德罗常数的值,下列说法正确的是
A.12 g 金刚石中含有化学键的数目为 4NA
B.18 g 的 D2O 中含有的质子数为 10
C.28 g 的乙烯和环已烷混合气体中所含原子总数为 6NA
D.1 L 1mol·L¯1 的 NH4Cl 溶液中 NH4
+和 Cl―的数目均为 1NA
9.实验室常用乙酸与过量的乙醇在浓硫酸催化下合成乙酸乙酯。下列说法正确的是
A.该反应的类型为加成反应
B.乙酸乙酯的同分异构体共有三种
�
C.可用饱和的碳酸氢钠溶液鉴定体系中是否有未反应的乙酸
D.该反应为可逆反应,加大乙醇的量可提高乙酸的转化率
评卷人
得分
二、多选题
10.一种镁氧电池如图所示,电极材料为金属镁和吸附氧气的活性炭,电解液为 KOH 浓
溶液。下列说法错误的是
A.电池总反应式为:2Mg+O2+2H2O=2Mg(OH)2
B.正极反应式为:Mg-2e-=Mg2+
C.活性炭可以加快 O2 在负极上的反应速率
D.电子的移动方向由 a 经外电路到 b
11.絮凝剂有助于去除工业和生活废水中的悬浮物。下列物质可作为絮凝剂的是
A.NaFe(SO4)2·6H2O
B.CaSO4·2H2O
C.Pb(CH3COO)2·3H2O
D.KAl(SO4)2·12H2O
12.炭黑是雾霾中的重要颗粒物,研究发现它可以活化氧分子,生成活化氧。活化过程
的能量变化模拟计算结果如图所示。活化氧可以快速氧化 SO2。下列说法正确的是
A.每活化一个氧分子吸收 0.29eV 能量
B.水可使氧分子活化反应的活化能降低 0.42eV
C.氧分子的活化是 O-O 的断裂与 C-O 键的生成过程
D.炭黑颗粒是大气中 SO2 转化为 SO3 的催化剂
试卷第 2页,总 7页
�
评卷人
得分
三、填空题
13.X、Y、Z 为短周期元素,X 原子的质子数等于 Z 与 Y 的质子数之和;Z 与 Y 位于同
一周期,Y 原子核外有 3 个未成对电子,非金属 Z 的一种固体单质可导电。回答下列问
题:
(1)Y 在周期表中的位置是第______周期第_____族,其原子结构示意图为
_______________;Y 与 Z 之间形成的化学键属于__________。
(2)X、Y、Z 三种元素中原子半径最大的是__________(填元素符号);X 单质既可与盐
酸反应,又可溶于氢氧化钠溶液,产生的气体为__________(填分子式),该气体与 Y 单
质反应的化学方程式为____________________________________。
(3)Z 的最高价氧化物的电子式为____________________。
评卷人
得分
四、解答题
14.铜是人类发现最早并广泛使用的一种金属。回答下列问题:
(1)实验室使用稀硫酸和 H2O2 溶解铜片,该反应的化学方程式为__________________。
(2)电子工业使用 FeCl3 溶液刻蚀印刷电路板铜箔,写出该过程的离子方程式
____________。配制的 FeCl3 溶液应保持_______(填“酸性”“碱性”或“中性”),原
因是_____________。
(3)溶液中 Cu2+的浓度可采用碘量法测得:
①2Cu2++5I―=2CuI↓+I3
- ②I3
- +2S2O3
2-=3I―+2S2O6
2-
反应①中的氧化剂为_____________。现取 20.00 mL 含 Cu2+的溶液,加入足量 KI 充分
反应后,用 0.1000 mol·L¯1 Na2S2O3 标准溶液滴定至终点,消耗 Na2S2O3 溶液 25.00 mL,
此溶液中 Cu2+的浓度为_______mol·L¯1。
评卷人
得分
五、推断题
15.二甲醚(CH3OCH3)是一种气体麻醉剂,可由“可燃冰”为原料合成。回答下列问题:
(1)B 为黄绿色气体,其化学名称为____________。
�
(2)由 A 和 B 生成 D 的化学方程式为__________________。
(3)E 的结构简式为____________。
(4)由 E 生成二甲醚的反应类型为______________________。
(5)二甲醚的同分异构体的结构简式为_____________。
评卷人
得分
六、综合题
16.过氧化氢(H2O2)是重要的化工产品,广泛应用于绿色化学合成.医疗消毒等领域。
回答下列问题:
(1)已知:H2(g)+ O2(g)=H2O(l)
△H1=-286 kJ·mol¯1
H2(g)+O2(g)=H2O2(l) △H2=-188 kJ·mol¯1
过氧化氢分解反应 2H2O2(l)=2H2O(l)+O2(g)的△H=______kJ·mol¯1。不同温度下过氧
化氢分解反应的平衡常数 K(313K)_____K(298K) (填大于、小于或等于)。
(2)100℃时,在不同金属离子存在下,纯过氧化氢 24 h 的分解率见下表:
离子
无
Al3+
Zn2+
加入量
(mg·L¯1)
分解率% 离子
加入量
(mg·L¯1)
分解率%
0
10
10
2
2
10
Fe3+
Cu2+
Cr3+
1.0
0.1
0.1
15
86
96
由上表数据可知,能使过氧化氢分解反应活化能降低最多的离子是_______。贮运过氧
化氢时,可选用的容器材质为_________(填标号)。
A.不锈钢
B.纯铝
C.黄铜
D.铸铁
(3)过氧化氢的 Ka1=2.24×10¯12,H2O2 的酸性________H2O (填大于、小于或等于)。
研究表明,过氧化氢溶液中 HO2
-的浓度越大,过氧化氢的分解速率越快。常温下,不同
浓度的过氧化氢分解率与 pH 的关系如图所示。一定浓度的过氧化氢,pH 增大分解率增
大的原因是___________________:相同 pH 下,过氧化氢浓度越大分解率越低的原因是
__________________________________________。
试卷第 4页,总 7页
�
17.I.下列氯代烃中不能由烯烃与氯化氢加成直接得到的有__________
A.氯代环己烷
B.2,2-二甲基-1-氯丙烷
C.2-甲基-2-氯丙烷
D.2,2,3,3-四甲基-1-氯丁烷
II.盐酸美西律(E)是一种抗心律失常药,其一条合成路线如下:
回答下列问题:
(1)已知 A 的分子式为 C8H10O,其化学名称为_______________。
(2)B 中的官能团的名称为____________________。
(3)由 A 生成 C 的化学反应方程式为_________________________,反应类型是_______。
(4)由 D 的结构可判断,D 应存在立体异构。该立体异构体的结构简式为
________________。
(5)若用更为廉价易得的氨水替代盐酸羟氨(NH2OH·HCl)与 C 反应,生成物的结构简
式为_____________________。
(6)A 的同分异构体中能与三氯化铁溶液发生显色反应的还有_______种;其中核磁共
振氢谱为 4 组峰,峰面积比为 6︰2︰1︰1 的结构简式为__________。
18.I.下列元素或化合物的性质变化顺序正确的是_______________
A.第一电离能:Cl>S>P>Si
B.共价键的极性:HF>HCI>HBr>HI
C.晶格能:NaF>NaCl>NaBr>NaI
D.热稳定性:MgCO3>CaCO3>SrCO3>BaCO3
II.黄铜矿是主要的炼铜原料,CuFeS2 是其中铜的主要存在形式。回答下列问题:
(1)CuFeS2 中存在的化学键类型是________________。下列基态原子或离子的价层电
子排布图正确的_____________。
(2)在较低温度下 CuFeS2 与浓硫酸作用时,有少量臭鸡蛋气味的气体 X 产生。
①X 分子的立体构型是______,中心原子杂化类型为__________,属于_______(填“极
性”或“非极性”)分子。
②X 的沸点比水低的主要原因是____________________。
(3)CuFeS2 与氧气反应生成 SO2,SO2 中心原子的价层电子对数为_____,共价键的类型
�
有_________。
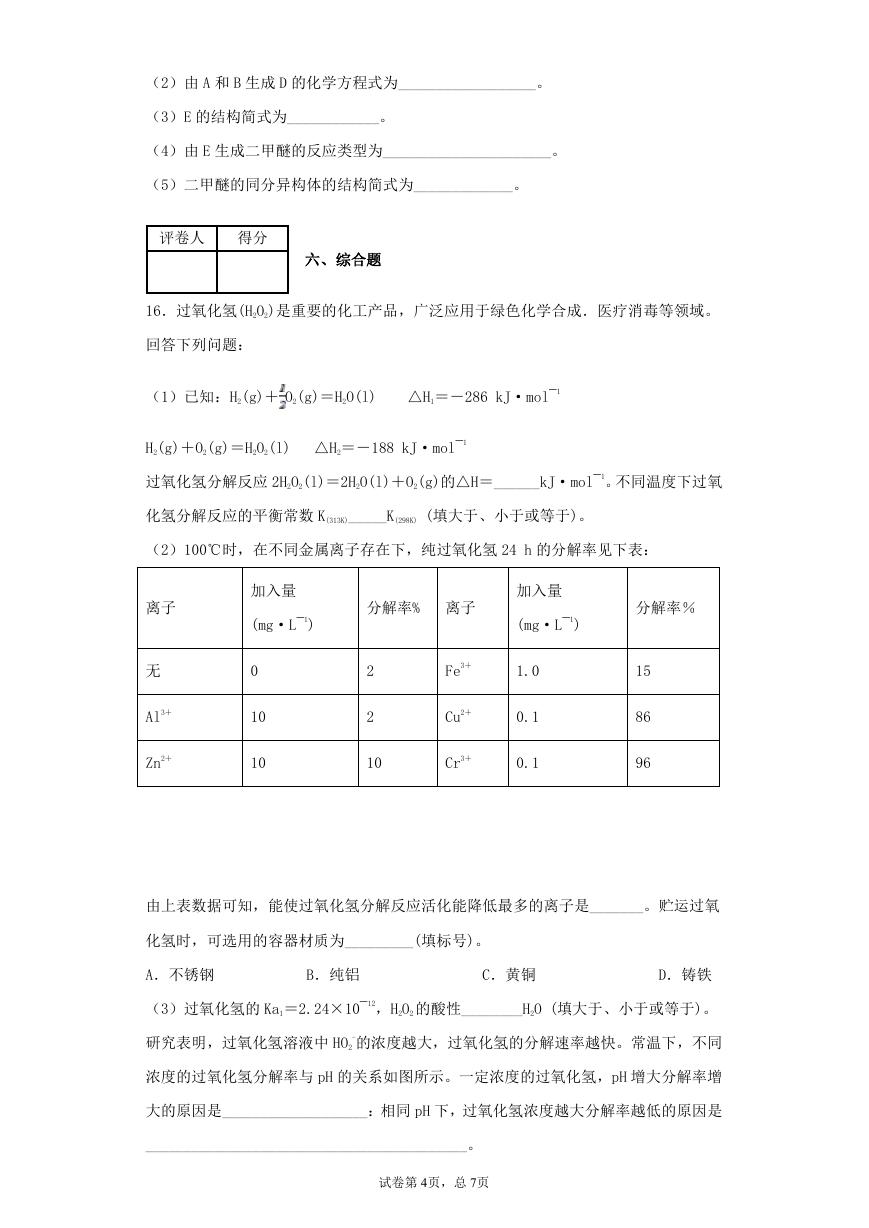
(4)四方晶系 CuFeS2 晶胞结构如图所示。
①Cu+的配位数为__________,S2-的配位数为____________。
②已知:a=b=0.524 nm,c=1.032 nm,NA 为阿伏加德罗常数的值,CuFeS2 晶体的密
度是________g•cm-3(列出计算式)。
评卷人
得分
七、实验题
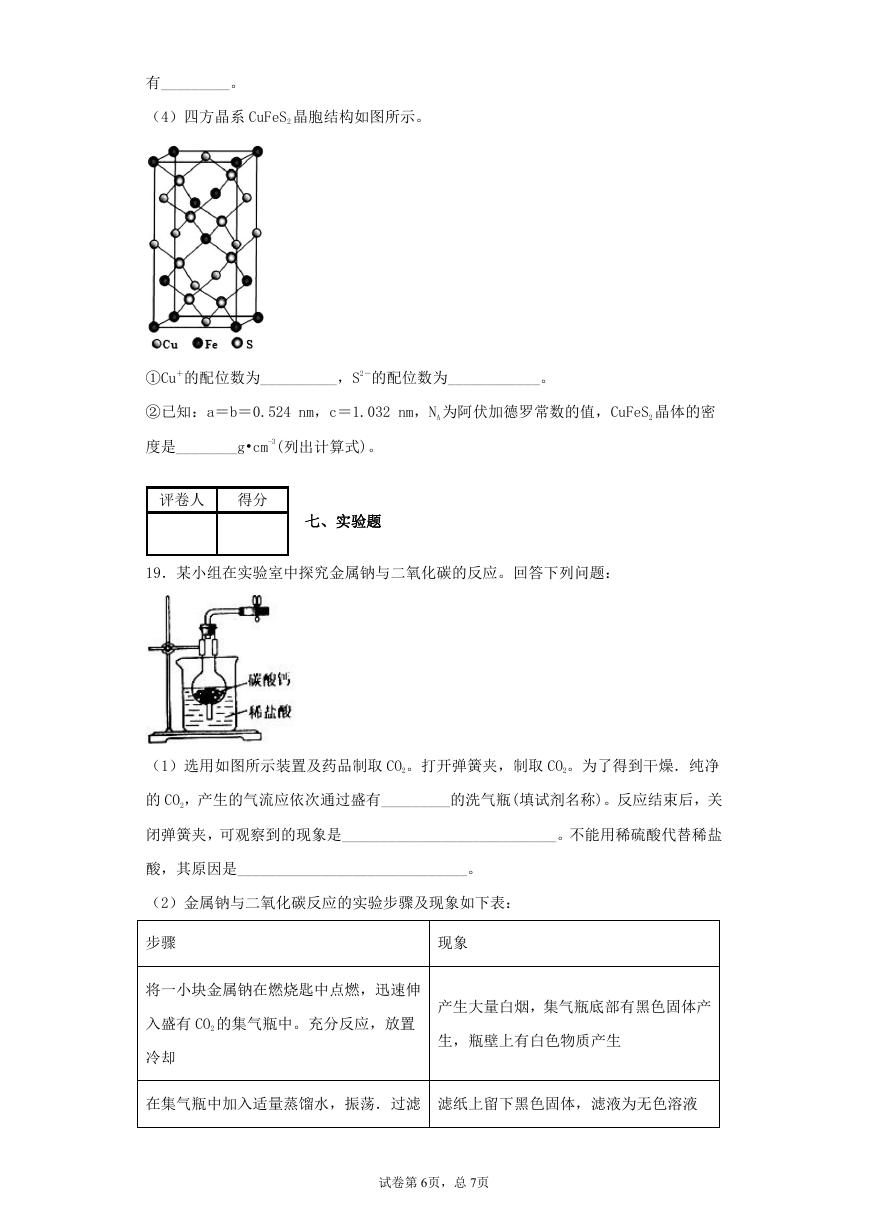
19.某小组在实验室中探究金属钠与二氧化碳的反应。回答下列问题:
(1)选用如图所示装置及药品制取 CO2。打开弹簧夹,制取 CO2。为了得到干燥.纯净
的 CO2,产生的气流应依次通过盛有_________的洗气瓶(填试剂名称)。反应结束后,关
闭弹簧夹,可观察到的现象是____________________________。不能用稀硫酸代替稀盐
酸,其原因是______________________________。
(2)金属钠与二氧化碳反应的实验步骤及现象如下表:
步骤
现象
将一小块金属钠在燃烧匙中点燃,迅速伸
入盛有 CO2 的集气瓶中。充分反应,放置
冷却
产生大量白烟,集气瓶底部有黑色固体产
生,瓶壁上有白色物质产生
在集气瓶中加入适量蒸馏水,振荡.过滤 滤纸上留下黑色固体,滤液为无色溶液
试卷第 6页,总 7页
�
①为检验集气瓶瓶壁上白色物质的成分,取适量滤液于 2 支试管中,向一支试管中滴加
1 滴酚酞溶液,溶液变红:向第二支试管中滴加澄清石灰水,溶液变浑浊。
据此推断,白色物质的主要成分是________(填标号)。
A.Na2O
B.Na2O2 C.NaOH
D.Na2CO3
②为检验黑色固体的成分,将其与浓硫酸反应,生成的气体具有刺激性气味。据此推断
黑色固体是________________。
③本实验中金属钠与二氧化碳反应的化学方程式为_______________________。
�
�














 2023年江西萍乡中考道德与法治真题及答案.doc
2023年江西萍乡中考道德与法治真题及答案.doc 2012年重庆南川中考生物真题及答案.doc
2012年重庆南川中考生物真题及答案.doc 2013年江西师范大学地理学综合及文艺理论基础考研真题.doc
2013年江西师范大学地理学综合及文艺理论基础考研真题.doc 2020年四川甘孜小升初语文真题及答案I卷.doc
2020年四川甘孜小升初语文真题及答案I卷.doc 2020年注册岩土工程师专业基础考试真题及答案.doc
2020年注册岩土工程师专业基础考试真题及答案.doc 2023-2024学年福建省厦门市九年级上学期数学月考试题及答案.doc
2023-2024学年福建省厦门市九年级上学期数学月考试题及答案.doc 2021-2022学年辽宁省沈阳市大东区九年级上学期语文期末试题及答案.doc
2021-2022学年辽宁省沈阳市大东区九年级上学期语文期末试题及答案.doc 2022-2023学年北京东城区初三第一学期物理期末试卷及答案.doc
2022-2023学年北京东城区初三第一学期物理期末试卷及答案.doc 2018上半年江西教师资格初中地理学科知识与教学能力真题及答案.doc
2018上半年江西教师资格初中地理学科知识与教学能力真题及答案.doc 2012年河北国家公务员申论考试真题及答案-省级.doc
2012年河北国家公务员申论考试真题及答案-省级.doc 2020-2021学年江苏省扬州市江都区邵樊片九年级上学期数学第一次质量检测试题及答案.doc
2020-2021学年江苏省扬州市江都区邵樊片九年级上学期数学第一次质量检测试题及答案.doc 2022下半年黑龙江教师资格证中学综合素质真题及答案.doc
2022下半年黑龙江教师资格证中学综合素质真题及答案.doc