2017 年江苏南京中考化学真题及答案
一、选择题(本题共 15 小题,每小题只有一个选型符合题意。每小题 2 分,共 30 分)
1.地壳中含量最多的元素是
[A.氧 B.硅 C.铝 D.钙
2.物质的下列性质中,属于化学性质的是
A.颜色 B.状态 C.熔点
D.氧化性
3.下列图标中表示禁止吸烟的是
A.
B.
C.
D.
4.下列金属中,金属活动性最弱的是
A.金
B.银
C.铜
D.铁
5.能用酒精灯直接加热的仪器是
A.漏斗
B.量筒
C.试管
D.烧杯
6.我国科技创新成果卓越,下列成果中获得诺贝尔奖的是
A.侯德榜发明联合制碱法
B.屠呦呦发现抗疟新药青蒿素
C. 闵恩泽研发石油炼制催化剂
D.张青莲主持测定了几种元素相对原子质量的新值
7.下列物质由分子构成的是
A.锌 B.硫酸铜 C.C60
D.金刚石
8.下列行为会增加空气中 PM2.5 的是
A.治理工地扬尘
C. 使用公共自行车
B. 露天焚烧垃圾
D.禁止焚烧秸杆
9.下列关于干冰升华过程的说法正确的是
A.二氧化碳分子的体积变大
B. 二氧化碳分子的质量变小
C.二氧化碳分子的种类改变
D.二氧化碳分子间的间隔变大
10.实验室制取某些气体的装置如图。下列说法正确的是
�
A.装置①和⑤组合可以用来制取氧气
B.装置②和③组合可以用来制取氢
气
C.装置②和④组合可以用来制取二氧化碳
D.装置②可以较好地控制反应速率
11.下列材料中属于复合材料的是
A.不锈钢
B.聚氯乙烯
C.玻璃钢
D.天然橡胶
12.下列叙述不正确的是
A.用蒸馏的方法,可以得到净化程度较高的水
B.用食醋浸泡鸡蛋的方法,可以制得无壳鸡蛋
C.用灼烧闻气味的方法,可以试分棉制品和羊毛制品
D.用喷水的方法,可以扑灭所有物质燃烧引起的火灾
13.下列各组离子在水中能大量共存的是
A.Cu2+、Na+、Cl-、OH-
B.H+、K+、NO3
-、SO4
2-
C.Na+、NH4
+、NO3
-、OH-
D.Ag+、Ba2+、NO3
-、Cl-
14.除去下列物质中混有的少甘杂质(括号内为杂质),拟定的实验方案不可行的是
A. FeCl2 溶液(CuCl2) ——加入过量的铁粉,过滤
B.KCl 固体(KClO3)——加入少量的二氧化锰,并加热
C.CO 气体(CO2)——通过足量的氢氧化钠溶液,并干燥
D. NaCl 溶液(MgCl2) ——加入过量的氢氧化钠溶液,过滤,滤液中加稀盐酸至中性
15.按右图所示装置,持续通入气态物质 X,可以看到玻璃管中有红色物质生成,无水 CuSO4
变蓝,澄清石灰水变浑浊,则 X 不可能是
A.氢气和水蒸气与
B.氢气和二氧化碳
C.一氧化碳和氛气
D.一氧化碳和水蒸气
二、(本题包括 2 小题,共 13 分)
16. (6 分)2017 年 5 月,我国首次海域可燃冰试采成功,可燃冰外观像冰,主要含有甲烷
水合物(由甲烷分子和水分子组成),还含少量二氧化碳等物质。
(1)可燃冰属于_______(填“纯净物”或“混合物”)。
(2)化学家在较低的温度和压力下,用甲烷等为原料制成了金刚石薄膜,该变化属于
_____(填“物理变化”或‘化学变化”)。
(3)甲烷(CH4)可用作燃料,其充分燃烧的化学方程式为_________。
�
(4)常温常压时,由甲烷和另两种气体组成的混合物中,碳元素的质量分数为 80%,则
另两种气体可能是________。
A.H2 和 CO
B. H2 和 C2H2
C. C2H2 和 C2H4
D.CO 和 C2H4
17. (7 分)溶液在生产、生活中起着十分重要的作用。请回答下列问题:
(1)可以作为溶质的是_________。
A.只有固体 B.只有液体 C.只有气体 D.气体、液体、固体都可以
(2)配制 100g 质量分数为 16%的氯化钠溶液,所需氯化钠的质量为________,水的体
积为________mL (水的密度近似看作 1g/cm3)。
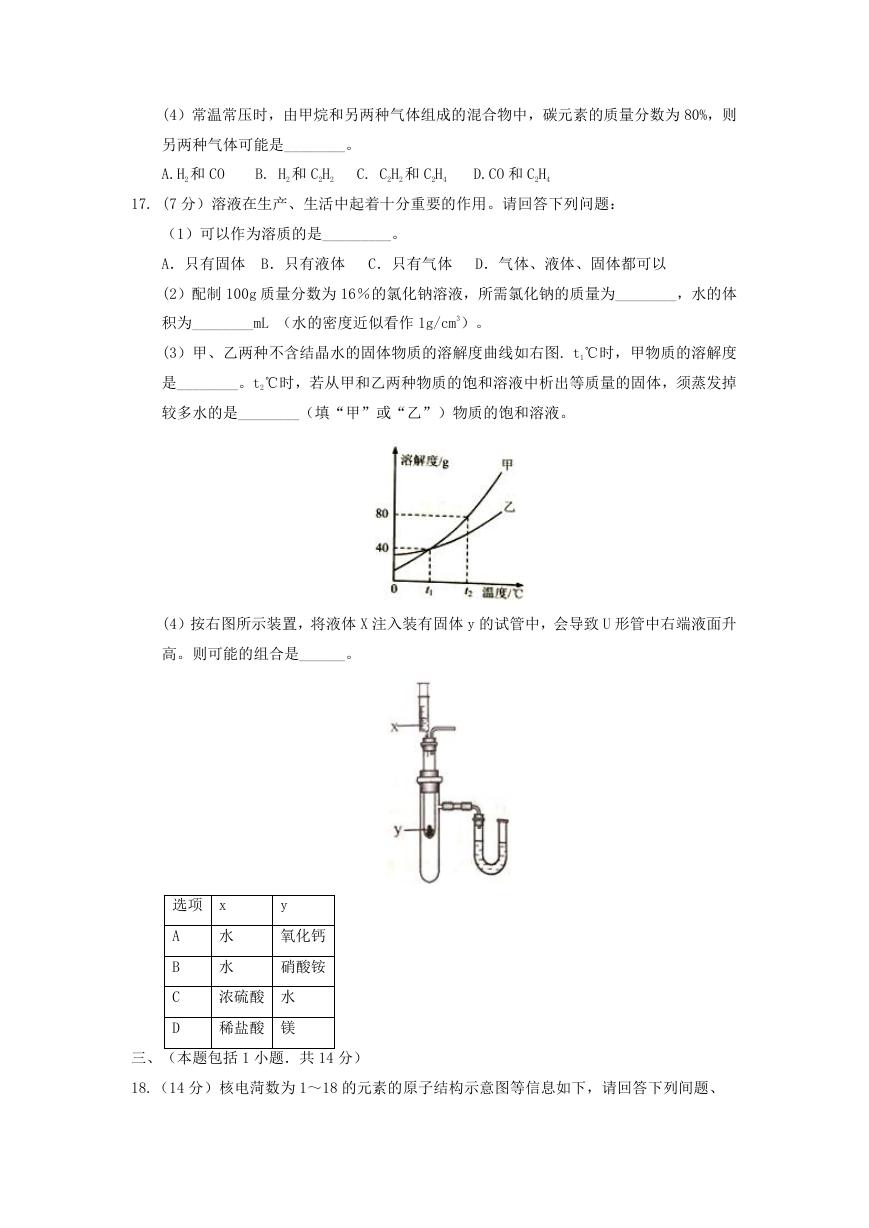
(3)甲、乙两种不含结晶水的固体物质的溶解度曲线如右图. t1℃时,甲物质的溶解度
是________。t2℃时,若从甲和乙两种物质的饱和溶液中析出等质量的固体,须蒸发掉
较多水的是________(填“甲”或“乙”)物质的饱和溶液。
(4)按右图所示装置,将液体 X 注入装有固体 y 的试管中,会导致 U 形管中右端液面升
高。则可能的组合是______。
选项 x
y
A
B
C
D
水
水
氧化钙
硝酸铵
浓硫酸 水
稀盐酸 镁
三、(本题包括 1 小题.共 14 分)
18.(14 分)核电菏数为 1~18 的元素的原子结构示意图等信息如下,请回答下列间题、
�
(1)2017 年 5 月 9 日,中国科学院等单位联合发布了 115 号元素的中文名为“镆”。
此元素原子的核电荷数为______,核外电子数为______。
(2)在第三周期中,随着原子序数的递增,元素原子核外电子排布的变化规律是
_________。
(3)利用上表中给出的元素,写出含有氮元素的常见单质、氧化物、酸、键、盐的化
学式各一个,并标出所写化学式中氮元素的化合价:单质______、氧化物______、酸
______、碱______、盐______。
(4)以钠和氯为例,简述结构与性质的关系。________________________。
(5)国产 C919 大型客机上使用了大量的铝合金。工业上用电解氧化铝(Al2O3)得到铝和
氧气、试计算电解 102t 氧化铝最多能生成铝的质量是多少?(在答题卡上写出计算过
程)
四、(本题包括 2 小题,共 12 分)
19.(5 分)空气中氧气含量测定的经典赏析。
教材中介绍了拉瓦锡用定量的方法研究了空气的成分(实验装置如图)。
(1)写出汞与氧气反应的化学方程式_________________。
(2)本实验中选择使用汞的优点有:
①汞在加热的条件下,只和氧气反应。②汞为液态,在汞槽中起到液封的作用,并能直
接用来测见反应器内空间体积的变化。
③生成的氧化汞分解又能得到汞和氧气中,把得到的氧气加到剩下的 4/5 体积的气体
中,结果所得气体跟空气的性质完全一样。
根据资料卡片,请再补充本实验使用汞的两个优点,并说明依据。
�
④_____________。 ⑤_____________。
(3)通过实验,拉瓦锡得出了空气由氧气和氮气组成,其中氧气约占空气总体积 1/5
的结论。请根据现在的认识,对此结论予以补充。_________________________________。
20. (7 分)右图中 A-I 表示初中化学常见的物质,且分别是由一种或两种元家组成:其中 A、
B、D、H 均为单质;F 可用作大棚蔬菜生产中的气体肥料;H 在 B、F、G 存在的情况下
可以生成铜绿[铜绿主要成分为 Cu2(OH)2CO3]。图中“--”表示两端的物质间能发生化学
反应:“→” 表示物质间存在转化关系;部分反应物、生成物或反应条件已略去。
(1)写出化学式:F______, H_______。
(2)实验室常用 E 制取 B,写出该反应的化学方程式__________________。
(3)反应①和②的基本反应类型相同,该基本反应类型是____________。
(4) 写出 A→C 反应的化学方程式_________________。
五、(本题包括 1 小题,共 11 分)
21.(11 分)兴趣小组的同学对碳酸氢钠、碳酸钠、氢氧化钠的某些性质进行相关探究。
【提出问题】它们溶液的酸碱性及与酸反应时溶液的 pH 如何变化?
【实验探究 1】向等体积、等浓度的碳酸氢钠、碳酸钠、氢氧化钠溶液中,分别加入几
滴紫甘蓝汁液,同时用蒸馏水进行对比实验,观察并记录现象如下:
液体名称
蒸馏水 碳酸氢钠溶液 碳酸钠溶液 氢氧化钠溶液
紫甘蓝汁液显示的颜色 蓝紫色 蓝色
绿色
黄色
查阅资料:
pH
7.5~9
10~11.9
12~14
紫甘蓝汁液显示的颜色 蓝色
绿色
黄色
【得出结论 1】三种溶液的碱性由强到弱的顺序为________________。
【实验探究 2】甲同学在烧杯溶液中加入约 5mL 稀氢氧化钠溶液,滴入几滴酚酞溶液,
此时溶液由_____色变为____色。向其中加入稀盐酸,该反应的化学方程式为
__________________。
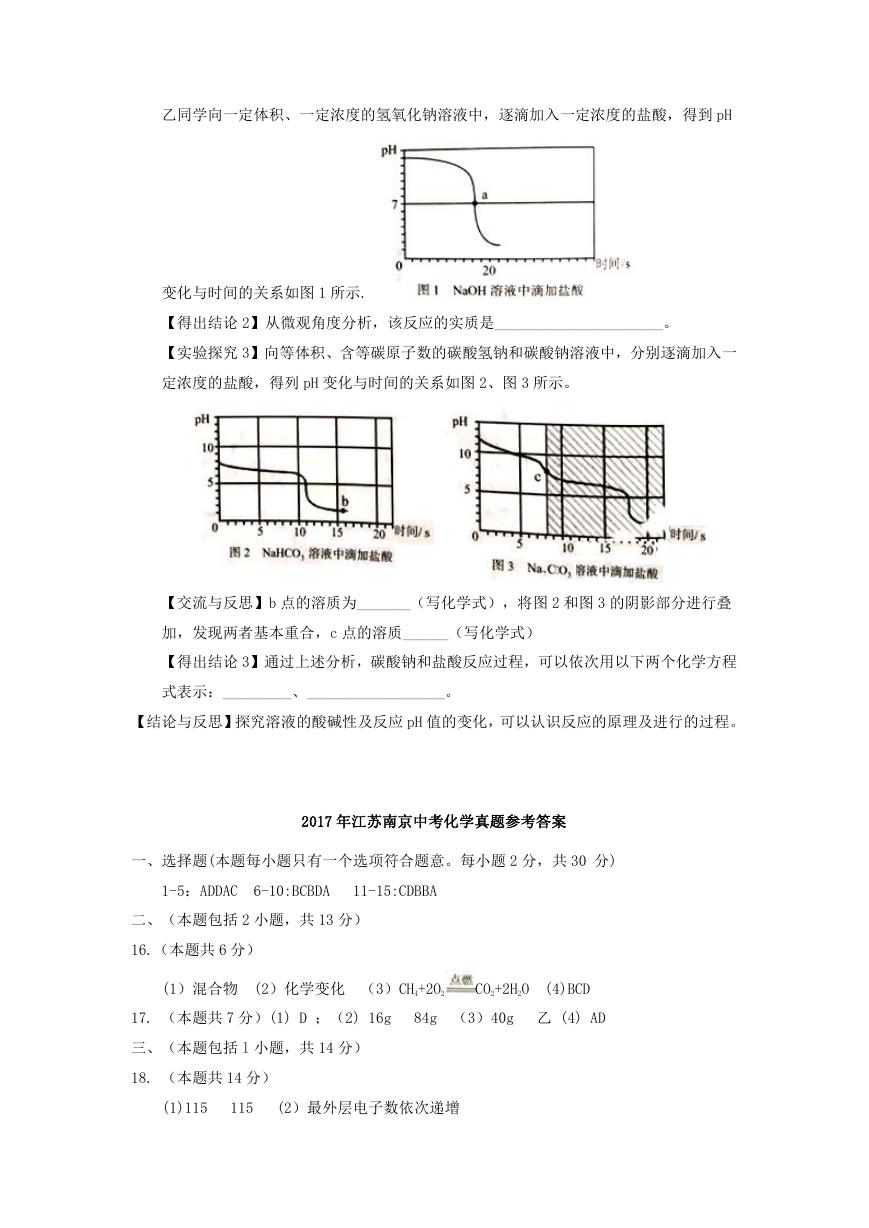
�
乙同学向一定体积、一定浓度的氢氧化钠溶液中,逐滴加入一定浓度的盐酸,得到 pH
变化与时间的关系如图 1 所示.
【得出结论 2】从微观角度分析,该反应的实质是______________________。
【实验探究 3】向等体积、含等碳原子数的碳酸氢钠和碳酸钠溶液中,分别逐滴加入一
定浓度的盐酸,得列 pH 变化与时间的关系如图 2、图 3 所示。
【交流与反思】b 点的溶质为_______(写化学式),将图 2 和图 3 的阴影部分进行叠
加,发现两者基本重合,c 点的溶质______(写化学式)
【得出结论 3】通过上述分析,碳酸钠和盐酸反应过程,可以依次用以下两个化学方程
式表示:_________、__________________。
【结论与反思】探究溶液的酸碱性及反应 pH 值的变化,可以认识反应的原理及进行的过程。
2017 年江苏南京中考化学真题参考答案
一、选择题(本题每小题只有一个选项符合题意。每小题 2 分,共 30 分)
1-5:ADDAC
6-10:BCBDA
11-15:CDBBA
二、(本题包括 2 小题,共 13 分)
16.(本题共 6 分)
(1)混合物 (2)化学变化 (3)CH4+2O2
CO2+2H2O
(4)BCD
17. (本题共 7 分)(1) D ;(2) 16g
84g (3)40g 乙 (4) AD
三、(本题包括 l 小题,共 14 分)
18. (本题共 14 分)
(1)115
115
(2)最外层电子数依次递增
�
(3)
(4) (问答要点)最外层电子数、得失电子与化学性质之间的关系
(5)54t
四、(本题包括 2 小题,共 12 分)
19.(本题共 5 分)
(1)2Hg+O2
2HgO (2) 汞的沸点较低,汞蒸气与氧气反应比较充分,能将密闭装
置内空气中的氧气几乎耗尽。氧化汞的密度小于汞,且不溶于汞,因此易与汞分离。
(其他合理答案均给分)
(3)空气的成分按体积计大约是:氧气 21%、氮气 78%、稀有气体等其他成分 1%。
20. (本题共 7 分)
(1) CO2
Cu
(2) 2H2O2
2H2O+O2↑ (3)置换反应 (4) H2+Cl2
2HCl
五、(本题包括 l 小题,共 11 分)
21. (本题共 11 分)
【得出结论 1】氢氧化钠溶液>碳酸钠溶液>碳酸氢钠溶液
【实验探究 2】无 红 NaOH+HCl=NaCl+H2O
pH=7,恰好完全反应
【得出结论 2】 氢离子和氢氧根离子结合生成水分子
【交流与反思】NaCl、HCl NaCl、NaHCO3
【得出结论 3】Na2CO3+ HCl=NaCl+ NaHCO3 NaHCO3+NaOH= Na2CO3+ H2O
�












 2023年江西萍乡中考道德与法治真题及答案.doc
2023年江西萍乡中考道德与法治真题及答案.doc 2012年重庆南川中考生物真题及答案.doc
2012年重庆南川中考生物真题及答案.doc 2013年江西师范大学地理学综合及文艺理论基础考研真题.doc
2013年江西师范大学地理学综合及文艺理论基础考研真题.doc 2020年四川甘孜小升初语文真题及答案I卷.doc
2020年四川甘孜小升初语文真题及答案I卷.doc 2020年注册岩土工程师专业基础考试真题及答案.doc
2020年注册岩土工程师专业基础考试真题及答案.doc 2023-2024学年福建省厦门市九年级上学期数学月考试题及答案.doc
2023-2024学年福建省厦门市九年级上学期数学月考试题及答案.doc 2021-2022学年辽宁省沈阳市大东区九年级上学期语文期末试题及答案.doc
2021-2022学年辽宁省沈阳市大东区九年级上学期语文期末试题及答案.doc 2022-2023学年北京东城区初三第一学期物理期末试卷及答案.doc
2022-2023学年北京东城区初三第一学期物理期末试卷及答案.doc 2018上半年江西教师资格初中地理学科知识与教学能力真题及答案.doc
2018上半年江西教师资格初中地理学科知识与教学能力真题及答案.doc 2012年河北国家公务员申论考试真题及答案-省级.doc
2012年河北国家公务员申论考试真题及答案-省级.doc 2020-2021学年江苏省扬州市江都区邵樊片九年级上学期数学第一次质量检测试题及答案.doc
2020-2021学年江苏省扬州市江都区邵樊片九年级上学期数学第一次质量检测试题及答案.doc 2022下半年黑龙江教师资格证中学综合素质真题及答案.doc
2022下半年黑龙江教师资格证中学综合素质真题及答案.doc