2017 浙江省宁波市中考化学真题及答案
一、选择题
1.下列实验操作符合安全要求的是(
)
A.
点燃酒精灯 B.
转移蒸发皿 C.
加热液体
D.
稀释浓硫酸
2.真空包装、食品包装内充氮气、放铁粉包或生石灰包等都是常用的食品防腐、保鲜方法,
对上述方法的分析,错误的是(
)
A.真空包装:能使食品不与氧气接触
B.充氮气:能隔绝空气并防止食品变形
C.放铁粉包:能除去食品包装袋内的氧气和水蒸气
D.放生石灰包:能除去食品包装袋内的氧气
3 . 如 图 是 物 质 甲 和 乙 反 应 生 成 丙 的 微 观 示 意 图 , 下 列 说 法 正 确 的 是 (
)
A.该化学反应属于化合反应
B.甲和乙属于单质,丙属于化合物
C.参加反应的甲与乙的分子个数比为 1:1
D.1 个丙分子由 1 个甲分子和 2 个乙分子构成
4.有 A、B 两种酸碱指示剂,它们显示的颜色与溶液 pH 的关系如图,它们在甲溶液和乙溶
�
液中显示的颜色如表,下列判断错误的是(
)
溶液
指示剂
A
B
甲
黄色
无色
乙
蓝色
粉红色
A.甲溶液呈酸性
B.乙溶液的 pH 可能为 11
C.只用 A 指示剂就可鉴别甲溶液、乙溶液和蒸馏水三种液体
D.在滴有 A 指示剂的甲溶液中不断地加入乙溶液,最后溶液一定呈绿色
5.某废液中只含有 Fe(NO3)2、Cu(NO3)2、Ba(NO3)2 三种溶质,为了回收金属、保护环
境,小科设计了如图方案(所加试剂均过量),下列判断正确的是(
)
A.固体 a 是铜
B.X 一定是 Na2SO4
C.溶液 B 中含有的盐有 Ba(NO3)2、NaNO3
D.若回收到 6.4g 固体 a,则加入的铁屑质量为 5.6g
二、填空题
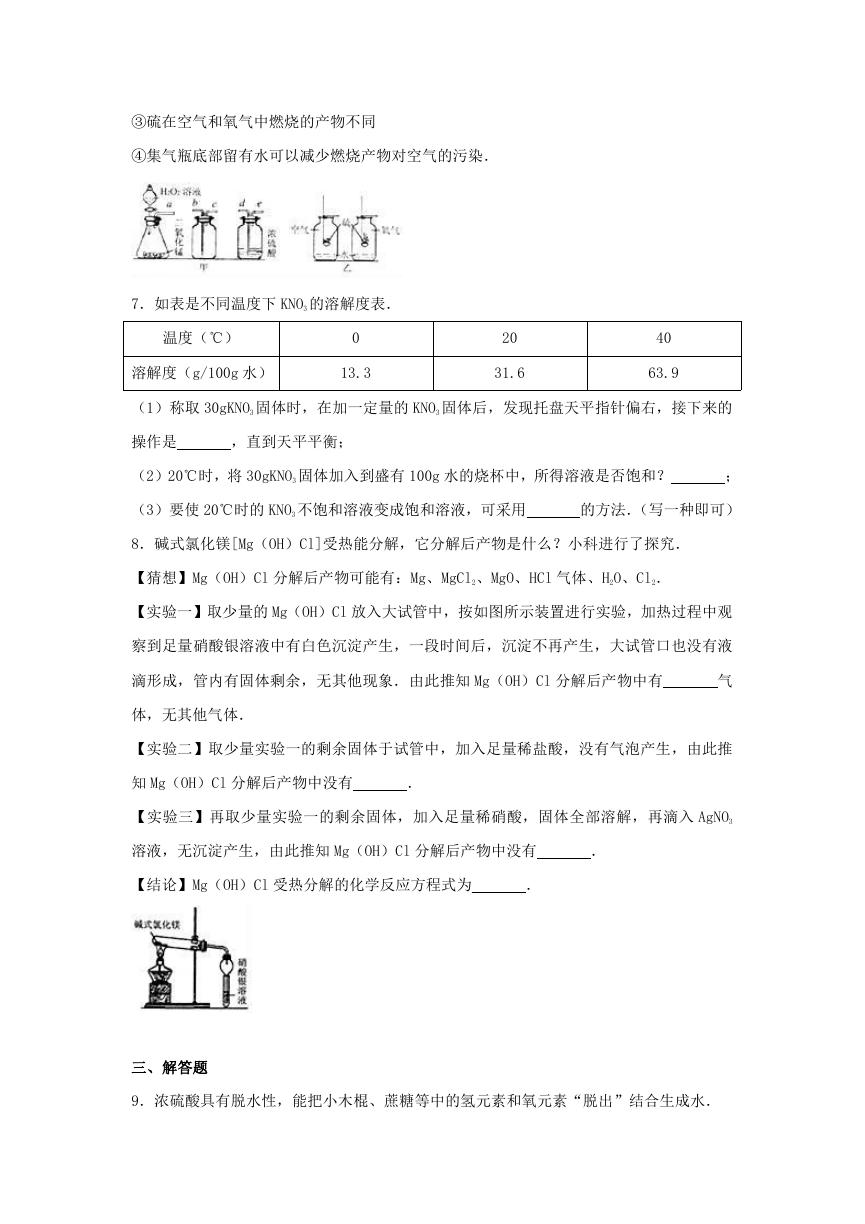
6.根据氧气的制取和性质的相关知识,回答下列问题:
(1)图甲装置中二氧化锰的作用是
;
(2)要获得一瓶干燥的氧气,图甲装置中导管的连接顺序为 a→
;
(3)下列关于硫燃烧实验(如图乙)的相关描述合理的有
(填序号);
①硫在空气中燃烧产生淡蓝色火焰
②硫燃烧是剧烈氧化的现象
�
③硫在空气和氧气中燃烧的产物不同
④集气瓶底部留有水可以减少燃烧产物对空气的污染.
7.如表是不同温度下 KNO3 的溶解度表.
温度(℃)
溶解度(g/100g 水)
0
13.3
20
31.6
40
63.9
(1)称取 30gKNO3 固体时,在加一定量的 KNO3 固体后,发现托盘天平指针偏右,接下来的
操作是
,直到天平平衡;
(2)20℃时,将 30gKNO3 固体加入到盛有 100g 水的烧杯中,所得溶液是否饱和?
;
(3)要使 20℃时的 KNO3 不饱和溶液变成饱和溶液,可采用
的方法.(写一种即可)
8.碱式氯化镁[Mg(OH)Cl]受热能分解,它分解后产物是什么?小科进行了探究.
【猜想】Mg(OH)Cl 分解后产物可能有:Mg、MgCl2、MgO、HCl 气体、H2O、Cl2.
【实验一】取少量的 Mg(OH)Cl 放入大试管中,按如图所示装置进行实验,加热过程中观
察到足量硝酸银溶液中有白色沉淀产生,一段时间后,沉淀不再产生,大试管口也没有液
滴形成,管内有固体剩余,无其他现象.由此推知 Mg(OH)Cl 分解后产物中有
气
体,无其他气体.
【实验二】取少量实验一的剩余固体于试管中,加入足量稀盐酸,没有气泡产生,由此推
知 Mg(OH)Cl 分解后产物中没有
.
【实验三】再取少量实验一的剩余固体,加入足量稀硝酸,固体全部溶解,再滴入 AgNO3
溶液,无沉淀产生,由此推知 Mg(OH)Cl 分解后产物中没有
.
【结论】Mg(OH)Cl 受热分解的化学反应方程式为
.
三、解答题
9.浓硫酸具有脱水性,能把小木棍、蔗糖等中的氢元素和氧元素“脱出”结合生成水.
�
(1)用小木棍蘸取浓硫酸少许,一段时间后,小木棍上出现的实验现象是
.
(2)在蔗糖(C12H22O11)分子中,氢、氧原子个数比是
,如果蔗糖完全脱水,则生
成 C 和 H2O 的质量比是
.
10.宁波开展“剿灭劣 V 类水体”攻坚,2017 年 3 月起,对月湖水域进行清淤,重构月湖
水生态.
(1)清淤前,技术人员需对月湖淤泥中的氮、磷等元素含量进行检测,因为氮、磷元素含
量偏高会导致水体
,可能造成污染.
(2)清淤时,技术人员以淤泥进行固化处理,产生的“泥饼”制成营养土或绿色肥料,“泥
饼”中的
元素能促进植物茎叶茂盛、叶色浓绿.
11.实验室有一瓶碳酸钙和氯化钙粉末组成的均匀混合物,小科用相同溶质质量分数的稀
盐酸和该混合物反应(所得溶液均为不饱和溶液),四组实验数据记录如表,请分析计算:
三
100.0
9.0
105.0
m
四
100.0
12.0
a
n
实验组别
一
稀盐酸质量/g
100.0
混合物质量/g
3.0
所得溶液质量/g
101.9
剩余固体质量/g
0
二
100.0
6.0
103.8
0
(1)反应后,稀盐酸还有剩余的是第
组;
(2)求混合物中碳酸钙和氯化钙质量之比;
(3)表中 a 的值为
;
(4)求表中 m 的值.
�
2017 年浙江省宁波市中考化学试卷
参考答案与试题解析
一、选择题
1.下列实验操作符合安全要求的是(
)
A.
点燃酒精灯 B.
转移蒸发皿 C.
加热液体
D.
稀释浓硫酸
【考点】4I:蒸发与蒸馏操作;44:加热器皿﹣酒精灯;4B:给试管里的液体加热;4D:
浓硫酸的性质及浓硫酸的稀释.
【分析】A、使用酒精灯时要注意“两查、两禁、一不可”.
B、根据蒸发操作的注意事项进行分析判断.
C、根据给试管中的液体加热的方法进行分析判断.
D、根据浓硫酸的稀释方法(酸入水,沿器壁,慢慢倒,不断搅)进行分析判断.
【解答】解:A、使用酒精灯时要注意“两查、两禁、一不可”,禁止用一酒精灯去引燃另
一酒精灯,图中所示操作错误.
B、正在加热的蒸发皿温度较高,为防止烫伤手,不能用手直接拿热的蒸发皿,应用坩埚钳
夹取,图中所示操作错误.
C、给试管中的液体加热时,用酒精灯的外焰加热试管里的液体,且液体体积不能超过试管
�
容积的 ,图中所示操作正确.
D、稀释浓硫酸时,要把浓硫酸缓缓地沿器壁注入水中,同时用玻璃棒不断搅拌,以使热量
及时地扩散;一定不能把水注入浓硫酸中;图中所示操作错误.
故选:C.
2.真空包装、食品包装内充氮气、放铁粉包或生石灰包等都是常用的食品防腐、保鲜方法,
对上述方法的分析,错误的是(
)
A.真空包装:能使食品不与氧气接触
B.充氮气:能隔绝空气并防止食品变形
C.放铁粉包:能除去食品包装袋内的氧气和水蒸气
D.放生石灰包:能除去食品包装袋内的氧气
【考点】2D:食品干燥剂、保鲜剂和真空包装的成分探究;6K:常见气体的用途;8G:金
属锈蚀的条件及其防护;8L:生石灰的性质与用途.
【分析】A、真空包装是抽取其中的空气,使食品因无氧气而不会氧化,并且其中的微生物
或者细菌等也因无法进行呼吸作用而窒息而死亡.
B、根据氮气的化学性质不活泼,进行分析判断.
C、根据铁粉能吸收氧气和水蒸气,进行分析判断.
D、根据生石灰的化学性质,进行分析判断.
【解答】解:A、真空包装是抽取其中的空气,使食品因无氧气而不会氧化,能使食品不与
氧气接触,故选项说法正确.
B、氮气的化学性质不活泼,充氮气能隔绝空气并防止食品变形,故选项说法正确.
C、铁粉发生锈蚀能吸收氧气和水蒸气,放铁粉包能除去食品包装袋内的氧气和水蒸气,故
选项说法正确.
D、生石灰能与水反应生成氢氧化钙,放生石灰包能除去食品包装袋内的水蒸气,故选项说
法错误.
故选:D.
3 . 如 图 是 物 质 甲 和 乙 反 应 生 成 丙 的 微 观 示 意 图 , 下 列 说 法 正 确 的 是 (
)
�
A.该化学反应属于化合反应
B.甲和乙属于单质,丙属于化合物
C.参加反应的甲与乙的分子个数比为 1:1
D.1 个丙分子由 1 个甲分子和 2 个乙分子构成
【考点】B3:微粒观点及模型图的应用;A3:从组成上识别氧化物;A7:单质和化合物的
判别;FA:反应类型的判定.
【分析】根据微观示意图分析反应物、生成物的化学式,根据反应写出反应的化学方程式.根
据化学式、方程式的意义计算、分析、判断有关的问题.
【解答】解:由反应的微观示意图可知,该反应是二氧化碳和氢气在一定条件下反应生成
了甲醇和水,反应的方程式是:CO+2H2
CH3OH.
A、由上述方程式可知,该反应是两种物质反应,生成一种物质,属于化合反应,故正确;
B、甲、丙都是由不同种原子构成的物质,属于化合物,乙是由同种原子构成的物质,属于
单质,故错误;
C、由上述方程式可知,参加反应的甲和乙的分子个数比为 1:2.故错误;
D、由上述方程式可知,1 个丙分子由 1 个碳原子、一个氧原子和 4 个氢原子构成,故错误.
故选:A.
4.有 A、B 两种酸碱指示剂,它们显示的颜色与溶液 pH 的关系如图,它们在甲溶液和乙溶
液中显示的颜色如表,下列判断错误的是(
)
溶液
指示剂
A
B
甲
黄色
无色
乙
蓝色
粉红色
A.甲溶液呈酸性
�
B.乙溶液的 pH 可能为 11
C.只用 A 指示剂就可鉴别甲溶液、乙溶液和蒸馏水三种液体
D.在滴有 A 指示剂的甲溶液中不断地加入乙溶液,最后溶液一定呈绿色
【考点】91:酸碱指示剂及其性质;99:溶液的酸碱性与 pH 值的关系.
【分析】根据题意,A 指示剂在 pH 小于 6.2 时显黄色;在 6.2﹣7.6 之间显绿色;在大于
7.6 时显黄色;B 指示剂在 pH 小于 10 时显黄色,大于 10 时显粉红色,结合题意进行分析
判断.
【解答】解:A、甲能使 A 指示剂显黄色,A 指示剂在 pH 小于 6.2 时显黄色,则甲显酸性,
故选项说法正确.
B、乙能使 B 指示剂显粉红色,B 指示剂在 pH 小于 10 时显黄色,则乙溶液的 pH 可能为 11,
显碱性,故选项说法正确.
C、甲溶液、乙溶液和蒸馏水三种液体分别显酸性、碱性、中性,分别能使 A 指示剂显黄色、
绿色、黄色,可以鉴别,故选项说法正确.
D、在滴有 A 指示剂的甲溶液中不断地加入乙溶液,最终溶液显碱性,最后溶液不一定显绿
色,也可能显蓝色,故选项说法错误.
故选:D.
5.某废液中只含有 Fe(NO3)2、Cu(NO3)2、Ba(NO3)2 三种溶质,为了回收金属、保护环
境,小科设计了如图方案(所加试剂均过量),下列判断正确的是(
)
A.固体 a 是铜
B.X 一定是 Na2SO4
C.溶液 B 中含有的盐有 Ba(NO3)2、NaNO3
D.若回收到 6.4g 固体 a,则加入的铁屑质量为 5.6g
【考点】85:金属的化学性质;G6:根据化学反应方程式的计算.
【分析】根据铁的金属活动性大于铜,向废液中加入过量的铁屑,铁能与硝酸铜反应生成
了铜和硝酸亚铁,过滤时得到的固体 a 中应含有铁和铜,向滤液中加入氢氧化钠时,硝酸
�














 2023年江西萍乡中考道德与法治真题及答案.doc
2023年江西萍乡中考道德与法治真题及答案.doc 2012年重庆南川中考生物真题及答案.doc
2012年重庆南川中考生物真题及答案.doc 2013年江西师范大学地理学综合及文艺理论基础考研真题.doc
2013年江西师范大学地理学综合及文艺理论基础考研真题.doc 2020年四川甘孜小升初语文真题及答案I卷.doc
2020年四川甘孜小升初语文真题及答案I卷.doc 2020年注册岩土工程师专业基础考试真题及答案.doc
2020年注册岩土工程师专业基础考试真题及答案.doc 2023-2024学年福建省厦门市九年级上学期数学月考试题及答案.doc
2023-2024学年福建省厦门市九年级上学期数学月考试题及答案.doc 2021-2022学年辽宁省沈阳市大东区九年级上学期语文期末试题及答案.doc
2021-2022学年辽宁省沈阳市大东区九年级上学期语文期末试题及答案.doc 2022-2023学年北京东城区初三第一学期物理期末试卷及答案.doc
2022-2023学年北京东城区初三第一学期物理期末试卷及答案.doc 2018上半年江西教师资格初中地理学科知识与教学能力真题及答案.doc
2018上半年江西教师资格初中地理学科知识与教学能力真题及答案.doc 2012年河北国家公务员申论考试真题及答案-省级.doc
2012年河北国家公务员申论考试真题及答案-省级.doc 2020-2021学年江苏省扬州市江都区邵樊片九年级上学期数学第一次质量检测试题及答案.doc
2020-2021学年江苏省扬州市江都区邵樊片九年级上学期数学第一次质量检测试题及答案.doc 2022下半年黑龙江教师资格证中学综合素质真题及答案.doc
2022下半年黑龙江教师资格证中学综合素质真题及答案.doc