2019 浙江省温州市中考化学真题及答案
班级:________
姓名:________
学
学校:________
号:________
一、单选题(共 5 小题)
1.银是一种银白色金属,密度较大,具有良好的导电性,长期放置会被氧化而发黑。其中属于银的化学性
质的是(
)
A.银白色
B.密度较大
C.导电性良好
D.能被氧化
2.联合国把今年定为“元素周期表年”。俄国科学家门捷列夫对元素周期表的编制做出巨大贡献,人们将
101 号元素命名为“钔”来纪念他。钔原子的核电荷数为 101,相对原子质量为 258,则钔原子的质子
数为(
)
A.101
B.157
C.258
D.359
3.如图,将红砂糖倒入一杯开水中,充分溶解。能作为判断砂糖水是饱和溶液的依据是(
)
A.砂糖水颜色很深
C.砂糖溶解得很快
B.砂糖水味道很甜
D.砂糖固体有剩余
4.当汽车发生剧烈碰撞时,安全气囊里的物质发生反应使气囊弹出,以保护司乘人员的安全。某汽车安全
气囊中的反应之一为:6Na+Fe2O3═2Fe+3Na2O,该反应属于(
)
A.化合反应
B.分解反应
C.置换反应
D.复分解反应
5.为研究盐酸的化学性质,小明进行如下实验。其中能产生白色沉淀的是(
)
�
A.
C.
B.
D.
二、填空题(共 4 小题)
6.端午节吃粽子是我国许多地方的习俗,粽叶是包粽子的材料之一。
(1)箬叶(如图)是粽叶的一种,含多种氨基酸,用箬叶包制粽子,可提高粽子中氨基酸含量,氨基
酸是人体合成
(填营养素名称)的重要原料。
(2)个别商贩利用硫酸铜(CuSO4)溶液浸泡陈旧粽叶使之变为青绿色,这对人体有害。
有关部门提醒市民可将粽叶用水浸泡,将铁钉(Fe)放入浸泡液中,根据铁钉是否变红进行检验,写出
该方法相关的化学方程式:
。
7.一些心脏病患者安装心脏起搏器,以在心跳骤停时刺激心脏,恢复心跳。一种用于心脏起搏器的锂电池,
工作时发生的反应为 4Li+2SOCl2═4LiCl+X+SO2↑.则 X 的化学式为
。
8.2019 年 5 月,我国目前推力最大的液体火箭发动机试验成功,该发动机用甲烷作燃料。
(1)甲烷(CH4)属于化合物中的
。
( 2 ) 用 甲 烷 作 燃 料 , 具 有 清 洁 无 毒 的 特 点 , 其 原 因
是
。
9.橘子罐头的生产过程中需要用稀盐酸和氢氧化钠去除橘络(橘瓣表面白色网状结构)。
(1)橘络营养丰富,但是其内含有味苦的芦丁,芦丁(C27H30O16)中质量分数最小的元素是
。
�
(2)去除橘络时,要控制好稀盐酸和氢氧化钠溶液的用量,以确保食品安全。某次生产过程中,要配
制 100 千克质量分数为 0.3%的氢氧化钠溶液,则需氢氧化钠固体
千克。
三、实验探究题(共 1 小题)
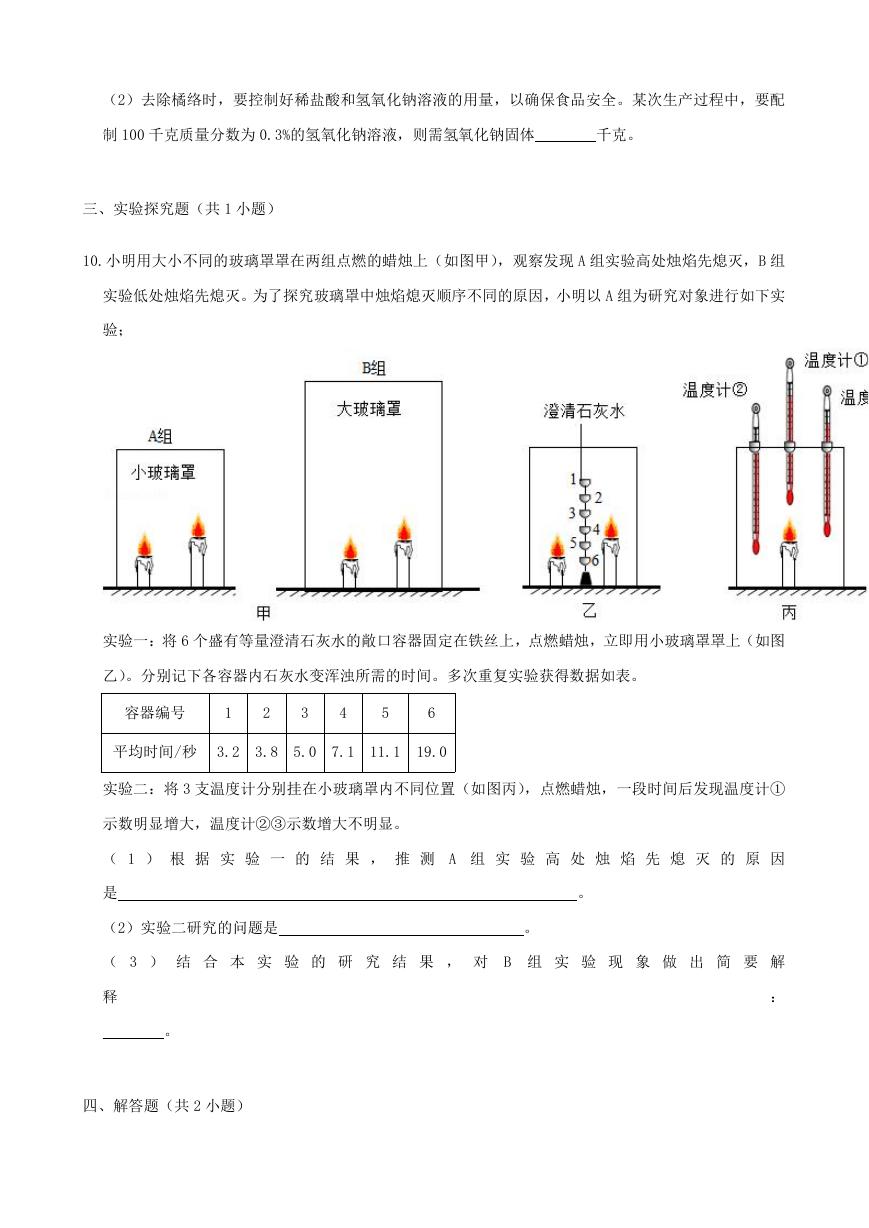
10.小明用大小不同的玻璃罩罩在两组点燃的蜡烛上(如图甲),观察发现 A 组实验高处烛焰先熄灭,B 组
实验低处烛焰先熄灭。为了探究玻璃罩中烛焰熄灭顺序不同的原因,小明以 A 组为研究对象进行如下实
验;
实验一:将 6 个盛有等量澄清石灰水的敞口容器固定在铁丝上,点燃蜡烛,立即用小玻璃罩罩上(如图
乙)。分别记下各容器内石灰水变浑浊所需的时间。多次重复实验获得数据如表。
容器编号
1
2
3
4
5
6
平均时间/秒 3.2
3.8
5.0 7.1
11.1
19.0
实验二:将 3 支温度计分别挂在小玻璃罩内不同位置(如图丙),点燃蜡烛,一段时间后发现温度计①
示数明显增大,温度计②③示数增大不明显。
( 1 ) 根 据 实 验 一 的 结 果 , 推 测 A 组 实 验 高 处 烛 焰 先 熄 灭 的 原 因
是
(2)实验二研究的问题是
。
。
( 3 ) 结 合 本 实 验 的 研 究 结 果 , 对 B 组 实 验 现 象 做 出 简 要 解
释
。
四、解答题(共 2 小题)
:
�
11.小明取一包某食品包装袋内的“脱氧剂“,查阅资料发现其成分除铁粉外,可能含有碳粉、Na2CO3、NaCl、
Fe2O3 等,为确定其成分,进行了如下实验:
(1)过滤操作中除了需带铁圈的铁架台、滤纸、玻璃棒外,还需要用到的仪器有
。
( 2 ) 写 出 用
pH
试 纸 测 定 滤 液
pH
的 方
法
。
(3)试剂 X 的名称是
。
:
12.过氧化氢溶液保存时,因缓慢分解导致质量分数变小(化学方程式为 2H2O2═2H2O+O2↑)。为探究酸碱性
对过氧化氢分解快慢的影响,小明利用图甲装置,每次实验往锥形瓶中加 10 克 30%过氧化氢溶液,再
滴加调节剂,使其 pH 分别从 3 依次调至 13,在 60℃反应温度下进行实验,获得数据如图乙。
(1)氧气能用排水法收集,是因为
。
( 2 ) 根 据 本 实 验 结 果 , 对 实 验 室 常 温 保 存 过 氧 化 氢 溶 液 提 出 合 理 的 建
议:
。
(3)某次实验中,当 10 克溶质质量分数为 30%的过氧化氢溶液分解产生 0.32 克氧气时,剩余过氧化
氢溶液的溶质质量分数为多少?(滴加的试剂对溶液质量的影响忽略不计,计算结果精确到 1%)
�
2019 年温州中考化学试卷(解析版)
参考答案
一、单选题(共 5 小题)
1.【分析】 物质在化学变化中表现出来的性质叫化学性质,如可燃性、助燃性、氧化性、还原性、酸碱
性、稳定性等;物质不需要发生化学变化就表现出来的性质,叫物理性质;物理性质经常表
现为:颜色、状态、气味、密度、硬度、熔点、沸点、导电性、导热性、溶解性、挥发性、
吸附性等。
【解答】 解:A、银白色,颜色属于物理性质;故选项错误;
B、密度较大,密度属于物理性质;故选项错误;
C、导电性良好,导电性属于物理性质;故选项错误;
D、能被氧化,氧化性属于化学性质;故选项正确;
故选:D。
【知识点】化学性质与物理性质的差别及应用
2.【分析】 在原子中,原子序数=核内质子数=核电荷数=核外电子数,相对原子质量=质子数+中子
数,据此分析解答。
【解答】 解:在原子中,核内质子数=核电荷数,钔原子的核电荷数为 101,则钔原子的质子数为 101;
故选:A。
【知识点】原子的有关数量计算
3.【分析】 判断溶液是否饱和的依据是:烧杯底部是否有剩余的不能在溶解的固体;如图,将红砂糖倒
入一杯开水中,充分溶解。能作为判断砂糖水是饱和溶液的依据是:砂糖固体有剩余。
【解答】 解:A、砂糖水颜色很深,颜色不能能作为判断砂糖水是饱和溶液的依据;故选项错误;
B、砂糖水味道很甜,味道不能能作为判断砂糖水是饱和溶液的依据;故选项错误;
C、砂糖溶解得很快,溶解的快慢不能能作为判断砂糖水是饱和溶液的依据;故选项错误;
D、如图,将红砂糖倒入一杯开水中,充分溶解。能作为判断砂糖水是饱和溶液的依据是:砂
糖固体有剩余;故选项正确;
故选:D。
【知识点】饱和溶液和不饱和溶液
4.【分析】 一种单质和一种化合物反应生成另外的单质和化合物的反应为置换反应,两种化合物相互交
换成分生成另外的两种化合物的反应是复分解反应,多变一的反应属于化合反应,一变多的
反应属于分解反应
【解答】 解:6Na+Fe2O3═2Fe+3Na2O,属于一种单质和一种化合物反应生成一种单质和化合物的反应为
置换反应。
故选:C。
【知识点】反应类型的判定
�
5.【分析】 根据酸的化学性质(能与酸碱指示剂、活泼金属、金属氧化物、碱、盐等反应),据此进行
分析解答。
【解答】 解:A、稀盐酸能与硝酸银溶液反应生成氯化银白色沉淀和硝酸,故选项正确。
B、稀盐酸能与氢氧化钠溶液反应生成氯化钠和水,无明显变化,故选项错误。
C、稀盐酸能与氧化铜反应生成氯化铜和水,故选项错误。
D、锌能与稀盐酸反应生成氯化锌溶液和氢气,故选项错误。
故选:A。
【知识点】酸的化学性质
二、填空题(共 4 小题)
6.【分析】 (1)根据氨基酸是合成蛋白质的重要原料进行分析;
(2)根据金属置换规律进行分析。
【解答】 解:(1)氨基酸是人体合成蛋白质的重要原料;
(2)在金属活动顺序里,铁在铜的前面,能把铜从硫酸铜溶液中给置换出来,化学方程式为:
Fe+CuSO4=FeSO4+Cu。
故答案为:
(1)蛋白质;
(2)Fe+CuSO4=FeSO4+Cu。
【知识点】生命活动与六大营养素、书写化学方程式、文字表达式、电离方程式
7.【分析】 化学反应遵循质量守恒定律,即参加反应的物质的质量之和,等于反应后生成的物质的质量
之和,是因为化学反应前后,元素的种类不变,原子的种类、总个数不变。
【解答】 解:由 4Li+2SOCl2═4LiCl+X+SO2↑可知,反应前后锂原子都是 4 个,氧原子都是 2 个,氯原
子都是 4 个,反应前硫原子是 2 个,反应后应该是 2 个,其中 1 个包含在 X 中,因此 X 的化学式
是 S。
故填:S。
【知识点】质量守恒定律及其应用
8.【分析】 (1)含碳的化合物属于有机物,一氧化碳、二氧化碳、碳酸盐除外;(2)根据甲烷中只含
有碳元素和氢元素考虑。
【解答】 解:(1)含碳的化合物属于有机物,一氧化碳、二氧化碳、碳酸盐除外,所以甲烷属于有机
物;
(2)甲烷中只含有碳元素和氢元素,完全燃烧生成二氧化碳和水,不污染环境。
故答案为:(1)有机物;(2)只含有碳元素和氢元素,完全燃烧生成二氧化碳和水。
【知识点】甲烷、乙醇等常见有机物的性质和用途、有机物与无机物的区别
9.【分析】 (1)根据化学式的意义进行有关的计算;
(2)根据溶质的质量分数的公式进行有关的计算。
【解答】 解:(1)芦丁(C27H30O16)中 C、H、O 的质量比=(12×27):(1×30):(16×16)=162:15:
98,其中质量分数最小的是氢元素;
(2)需氢氧化钠固体的质量为:
100kg×0.3%=0.3kg。
故答案为:
(1)氢;
�
(2)0.3。
【知识点】有关溶质质量分数的简单计算、元素的质量分数计算
三、实验探究题(共 1 小题)
10.【分析】 (1)根据表中的数据分析小玻璃罩内各处浓度及二氧化碳的性质分析回答;
(2)根据实验的过程及现象分析回答;
(3)根据热的二氧化碳气体向上运动,冷却后聚集在玻璃罩的下部分析回答。
【解答】 解:(1)由实验一的结果可知,小玻璃罩内高处的石灰水变浑浊的快,说明了小玻璃罩内高
处二氧化碳的浓度大,推测 A 组实验高处烛焰先熄灭的原因是 玻璃罩内高处二氧化碳的浓度大,
二氧化碳不燃烧不支持燃烧。
(2)实验二可知,玻璃罩内各处的温度不同,所以研究的问题是探究小玻璃罩内不同位置的
温度。
(3)二氧化碳的密度比空气大,B 组中低处烛焰先熄灭的原因是:在大玻璃罩内生成热的二
氧化碳气体冷却后,聚集在玻璃罩的底部,二氧化碳不燃烧不支持燃烧。
故答为:(1)玻璃罩内高处二氧化碳的浓度大,二氧化碳不燃烧不支持燃烧;(2)探究玻璃罩
内不同位置的温度;(3)在大玻璃罩内,生成热的二氧化碳气体冷却后,聚集在玻璃罩的底部,
二氧化碳不燃烧不支持燃烧。
【知识点】实验探究物质变化的条件和影响物质变化的因素
四、解答题(共 2 小题)
11.【分析】 (1)过滤是把不溶于液体的固体与液体分离的一种方法,根据过滤操作所需的仪器进行
分析解答。
(2)根据用 pH 试纸测定未知溶液的 pH 的方法进行分析解答。
(3)棕黑色粉末与试剂 X 反应后得到黄色溶液和黑色固体,黄色溶液中含有铁离子,
进行分析解答。
【解答】 解:(1)过滤操作中除了需带铁圈的铁架台、滤纸、玻璃棒外,还需要用到的仪器有漏斗、
烧杯。
(2)用 pH 试纸测定未知溶液的 pH 时,正确的操作方法为取一片 pH 试纸放在玻璃片或白瓷板
上,用玻璃棒蘸取少量待测液滴在干燥的 pH 试纸上,与标准比色卡对比来确定 pH。
(3)棕黑色粉末与试剂 X 反应后得到黄色溶液和黑色固体,黄色溶液中含有铁离子,则棕黑
色粉末中含有氧化铁,氧化铁能与酸反应生成盐和水,则 X 可能是稀盐酸或稀硫酸。
故答案为:
(1)漏斗、烧杯;
(2)取一片 pH 试纸放在玻璃片或白瓷板上,用玻璃棒蘸取少量待测液滴在干燥的 pH 试纸上,
与标准比色卡对比来确定 pH;
(3)稀盐酸。
【知识点】食品干燥剂、保鲜剂和真空包装的成分探究、溶液的酸碱度测定、过滤的原理、方法及其应用
12.【分析】 根据给出的实验过程以及曲线图进行分析和解答,结合对应的数据和化学方程式求算过氧
化氢的质量,进而求算剩余过氧化氢溶液的溶质质量分数。
【解答】 解:
(1)氧气能用排水法收集,是因为 氧气不易溶于水。
�
(2)根据本实验结果,由于在 pH 约为 3~5 的酸性条件下过氧化氢分解最慢,所以对实验室
常温保存过氧化氢溶液提出合理的建议:在 pH 约为 3~5 的酸性条件下保存。
(3)设分解产生 0.32 克氧气时,消耗的过氧化氢的质量为 x
2H2O2═2H2O+O2↑
68
32
0.32g
x
=
x=0.68g
剩余的过氧化氢的质量为 10g×30%﹣0.68g=2.32g
剩余过氧化氢溶液的溶质质量分数为
×100%=24%
故答案为:
(1)氧气不易溶于水。
(2)在 pH 约为 3~5 的酸性条件下保存。
(3)24%。
【知识点】有关溶质质量分数的简单计算、根据化学反应方程式的计算
�















 2023年江西萍乡中考道德与法治真题及答案.doc
2023年江西萍乡中考道德与法治真题及答案.doc 2012年重庆南川中考生物真题及答案.doc
2012年重庆南川中考生物真题及答案.doc 2013年江西师范大学地理学综合及文艺理论基础考研真题.doc
2013年江西师范大学地理学综合及文艺理论基础考研真题.doc 2020年四川甘孜小升初语文真题及答案I卷.doc
2020年四川甘孜小升初语文真题及答案I卷.doc 2020年注册岩土工程师专业基础考试真题及答案.doc
2020年注册岩土工程师专业基础考试真题及答案.doc 2023-2024学年福建省厦门市九年级上学期数学月考试题及答案.doc
2023-2024学年福建省厦门市九年级上学期数学月考试题及答案.doc 2021-2022学年辽宁省沈阳市大东区九年级上学期语文期末试题及答案.doc
2021-2022学年辽宁省沈阳市大东区九年级上学期语文期末试题及答案.doc 2022-2023学年北京东城区初三第一学期物理期末试卷及答案.doc
2022-2023学年北京东城区初三第一学期物理期末试卷及答案.doc 2018上半年江西教师资格初中地理学科知识与教学能力真题及答案.doc
2018上半年江西教师资格初中地理学科知识与教学能力真题及答案.doc 2012年河北国家公务员申论考试真题及答案-省级.doc
2012年河北国家公务员申论考试真题及答案-省级.doc 2020-2021学年江苏省扬州市江都区邵樊片九年级上学期数学第一次质量检测试题及答案.doc
2020-2021学年江苏省扬州市江都区邵樊片九年级上学期数学第一次质量检测试题及答案.doc 2022下半年黑龙江教师资格证中学综合素质真题及答案.doc
2022下半年黑龙江教师资格证中学综合素质真题及答案.doc