2021 年广东普通高中学业水平选择性考试化学真题
可能用到的相对原子质量:H 1
C 12
N 14
O 16
Na 23
S 32
Fe 56
一、选择题:本题共 16 小题,共 44 分。第 1~10 小题,每小题 2 分;第 11~16 小题,每小
题 4 分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1. 今年五一假期,人文考古游持续成为热点。很多珍贵文物都记载着中华文明的灿烂成就,
具有深邃的文化寓意和极高的学术价值。下列国宝级文物主要由合金材料制成的是(
)
选
项
A
B
C
D
文
物
名
称
铸客大铜鼎
河姆渡出土陶灶
兽首玛瑙杯
角形玉杯
2. 广东有众多国家级非物质文化遗产,如广东剪纸、粤绣、潮汕工夫茶艺和香云纱染整技
艺等。下列说法不正确的是(
)
A. 广东剪纸的裁剪过程不涉及化学变化
B. 冲泡工夫茶时茶香四溢,体现了分子是运动的
C. 制作粤绣所用的植物纤维布含有天然高分子化合物
D. 染整技艺中去除丝胶所用的纯碱水溶液属于纯净物
3. “天问一号”着陆火星,“嫦娥五号”采回月壤。腾飞中国离不开化学,长征系列运载
火箭使用的燃料有液氢和煤油等化学品。下列有关说法正确的是(
)
A. 煤油是可再生能源
2H 燃烧过程中热能转化为化学能
B.
C. 火星陨石中的
20 Ne 质量数为 20
D. 月壤中的
3He 与地球上的
3H 互为同位素
4. 化学创造美好生活。下列生产活动中,没有运用相应化学原理的是(
)
�
选项
生产活动
化学原理
A
B
C
D
用聚乙烯塑料制作食品保鲜膜
聚乙烯燃烧生成 2CO 和 2H O
利用海水制取溴和镁单质
Br
可被氧化、
2Mg
可被还原
利用氢氟酸刻蚀石英制作艺术品
氢氟酸可与 2SiO 反应
公园的钢铁护栏涂刷多彩防锈漆
钢铁与潮湿空气隔绝可防止腐蚀
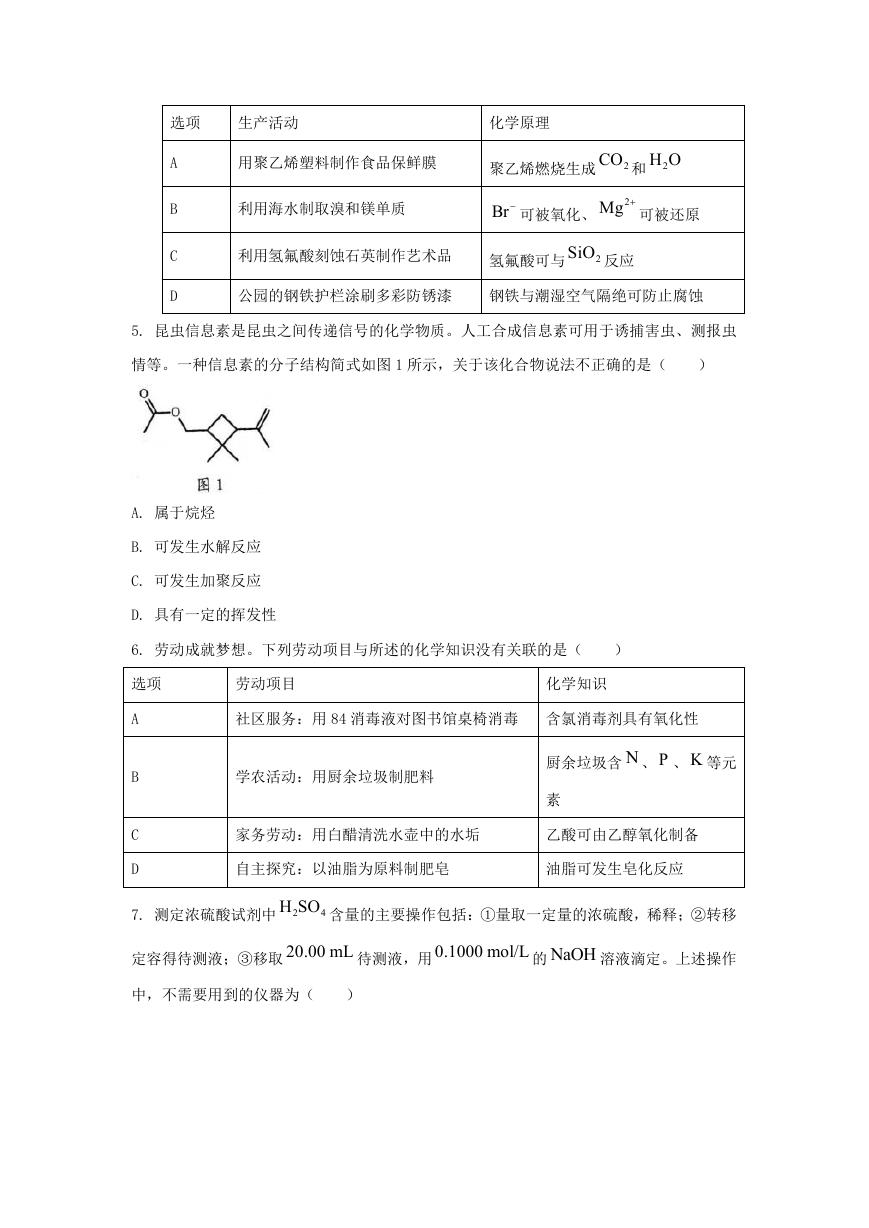
5. 昆虫信息素是昆虫之间传递信号的化学物质。人工合成信息素可用于诱捕害虫、测报虫
情等。一种信息素的分子结构简式如图 1 所示,关于该化合物说法不正确的是(
)
A. 属于烷烃
B. 可发生水解反应
C. 可发生加聚反应
D. 具有一定的挥发性
6. 劳动成就梦想。下列劳动项目与所述的化学知识没有关联的是(
)
选项
劳动项目
化学知识
A
B
C
D
社区服务:用 84 消毒液对图书馆桌椅消毒 含氯消毒剂具有氧化性
学农活动:用厨余垃圾制肥料
厨余垃圾含 N 、 P 、 K 等元
素
家务劳动:用白醋清洗水壶中的水垢
乙酸可由乙醇氧化制备
自主探究:以油脂为原料制肥皂
油脂可发生皂化反应
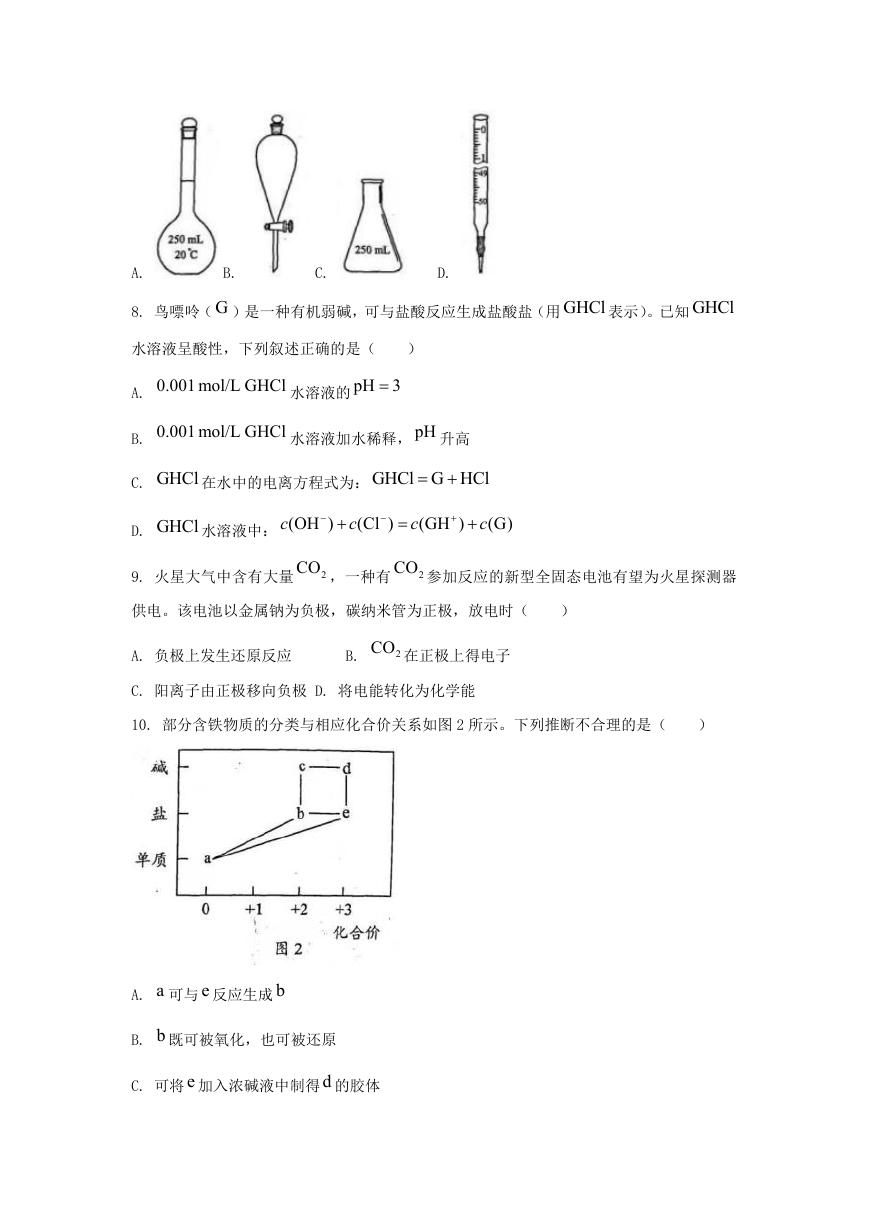
7. 测定浓硫酸试剂中 2
H SO 含量的主要操作包括:①量取一定量的浓硫酸,稀释;②转移
4
定容得待测液;③移取 20.00 mL 待测液,用 0.1000 mol/L 的 NaOH 溶液滴定。上述操作
中,不需要用到的仪器为(
)
�
A.
B.
C.
D.
8. 鸟嘌呤(G )是一种有机弱碱,可与盐酸反应生成盐酸盐(用 GHCl 表示)。已知 GHCl
水溶液呈酸性,下列叙述正确的是(
)
A. 0.001 mol/L GHCl 水溶液的 pH 3
B. 0.001 mol/L GHCl 水溶液加水稀释, pH 升高
C. GHCl 在水中的电离方程式为: GHCl G HCl
D. GHCl 水溶液中: (OH )
c
c
(Cl )
c
(GH )
c
(G)
9. 火星大气中含有大量 2CO ,一种有 2CO 参加反应的新型全固态电池有望为火星探测器
供电。该电池以金属钠为负极,碳纳米管为正极,放电时(
)
A. 负极上发生还原反应
2CO 在正极上得电子
B.
C. 阳离子由正极移向负极 D. 将电能转化为化学能
10. 部分含铁物质的分类与相应化合价关系如图 2 所示。下列推断不合理的是(
)
A. a 可与 e 反应生成 b
B. b 既可被氧化,也可被还原
C. 可将 e 加入浓碱液中制得 d 的胶体
�
D. 可存在 b
的循环转化关系
d
c
e
b
11. 设 AN 为阿伏加德罗常数的值。下列说法正确的是(
)
1 mol CHCl 含有 C Cl 键的数目为 A3N
3
A.
B. 1 L1.0 mol/L 的盐酸含有阴离子总数为 A2N
C. 11.2 L NO 与
11.2 L O 混合后的分子数目为 AN
2
D. 23 g Na 与足量 2H O 反应生成的 2H 分子数目为 AN
12. 化学是以实验为基础的科学。下列实验操作或做法正确且能达到目的的是(
)
选项
操作或做法
将铜丝插入浓硝酸中
将密闭烧瓶中的 2NO 降温
目的
制备 NO
探究温度对平衡移动的影响
A
B
C
D
将溴水滴入 KI 溶液中,加入乙醇并振荡
萃取溶液中生成的碘
实验结束,将剩余 NaCl 固体放回原试剂瓶
节约试剂
13. 一种麻醉剂的分子结构式如图 3 所示。其中,X 的原子核只有 1 个质子;元素 Y 、Z 、
W 原子序数依次增大,且均位于 X 的下一周期;元素 E 的原子比 W 原子多 8 个电子。下
列说法不正确的是(
)
4XEZ 是一种强酸
A.
B. 非金属性: W Z Y
C. 原子半径: Y W E
2ZW 中, Z 的化合价为+2 价
D.
14. 反应 X 2Z 经历两步:① X Y ;② Y 2Z 。反应体系中 X 、Y 、 Z 的浓度c 随
�
时间t 的变化曲线如图 4 所示。下列说法不正确的是(
)
c
Y
X
随t 的变化曲线
A. a 为
Xc
B. 1t 时,
c
C. 2t 时, Y 的消耗速率大于生成速率
D. 3t 后,
c
2
c
0
Y
Z
Z
c
c
15. 宏观辨识与微观探析是化学学科核心素养之一。下列物质性质实验对应的反应方程式书
写正确的是(
)
Na O 放入水中: 2
2
2
Na O H O 2NaOH O
2
2
2
2H O(g) 通过灼热铁粉: 2
3H O 2Fe Fe O 3H
2
3
2
A.
B.
C. 钢丝插入热的浓硫酸中:
Cu H SO CuSO H
2
4
2
4
2
2SO 通入酸性
KMnO 溶液中:
4
D.
5SO 2H O 2MnO
2
4
5SO
2
4
4H 2Mn
2
16. 钴(Co )的合金材料广泛应用于航空航天、机械制造等领域。图 5 为水溶液中电解制
备金属钴的装置示意图。下列说法正确的是(
)
A. 工作时,Ⅰ室和Ⅱ室溶液的 pH 均增大
�
B. 生成1 mol Co ,Ⅰ室溶液质量理论上减少16 g
C. 移除两交换膜后,石墨电极上发生的反应不变
D. 电解总反应:
2
2Co
2H O
2
通电
2Co O
2
4H
二、非选择题:共 56 分。第 17~19 题为必考题,考生都必须作答。第 20~21 题为选考题,
考生根据要求作答。
(一)必考题:共 42 分。
17.(15 分)
含氯物质在生产生活中有重要作用。1774 年,舍勒在研究软锰矿(主要成分是
2MnO )的
过程中,将它与浓盐酸混合加热,产生了一种黄绿色气体。1810 年,戴维确认这是一种新
元素组成的单质,并命名为 chlorine(中文命名“氯气”)。
(1)实验室沿用舍勒的方法制取 2Cl 的化学方程式为___________。
(2)实验室制取干燥 2Cl 时,净化与收集 2Cl 所需装置的接口连接顺序为___________。
(3)某氯水久置后不能使品红溶液褪色,可推测氯水中__________已分解。检验此久置氯
水中 Cl
存在的操作及现象是___________。
(4)某合作学习小组进行以下实验探究。
①实验任务 通过测定溶液电导率,探究温度对 AgCl 溶解度的影响。
②查阅资料 电导率是表征电解质溶液导电能力的物理量。温度一定时,强电解质稀溶液的
电导率随溶液中离子浓度的增大而增大;离子浓度一定时,稀溶液电导率随温度的升高而增
10
。
K
1.8 10
sp AgCl
大。 25 C 时,
③提出猜想 猜想 a:较高温度的 AgCl 饱和溶液的电导率较大。
猜想 b: AgCl 在水中的溶解度
s
④设计实验、验证猜想 取试样Ⅰ、Ⅱ、Ⅲ(不同温度下配制的 AgCl 饱和溶液),在设定
45 C
35 C
25 C
s
s
。
�
的测试温度下,进行表 1 中实验 1~3,记录数据。
表 1
实验序号
试样
测试温度/ C
电导率/
μS/cm
1
2
3
Ⅰ:25 C 的 AgCl 饱和溶液 25
Ⅱ:35 C 的 AgCl 饱和溶液 35
Ⅲ:45 C 的 AgCl 饱和溶液 45
1A
2A
3A
⑤数据分析、交流讨论 25 C 的 AgCl 饱和溶液中,
c
Cl
__________ mol/L 。
实验结果为 3
A A
A
。小组同学认为,此结果可以证明③中的猜想 a 成立,但不足以
1
2
证明猜想 b 成立。结合②中信息,猜想 b 不足以成立的理由有_______________。
⑥优化实验 小组同学为进一步验证猜想 b ,在实验 1~3 的基础上完善方案,进行实验 4 和
5。请在答题卡上完成表 2 中内容。
表 2
实验序号
试样
Ⅰ
4
5
__________
__________
测试温度/ C
__________
电导率/
μS/cm
1B
2B
⑦实验总结 根据实验 1~5 的结果,并结合②中信息,小组同学认为猜想 b 也成立。猜想 b
成立的判断依据是____________。
18.(13 分)
对废催化剂进行回收可有效利用金属资源。某废催化剂主要含铝( Al )、钼( Mo )、镍( Ni )
等元素的氧化物,一种回收利用工艺的部分流程如下:
已知:25 C 时, 2
H CO 的
3
K
a1
4.5 10
7
K
,
a2
4.7 10
11
;
K
sp
BaMoO
4
3.5 10
8
;
�
K
sp
BaCO
3
2.6 10
9
;该工艺中, pH 6.0 时,溶液中 Mo 元素以
2
4MoO
的形态存
在。
(1)“焙烧”中,有 2
Na MoO 生成,其中 Mo 元素的化合价为____________。
4
(2)“沉铝”中,生成的沉淀 X 为______________。
(3)“沉钼”中, pH 为 7.0。
①生成
BaMoO 的离子方程式为__________。
4
BaMoO 中混入
4
BaCO 沉淀,溶液中
3
②若条件控制不当,
c
HCO : MoO
c
3
3
BaCO 也会沉淀。为避免
2
4
___________(列出算式)时,应停止加入
BaCl 溶液。
2
(4)①滤液Ⅲ中,主要存在的钠盐有 NaCl 和 Y , Y 为___________。
②往滤液Ⅲ中添加适量 NaCl 固体后,通入足量______________(填化学式)气体,再通入
足量 2CO ,可析出 Y 。
(5)高纯 AlAs (砷化铝)可用于芯片制造。芯片制造中的一种刻蚀过程如图 6 所示,图
中所示致密保护膜为一种氧化物,可阻止 2
2H O 刻蚀液与下层 GaAs (砷化镓)反应。
①该氧化物为___________。
②已知: Ga 和 Al 同族, As 和 N 同族。在 2
2H O 与上层 GaAs 的反应中, As 元素的化合
价变为+5 价,则该反应的氧化剂与还原剂物质的量之比为___________。
19.(14 分)
我国力争于 2030 年前做到碳达峰,2060 年前实现碳中和。 4CH 与 2CO 重整是 2CO 利用的
研究热点之一。该重整反应体系主要涉及以下反应:
�














 2023年江西萍乡中考道德与法治真题及答案.doc
2023年江西萍乡中考道德与法治真题及答案.doc 2012年重庆南川中考生物真题及答案.doc
2012年重庆南川中考生物真题及答案.doc 2013年江西师范大学地理学综合及文艺理论基础考研真题.doc
2013年江西师范大学地理学综合及文艺理论基础考研真题.doc 2020年四川甘孜小升初语文真题及答案I卷.doc
2020年四川甘孜小升初语文真题及答案I卷.doc 2020年注册岩土工程师专业基础考试真题及答案.doc
2020年注册岩土工程师专业基础考试真题及答案.doc 2023-2024学年福建省厦门市九年级上学期数学月考试题及答案.doc
2023-2024学年福建省厦门市九年级上学期数学月考试题及答案.doc 2021-2022学年辽宁省沈阳市大东区九年级上学期语文期末试题及答案.doc
2021-2022学年辽宁省沈阳市大东区九年级上学期语文期末试题及答案.doc 2022-2023学年北京东城区初三第一学期物理期末试卷及答案.doc
2022-2023学年北京东城区初三第一学期物理期末试卷及答案.doc 2018上半年江西教师资格初中地理学科知识与教学能力真题及答案.doc
2018上半年江西教师资格初中地理学科知识与教学能力真题及答案.doc 2012年河北国家公务员申论考试真题及答案-省级.doc
2012年河北国家公务员申论考试真题及答案-省级.doc 2020-2021学年江苏省扬州市江都区邵樊片九年级上学期数学第一次质量检测试题及答案.doc
2020-2021学年江苏省扬州市江都区邵樊片九年级上学期数学第一次质量检测试题及答案.doc 2022下半年黑龙江教师资格证中学综合素质真题及答案.doc
2022下半年黑龙江教师资格证中学综合素质真题及答案.doc