2014 年黑龙江省大庆市中考化学试卷及答案
满分:100 分 时间:120 分钟
试题难度:较难
难度系数:0.60
易错题 11.15.18
较难题:14.20.27
可能用到的相对原子质量: H-1
C-12
N-12
O-16
Cl-35.5
Na-23
S-32 K-39
Cr-52
Mn—55
Fe-56
I-127
一、选择题(以下各题,只有一个符合要求的答案.每小题 2 分,共 30 分)
1.化学物质正逐渐改变我们的生活,下列有关说法不正确的是(
)
A. 为保障食品安全,应杜绝使用食品添加剂
B. 臭氧层可以保护地球生物免受过量紫外线伤害,但近地面过量的臭氧则对人体有害
C. 石油分馏出的成分可以可以用来制造合成纤维、合成橡胶、塑料等
D. 为了可持续发展,我们不仅要善用 金属材料和制品,更要有计划地开采金属资源
2.微粒是构成化学物质的基础,下列对微粒的描述正确的是(
)
A. 仅有碳原子构成的物质属于纯净物
B. 原子中一定含有质子、中子、电子
C. NaCl 是由离子构成的,所以 HCl 也是有离子构成的
D.
Cl﹣的离子结构示意图为
3.下列过程中,属于化学变化的是(
)
A. 碘升华
B. 火药爆炸
C. 水的蒸馏
D. 酒精溶于水
4.下列实验操作符合规范的是(
)
A.
B.
C.
D.
检验装置气密性
给液体加热
向试管中加固体
取用固体药品
5.某溶液溶质的质量分数为 20%,加入 50g 水后变为 10%,稀释后溶液中溶质的质量是
(
)
A. 50g
B. 10g
C. 100g
D. 40g
6.已知 FeCl3 与 CuCl2 对 H2O2 分解都有催化作用,为测定并比较二者的催化效率,需要控
制的条件包括:①实验温度;②H2O2 的浓度;③催化剂质量;④FeCl3 与 CuCl2 的颗粒大小
(
)
A. ①②
B. ②③
C. 全部
D. ①②④
7.下列关于生活中的化学现象和原理解释均正确的是(
)
�
A. 在煤中掺入适量生石灰再燃烧可以减少 SO2 气体的排放
B. 大气污染物主要包括总悬浮颗粒物、PM2.5 和 CO2 等
C. 电池可分为一次电池、二次电池、二次电池只能使用两次
D. 用汽油除去衣服上的油污,是利用了汽油的乳化功能
8.下列物质在使用过程中与化学性质无关的是(
)
A. 用小苏打治疗胃酸过多
B. 用食醋除去暖水瓶中的水垢
C. 用干冰进行人工降雨
D. 用熟石灰改良酸性土壤
9.古代“银针验毒”的原理是 4Ag+2H2S+X→2Ag2S+2H2O,X 的化学式为(
A. H2
C. O2
B. S
)
D. SO2
10.下列实验方法、现象、结论均正确的是(
)
选项
实验方法
现象
结论
A
用 pH 试纸测肥皂液的酸碱性 试纸变黄(pH<7)
肥皂液呈酸性
B 铜丝放入稀硝酸中
有气泡产生
铜可以置换出酸中的氢气
C
D
A. A
燃烧法测定纤维种类
烧毛发的气味
该纤维是棉纤维
蓝墨水滴入盛有水的水杯中 一段时间后整杯水变蓝
分子是不断运动的
B. B
C. C
D. D
11.图中 a、b、c 分别表示 KNO3、NaCl、Ca(OH)2 溶解度曲线,下列说法错误的是
(
)
A
T1 时,KNO3 和 NaCl 的饱和溶液溶质的质量分数相等
.
B
T2 时,A 点表示 KNO3 的不饱和溶液,降温至 T1 时有晶体析出,且
.
变为 T1 时 KNO3 的饱和溶液
C
T1 时,将 Ca(OH)2 饱和溶液升温至 T2 变为不饱和溶液
.
D
温度高于 T1 时,KNO3 溶解度大于 NaCl 溶解度,温度低于 T1 时,
.
KNO3 溶解度小于 NaCl 溶解度
12.化学方程式是重要的“化学语言”,下列化学方程式与文字表述均正确的是(
A. 浓氨水遇浓盐酸产生白雾:NH3+HCl═NH4Cl
)
B. 用稀盐酸除去铁锈:Fe2O3+4HCl═2FeCl2+2H2O
C. 实验室制备 CO2:CaCO3+2HCl═CaCl2+CO2↑+H2O
D.
甲醇不充分燃烧:2CH3OH+3O2
2CO2+4H2O
13.下列各项指定数据前者小于后者的是(
)
�
选项
数据
A
B
C
D
溶液温度
室温下 10gNH4NO3
溶于 100g 水中
物质中氧元素的质量分数
甲醛(HCHO)
室温下 10gNaOH
溶于 100g 水中
葡萄糖(C6H12O6)
二氧化碳的溶解度
5℃、101KPa 下
25℃、101KPa 下
物质中碳元素的质量分数
A. A
B. B
生铁
C. C
钢
D. D
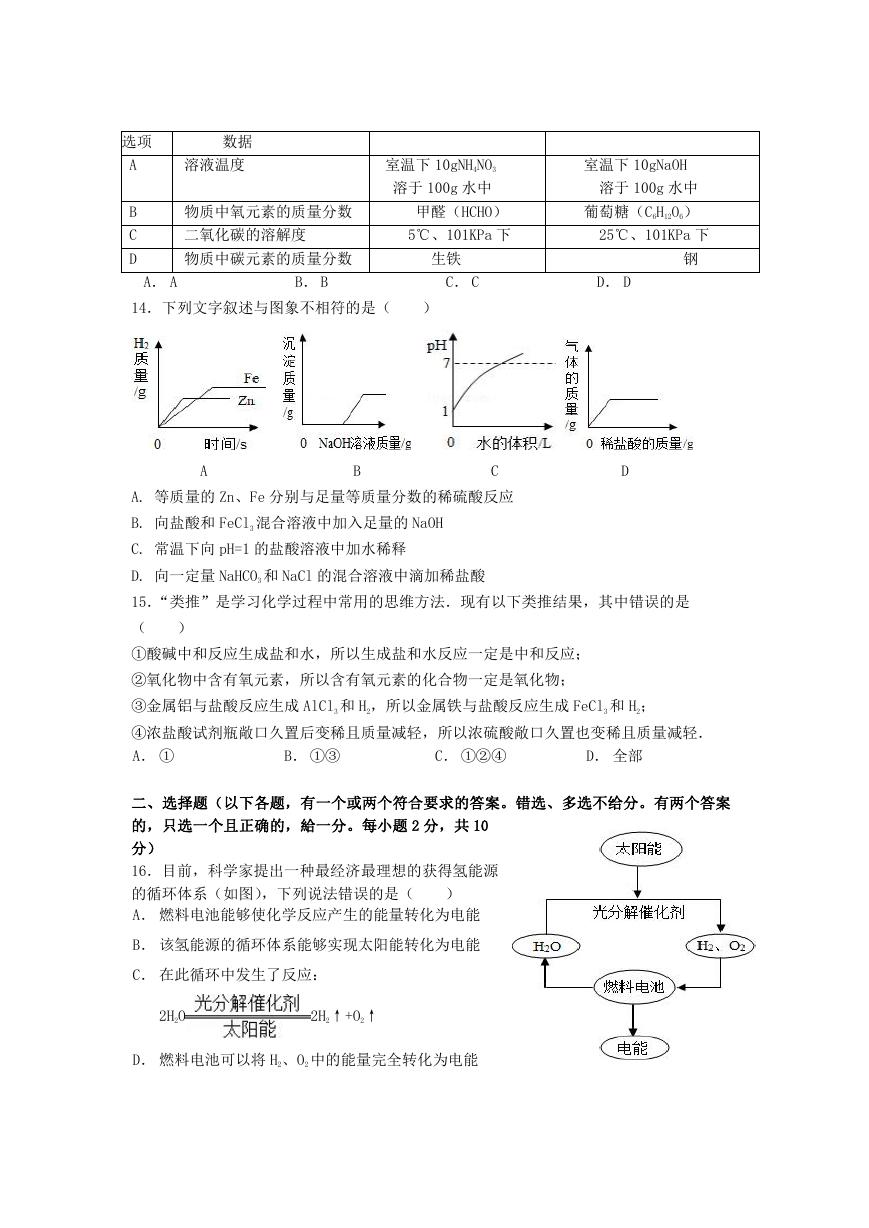
14.下列文字叙述与图象不相符的是(
)
A
B
C
D
A. 等质量的 Zn、Fe 分别与足量等质量分数的稀硫酸反应
B. 向盐酸和 FeCl3 混合溶液中加入足量的 NaOH
C. 常温下向 pH=1 的盐酸溶液中加水稀释
D. 向一定量 NaHCO3 和 NaCl 的混合溶液中滴加稀盐酸
15.“类推”是学习化学过程中常用的思维方法.现有以下类推结果,其中错误的是
(
)
①酸碱中和反应生成盐和水,所以生成盐和水反应一定是中和反应;
②氧化物中含有氧元素,所以含有氧元素的化合物一定是氧化物;
③金属铝与盐酸反应生成 AlCl3 和 H2,所以金属铁与盐酸反应生成 FeCl3 和 H2;
④浓盐酸试剂瓶敞口久置后变稀且质量减轻,所以浓硫酸敞口久置也变稀且质量减轻.
A. ①
B. ①③
C. ①②④
D. 全部
二、选择题(以下各题,有一个或两个符合要求的答案。错选、多选不给分。有两个答案
的,只选一个且正确的,給一分。每小题 2 分,共 10
分)
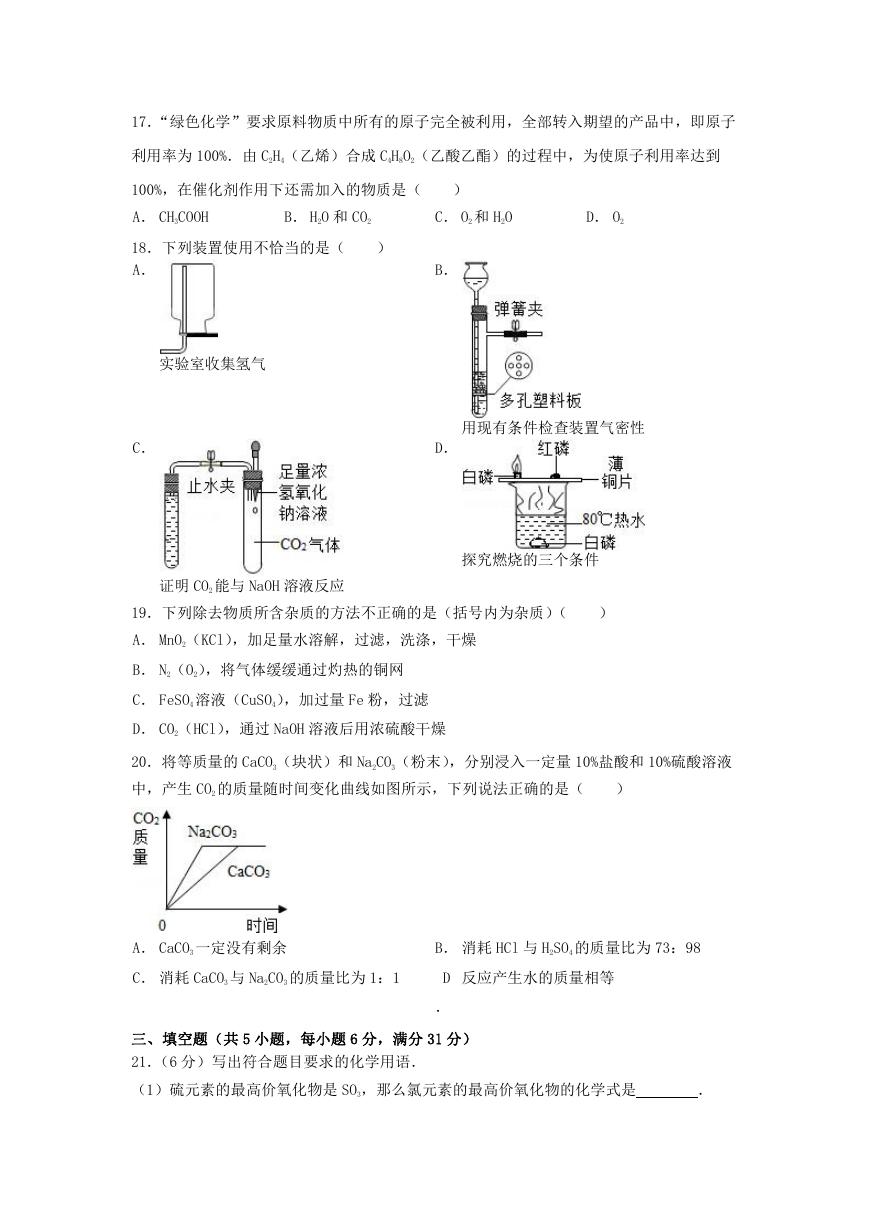
16.目前,科学家提出一种最经济最理想的获得氢能源
的循环体系(如图),下列说法错误的是(
A. 燃料电池能够使化学反应产生的能量转化为电能
)
B. 该氢能源的循环体系能够实现太阳能转化为电能
C. 在此循环中发生了反应:
2H2O
2H2↑+O2↑
D. 燃料电池可以将 H2、O2 中的能量完全转化为电能
�
17.“绿色化学”要求原料物质中所有的原子完全被利用,全部转入期望的产品中,即原子
利用率为 100%.由 C2H4(乙烯)合成 C4H8O2(乙酸乙酯)的过程中,为使原子利用率达到
100%,在催化剂作用下还需加入的物质是(
)
A. CH3COOH
B. H2O 和 CO2
C. O2 和 H2O
D. O2
18.下列装置使用不恰当的是(
A.
)
B.
实验室收集氢气
C.
用现有条件检查装置气密性
D.
证明 CO2 能与 NaOH 溶液反应
19.下列除去物质所含杂质的方法不正确的是(括号内为杂质)(
)
探究燃烧的三个条件
A. MnO2(KCl),加足量水溶解,过滤,洗涤,干燥
B. N2(O2),将气体缓缓通过灼热的铜网
C. FeSO4 溶液(CuSO4),加过量 Fe 粉,过滤
D. CO2(HCl),通过 NaOH 溶液后用浓硫酸干燥
20.将等质量的 CaCO3(块状)和 Na2CO3(粉末),分别浸入一定量 10%盐酸和 10%硫酸溶液
中,产生 CO2 的质量随时间变化曲线如图所示,下列说法正确的是(
)
A. CaCO3 一定没有剩余
B. 消耗 HCl 与 H2SO4 的质量比为 73:98
C. 消耗 CaCO3 与 Na2CO3 的质量比为 1:1
D
反应产生水的质量相等
三、填空题(共 5 小题,每小题 6 分,满分 31 分)
21.(6 分)写出符合题目要求的化学用语.
.
(1)硫元素的最高价氧化物是 SO3,那么氯元素的最高价氧化物的化学式是
.
�
(2)实验室用氢气还原 Fe2O3 制铁粉的过程中常常会生成一种黑色晶体,
该晶体有磁性,是铁的氧化物,铁元素与氧元素的质量比为 21:8,该晶体
的化学式是
.
(3)酸雨是指 pH<5.6 的降水,但普通降水的 pH 也小于 7,用化学方程式
表示普通降水 pH<7 的原因
.
(4)碳铵是最常用的氮肥之一,遇碱性物质会降低肥效,请写出碳铵与过量 NaOH 反应的
化学方程式
.
22.(6 分)太阳能光伏发电最关 键的材料是高纯硅.硅原子结构示意图为
高纯硅可以通过以下过程制取:
制粗硅:①SiO2+2C
Si(粗硅)+2CO↑
制纯硅:②Si(粗硅)+2Cl2
SiCl4
③SiCl4+2H2
Si(纯硅)+4HCl
石英砂、水晶、玛瑙的主要成份均是 SiO2,SiO2 的化学性质与 CO2 有些类似.
(1)x 的值为
.
(2)请写出 SiO2 与 NaOH 溶液反应的化学方程式:
.
(3)在反应①②③中,②属于
反应类型,属于置换反应的是(填序号)
.
(4)有元素的化合价改变的反应是
(填序号).
23.(7 分)(海洋面积约占地球表面积的 71%,海洋孕育了地球上的生命,又给这些生命提
供丰富的资源.
Ⅰ.化工厂利用海水和贝壳(主要成分 CaCO3)制取金属镁,流程如下:
(1)写出电解无水 MgCl2 时得到的另一种产物在生产生活中的用途
.(任写一
种)
(2)分别写出①和④的化学方程式
、
.
Ⅱ.如图是超市销售的一种加点盐标签上的部分文字说明,碘元素是
人体必须的
(填“常量”或微量:)元素,毎袋该食盐碘元素
的质量为
mg,若成人每天需摄入碘元素 0.15mg,仅靠这种加碘
食盐获取则每天需食用这种食盐
g.
�
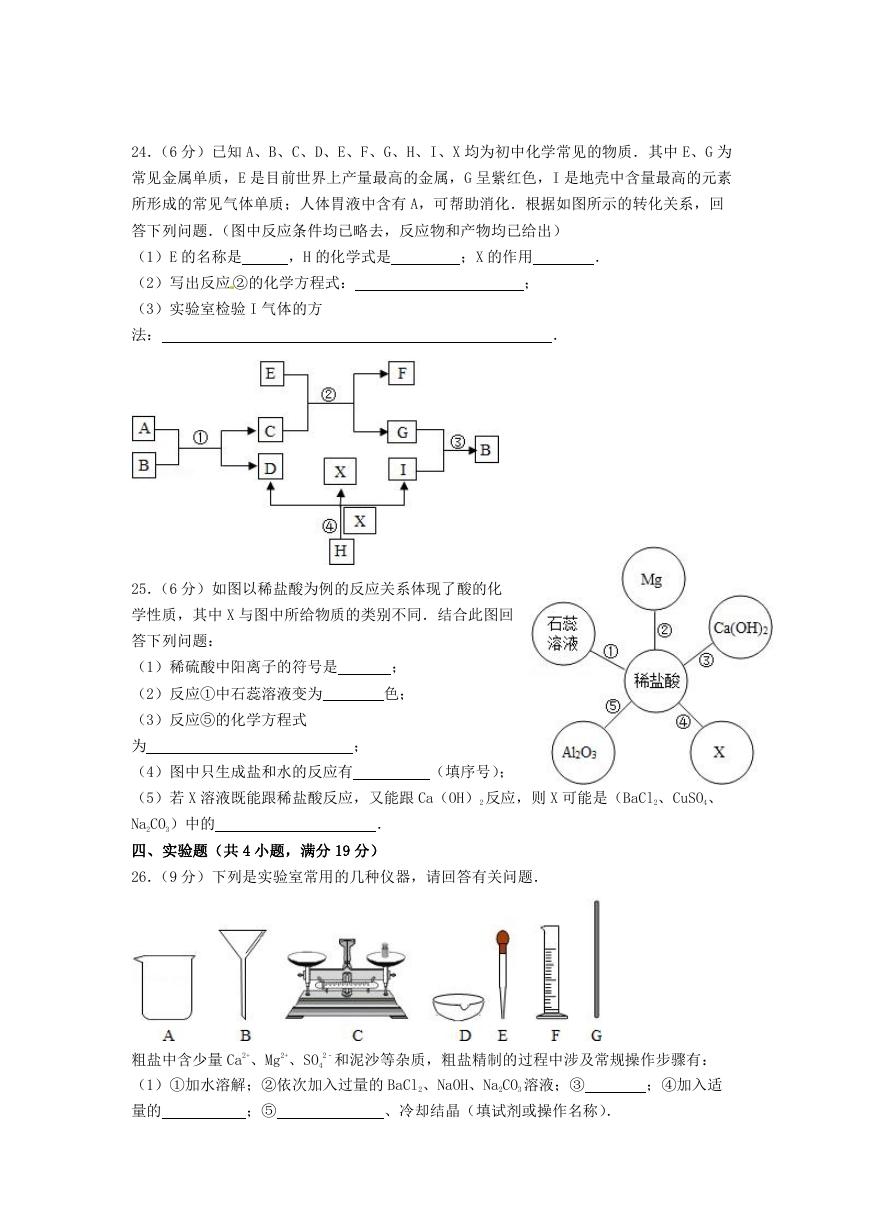
24.(6 分)已知 A、B、C、D、E、F、G、H、I、X 均为初中化学常见的物质.其中 E、G 为
常见金属单质,E 是目前世界上产量最高的金属,G 呈紫红色,I 是地壳中含量最高的元素
所形成的常见气体单质;人体胃液中含有 A,可帮助消化.根据如图所示的转化关系,回
答下列问题.(图中反应条件均已略去,反应物和产物均已给出)
(1)E 的名称是
,H 的化学式是
;X 的作用
.
(2)写出反应 ②的化学方程式:
(3)实验室检验 I 气体的方
法:
;
.
25.(6 分)如图以稀盐酸为例的反应关系体现了酸的化
学性质,其中 X 与图中所给物质的类别不同.结合此图回
答下列问题:
(1)稀硫酸中阳离子的符号是
(2)反应①中石蕊溶液变为
(3)反应⑤的化学方程式
;
色;
为
;
(4)图中只生成盐和水的反应有
(填序号);
(5)若 X 溶液既能跟稀盐酸反应,又能跟 Ca(OH)2 反应,则 X 可能是(BaCl2、CuSO4、
Na2CO3)中的
.[来源:学#科#网 Z#X#X#K]
四、实验题(共 4 小题,满分 19 分)
26.(9 分)下列是实验室常用的几种仪器,请回答有关问题.
粗盐中含少量 Ca2+、Mg2+、SO4
(1)①加水溶解;②依次加入过量的 BaCl2、NaOH、Na2CO3 溶液;③
2﹣和泥沙等杂质,粗盐精制的过程中涉及常规操作步骤有:
;④加入适
量的
;⑤
、冷却结晶(填试剂或操作名称).
�
(2)过滤用到的玻璃仪器有:
、
、
.
(3)蒸发时
(填“能”或“不能”)将溶液直接蒸干.
(4)配置 1000g5.85%的 NaCl 溶液,需
gNaCl;在准确称取固体后,用量筒量取水
时,仰视读数,则所配置溶液溶质质量分时
(填“偏高”或“偏低”)
27.(10 分)世界上每年因锈蚀而报废的金属设备和材料,高达产量的 20%~40%,某实验
小组对铁的燃烧和锈蚀进行如下探究
探究一:铁丝燃烧
如图 1 所示,取 3 根粗细、长度均相同的光亮细铁丝,将其中两根分别盘成螺旋状,在每
根铁丝一端系上粗铜丝,另一端系一根火柴杆,点燃火柴杆待快燃尽时,分别插入充满氧
气的集气瓶中,观察到:观察到:Ⅰ、Ⅱ中铁丝都剧烈燃烧,且Ⅱ中铁丝燃烧比 I 中的更
剧烈;Ⅲ中铁丝没有燃烧.
(1)集气瓶中加入少量水的作用:
(2)为什么Ⅲ中铁丝不能燃烧
(3)分析Ⅱ中铁丝燃烧比Ⅰ中更剧烈的原
因
.
探究二:铁粉腐蚀的条件
.
.
如图 2 所示,将包有样品的滤纸包用大头针固定在橡胶塞上,迅速塞紧,观察到量筒内水
沿着细导管慢慢进广口瓶(容积为 146mL).当温度恢复至室温,且量筒内水面高度不变时
读数(此时瓶内氧气含量近似为零).记录起始和最终量筒的读数以及所需时间如下表.
序号
样品
量筒起始
量筒最终
所需时间
1.0g 铁粉、0.2g 碳和 10 滴水
l.0g 铁粉、0.2g 碳、10 滴水和
少量 NaCl
1
2
3
读数/mL
读数/mL
100
100
\
72
7 2
\
/min
约 120
约 70
\
�
(4)金属腐蚀的过程实际上就是金属元素化合价
(填“升高”或“降低”)的过
程.
(5)实验①和②说明 NaCl 可以
(填“加快”或“减慢”)铁锈蚀的速率.
(6)实验开始后,广口瓶内温度有所上升,说明铁的锈蚀过程是
(填“放热”
或“吸热”)过程.
(7)实验①和③是探究碳对铁锈蚀速率的影响,请在表格空白处填写实验③的样品组成
是
.
(8)该装置还可用于测量空气中氧气的含量,根据上述数据计算氧气的体积含量
是
%(精确到小数点后 1 位),试分析该实验结果出现误差的原因
(写任意一条即可)
28.(4 分)守恒思想是化学中重要的学科思想,电荷守恒便是其中之一,电荷守恒是指溶
液中所有的阳离子所带正电荷之和等于所有阴离子所带负电荷之和.例如:某 Na2SO4 溶液
中 x 个 Na+,y 个 SO4
2﹣,则该溶液电荷守恒可表示为 x=2y.现有一混合溶液,组成如下表
所示:
离子
个数
回答下列问题:
K+
a
Mg2+
b
Cl﹣
c
2﹣
SO4
d
(1)该混合液的电荷守恒可表示为:
(用 a、b、c 表示)
(2)若该溶液中有两种溶质,这两种溶质可以是 KCl 和 MgSO4,也可以
是
和
.
29.(6 分)重铬酸钾(K2Cr2O7Mr=294,铬元素为+6 价,Mr 表示相对分子质量)是一种重要
的化工原料,在皮革工业、有机反应中都有广泛应用.但+6 价格有很强的毒性易污染环
境,使用后,须用绿矾,(FeSO4•7H2O,Mr=278)将其变成毒性+3 价格才能做后续处理.反
应原理是:
6FeSO4•7H2O+K2Cr2O7+7H2SO4═3Fe2(SO4)3+Cr2(SO4)3+K2SO4+49H2O 现有 1.0 吨重铬酸
钾需要处理,计算需绿矾多少吨?(写出计算过程,结果精确到小数点后 1 位)
�













 2023年江西萍乡中考道德与法治真题及答案.doc
2023年江西萍乡中考道德与法治真题及答案.doc 2012年重庆南川中考生物真题及答案.doc
2012年重庆南川中考生物真题及答案.doc 2013年江西师范大学地理学综合及文艺理论基础考研真题.doc
2013年江西师范大学地理学综合及文艺理论基础考研真题.doc 2020年四川甘孜小升初语文真题及答案I卷.doc
2020年四川甘孜小升初语文真题及答案I卷.doc 2020年注册岩土工程师专业基础考试真题及答案.doc
2020年注册岩土工程师专业基础考试真题及答案.doc 2023-2024学年福建省厦门市九年级上学期数学月考试题及答案.doc
2023-2024学年福建省厦门市九年级上学期数学月考试题及答案.doc 2021-2022学年辽宁省沈阳市大东区九年级上学期语文期末试题及答案.doc
2021-2022学年辽宁省沈阳市大东区九年级上学期语文期末试题及答案.doc 2022-2023学年北京东城区初三第一学期物理期末试卷及答案.doc
2022-2023学年北京东城区初三第一学期物理期末试卷及答案.doc 2018上半年江西教师资格初中地理学科知识与教学能力真题及答案.doc
2018上半年江西教师资格初中地理学科知识与教学能力真题及答案.doc 2012年河北国家公务员申论考试真题及答案-省级.doc
2012年河北国家公务员申论考试真题及答案-省级.doc 2020-2021学年江苏省扬州市江都区邵樊片九年级上学期数学第一次质量检测试题及答案.doc
2020-2021学年江苏省扬州市江都区邵樊片九年级上学期数学第一次质量检测试题及答案.doc 2022下半年黑龙江教师资格证中学综合素质真题及答案.doc
2022下半年黑龙江教师资格证中学综合素质真题及答案.doc