2008 年江苏高考化学真题及答案
一、单项选择题:(本题包括 8 小题,每题 3 分,共 24 分。每小题只有一个....选项符合题意)
1.化学与生活、社会密切相关。下列说法不正确的是
A.利用太阳能等清洁能源代替化石燃料,有利于节约资源、保护环境
B.凡含有食品添加剂的食物对人体健康均有害,不可食用
C.为防止电池中的重金属等污染土壤和水体,应积极开发废电池的综合利用技术
D.提倡人们购物时不用塑料袋,是为了防止白色污染
2.下列文字表述与反应方程式对应且正确的是
A.溴乙烷中滴入 AgNO3 溶液检验其中的溴元素:Br-+Ag+==AgBr↓
B.用醋酸除去水垢:CaCO3 + 2H+==Ca2+ + H2O + CO2↑
C.利用腐蚀法制作印刷线路板:Fe3+ + Cu == Fe2+ + Cu2+
D.实验室用液溴和苯在催化剂作用下制溴苯:
FeBr3
+ Br2
Br
+ HBr
3.用 NA 表示阿伏加德罗常数的值。下列叙述正确的是
A.常温常压下的 33.6L 氯气与 27g 铝充分反应,转移电子数为 3NA
B.标准状况下,22.4L 己烷中共价键数目为 19NA
C.由 CO2 和 O2 组成的混合物中共有 NA 个分子,其中的氧原子数为 2NA
D.1L 浓度为 1mol·L-1 的 Na2CO3 溶液中含有 NA 个 CO3
2-
4.下列现象或事实可用同一原理解释的是
A.浓硫酸和浓盐酸长期暴露在空气中浓度降低
B.氯水和活性炭使红墨水褪色
C.漂白粉和水玻璃长期暴露在空气中变质
D.乙炔和乙烯使溴的四氯化炭溶液褪色
5.镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为
KOH 溶液,其充、放电按下式进行:Cd + 2NiOOH + 2H2O
放电
充电
Cd(OH)2 + 2Ni(OH)2
有关该电池的说法正确的是
A.充电时阳极反应:Ni(OH)2 -e— + OH- == NiOOH + H2O
B.充电过程是化学能转化为电能的过程
C.放电时负极附近溶液的碱性不变
D.放电时电解质溶液中的 OH - 向正极移动
6.下列装置或操作能达到实验目的的是
( C
)
7.下列排列顺序正确的是
①热稳定性:H2O>HF>H2S
③酸性:H3PO4>H2SO4>HClO4
②原子半径:Na>Mg>O
④结合质子能力:OH->CH3COO->Cl-
�
A.①③
B.②④
C.①④
D.②③
8.在下列溶液中,各组离子一定能够大量共存的是
A.使酚酞试液变红的溶液: Na+、Cl-、SO4
B.使紫色石蕊试液变红的溶液:Fe2+、Mg2+、NO3
C. c(H+)=10-12 mol·L-1 的溶液:K+、Ba2+、Cl-、Br-
D.碳酸氢钠溶液:K+、SO4
2-、Cl-、H+
2-、Fe3+
-、Cl-
二、不定项选择题(本题包括 6 小题,每小题 4 分,共 24 分。每小题只有一个或两个
.....选项
符合题意。若正确答案只包括一个选项,多选时,该题为 0 分;若正确答案包括两个选项,
只选一个且正确的得 2 分,选两个且都正确的得满分,但只要选错一个,该小题就为 0 分)
9.以下实验或操作不能达到目的的是
A.用溴水鉴别苯、乙醇、四氯化碳
B.准确称取 0.4000g 的 NaOH 固体配成 1000mL 浓度为 0.01000 mol·L-1 的溶液
C.为除去苯中的少量苯酚,向混合物中加入适量的溴水后过滤
D.用激光笔检验淀粉溶液的丁达尔现象
10.下列离子方程式正确的是
A.用惰性电极电解饱和氯化钠溶液:2Cl- + 2H+
电解
H2↑+ Cl2↑
B.用银氨溶液检验乙醛中的醛基:
CH3CHO +2Ag(NH3)2
+ + 2OH- 水浴加热
CH3COO- + NH4
+ +3NH3 + 3Ag↓+ H2O
C.苯酚钠溶液中通入少量 CO2:CO2 + H2O + 2C6H5O-
D.Na2SO3 溶液使酸性 KMnO4 溶液褪色:
2C6H5OH + 2CO3
2-
5SO3
2- + 6H+ + 2MnO4
- == 5SO4
2- + 2Mn2+ 3H2O
11.香兰素是重要的香料之一,它可由丁香酚经多步反应合成。
OH
OCH3
……
OH
OCH3
CH2CH CH2
丁香酚
CHO
香兰素
有关上述两种化合物的说法正确的是
A.常温下,1mol 丁香酚只能与 1molBr2 反应
B.丁香酚不能与 FeCl3 溶液发生显色反应
C.1mol 香兰素最多能与 3mol 氢气发生加成反应
D.香兰素分子中至少有 12 个原子共平面
12.下列溶液中有关物质的量浓度关系正确的是
A.pH=2 的 HA 溶液与 pH=12 的 MOH 溶液任意比混合:
c(H+) + c(M+) == c(OH-) + c(A-)
B.pH 相等的 CH3COONa、NaOH 和 Na2CO3 三种溶液:
c(NaOH)<c(CH3COONa)<c(Na2CO3)
C.物质的量浓度相等的 CH3COOH 和 CH3COONa 溶液等体积混合:
c(CH3COO-) +2c(OH-) == 2c(H+) + c(CH3COOH)
�
D.0.1mol·L-1 的 NaHA 溶液,其 pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-)
13.研究反应物的化学计量数与产物之间的关系时,使用类似数轴的方法可以收到的直观形
象的效果。下列表达不正确...的是
A.密闭容器中 CuO 和 C 高温反应的气体产物:
1
C O
C O
C O 2
2
C O 2
n (C u O )
n (C )
B.Fe 在 Cl2 中的燃烧产物:
1 .5
1
F e C l2
F e C l2
F e C l3
F e C l3
n (C l2)
n (F e )
C.AlCl3 溶液中滴加 NaOH 后铝的存在形式:
n(NaOH)
n(AlCl3)
-
AlO2
3
Al(OH)3
Al3+
4
Al(OH)3
-
AlO2
D.氨水与 SO2 反应后溶液中的铵盐:
1
2
NH4HSO4 NH4HSO4
(NH4)2SO4
(NH4)2SO4
n(NH3 H2O)
n(SO2)
14.某有机样品 3.1g 完全燃烧,燃烧后的混合物通入过量的澄清石灰水,石灰水共增重 7.1g,
经过滤得到 10g 沉淀。该有机样品可能是
A.乙二醇
B.乙醇
C.乙醛
D.甲醇和丙三醇的混合物
�
第二卷(非选择题 共 72 分)
三、(本题包括 1 小题,共 10 分)
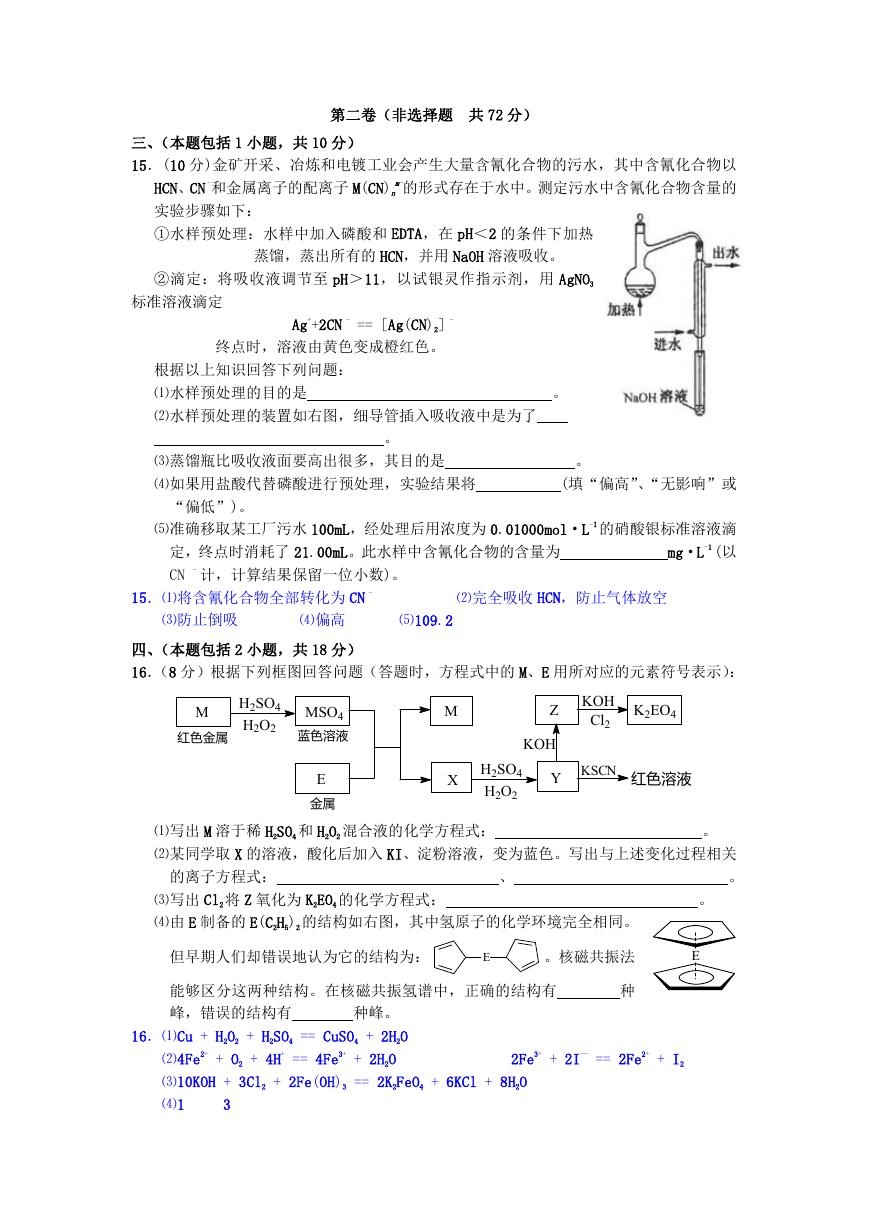
15.(10 分)金矿开采、冶炼和电镀工业会产生大量含氰化合物的污水,其中含氰化合物以
m-的形式存在于水中。测定污水中含氰化合物含量的
HCN、CN -和金属离子的配离子 M(CN)n
实验步骤如下:
①水样预处理:水样中加入磷酸和 EDTA,在 pH<2 的条件下加热
蒸馏,蒸出所有的 HCN,并用 NaOH 溶液吸收。
②滴定:将吸收液调节至 pH>11,以试银灵作指示剂,用 AgNO3
标准溶液滴定
Ag++2CN - == [Ag(CN)2] -
终点时,溶液由黄色变成橙红色。
根据以上知识回答下列问题:
⑴水样预处理的目的是
⑵水样预处理的装置如右图,细导管插入吸收液中是为了
。
。
⑶蒸馏瓶比吸收液面要高出很多,其目的是
⑷如果用盐酸代替磷酸进行预处理,实验结果将
。
(填“偏高”、“无影响”或
“偏低”)。
⑸准确移取某工厂污水 100mL,经处理后用浓度为 0.01000mol·L-1 的硝酸银标准溶液滴
mg·L-1 (以
定,终点时消耗了 21.00mL。此水样中含氰化合物的含量为
CN - 计,计算结果保留一位小数)。
15.⑴将含氰化合物全部转化为 CN -
⑵完全吸收 HCN,防止气体放空
⑶防止倒吸
⑷偏高
⑸109.2
四、(本题包括 2 小题,共 18 分)
16.(8 分)根据下列框图回答问题(答题时,方程式中的 M、E 用所对应的元素符号表示):
M
红色金属
H2SO4
H2O2
MSO4
蓝色溶液
E
金属
M
X
KOH
Cl2
K2EO4
Z
KOH
H2SO4
H2O2
Y KSCN 红色溶液
⑴写出 M 溶于稀 H2SO4 和 H2O2 混合液的化学方程式:
⑵某同学取 X 的溶液,酸化后加入 KI、淀粉溶液,变为蓝色。写出与上述变化过程相关
。
的离子方程式:
。
、
⑶写出 Cl2 将 Z 氧化为 K2EO4 的化学方程式:
⑷由 E 制备的 E(C2H5)2 的结构如右图,其中氢原子的化学环境完全相同。
但早期人们却错误地认为它的结构为:
E
。核磁共振法
能够区分这两种结构。在核磁共振氢谱中,正确的结构有
峰,错误的结构有
种峰。
种
。
E
16.⑴Cu + H2O2 + H2SO4 == CuSO4 + 2H2O
⑵4Fe2+ + O2 + 4H+ == 4Fe3+ + 2H2O
⑶10KOH + 3Cl2 + 2Fe(OH)3 == 2K2FeO4 + 6KCl + 8H2O
⑷1
3
2Fe3+ + 2I— == 2Fe2+ + I2
�
17.(10 分)工业上制备 BaCl2 的工艺流程图如下:
炭
重晶石矿 高温焙烧
盐酸
溶解
气体
吸收
滤液
过滤
结晶
产物
某研究小组在实验室用重晶石(主要成分 BaSO4)对工业过程进行模拟实验。查表得
BaSO4(s) + 4C(s)
BaSO4(s) + 2C(s)
高温
高温
4CO(g) + BaS(s) △H1 = 571.2 kJ·mol-1
2CO2(g) + BaS(s) △H2= 226.2 kJ·mol-1
⑴气体用过量 NaOH 溶液吸收,得到硫化钠。Na2S 水解的离子方程式为
⑵向 BaCl2 溶液中加入 AgNO3 和 KBr,当两种沉淀共存时, c(Br-)
c(Cl-)
=
[Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10]
⑶反应 C(s) + CO2(g)
高温
2CO(g)的△H=
kJ·mol-1。
⑷实际生产中必须加入过量的炭,同时还要通入空气,其目的是
17.⑴S2- + H2O
⑵2.7×10-3
⑷使 BaSO4 得到充分的还原(或提高 BaS 的产量)
HS- +OH-
⑶172.5
,
HS- + H2O
H2S +OH-(可不写)
①
②
。
。
。
①②为吸热反应,炭和氧气反应放热维持反应所需高温
五、(本题包括 1 小题,共 10 分)
18.(10 分)“温室效应”是全球关注的环境问题之一。CO2 是目前大气中含量最高的一种温
室气体。因此,控制和治理 CO2 是解决温室效应的有效途径。
⑴下列措施中,有利于降低大气中 CO2 浓度的有:
。(填字母)
a.减少化石燃料的使用
c.采用节能技术
b.植树造林,增大植被面积
d.利用太阳能、风能
⑵将 CO2 转化成有机物可有效实现碳循环。CO2 转化成有机物的例子很多,如:
a.6CO2 + 6H2O
光合作用
C6H12O6 +6O2
b.CO2 + 3H2
催化剂
△
CH3OH +H2O
c.CO2 + CH4
催化剂
△
CH3COOH
d.2CO2 + 6H2
催化剂
△
CH2==CH2 + 4H2O
以上反应中,最节能的是
,原子利用率最高的是
⑶文献报道某课题组利用 CO2 催化氢化制甲烷的研究过程如下:
。
CO2
H2O
铁粉
镍粉
300℃
6h
冷却
气体
收集
过滤
检测
检测
检测
固体
滤液
反应结束后,气体中检测到 CH4 和 H2,滤液中检测到 HCOOH,固体中检测到镍粉和 Fe3O4。
�
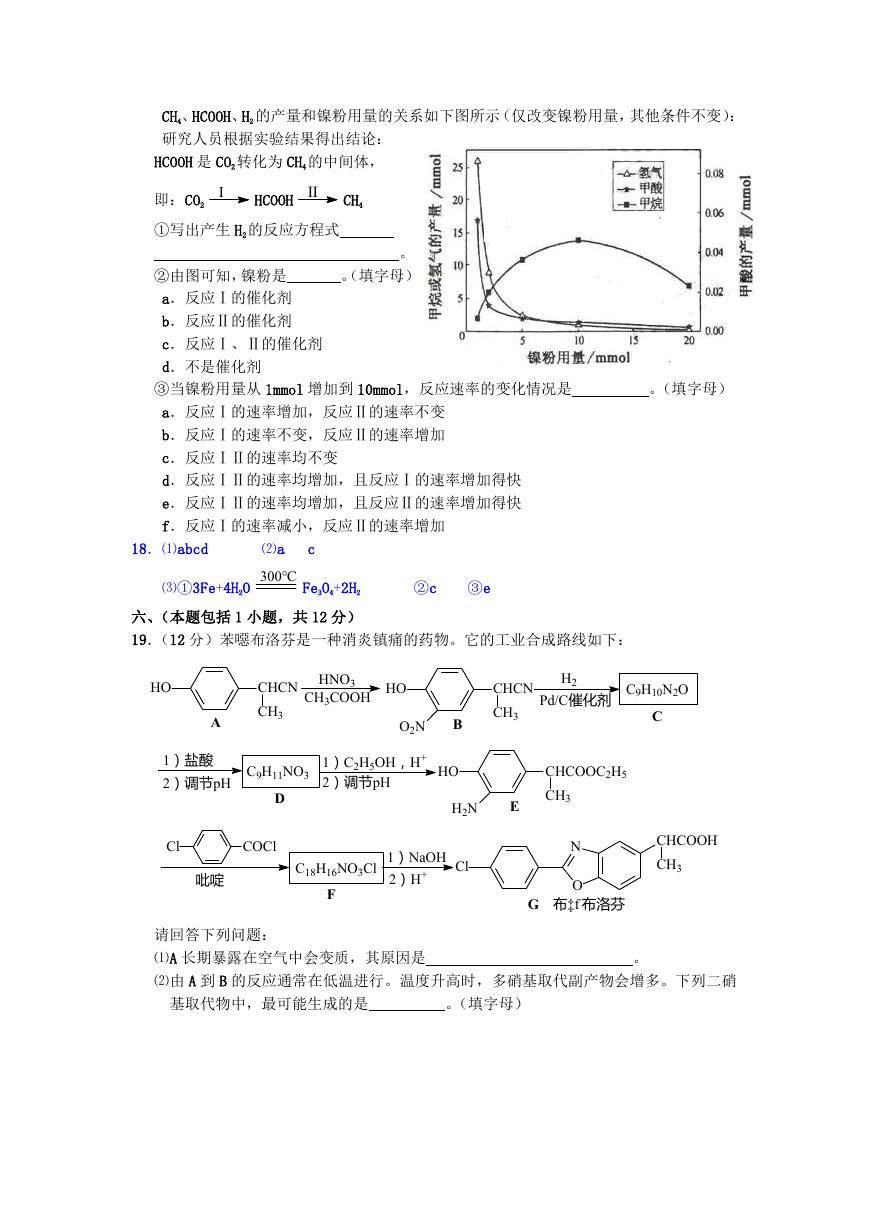
CH4、HCOOH、H2 的产量和镍粉用量的关系如下图所示(仅改变镍粉用量,其他条件不变):
研究人员根据实验结果得出结论:
HCOOH 是 CO2 转化为 CH4 的中间体,
即:CO2
Ⅰ
HCOOH Ⅱ
CH4
①写出产生 H2 的反应方程式
。
。(填字母)
②由图可知,镍粉是
a.反应Ⅰ的催化剂
b.反应Ⅱ的催化剂
c.反应Ⅰ、Ⅱ的催化剂
d.不是催化剂
③当镍粉用量从 1mmol 增加到 10mmol,反应速率的变化情况是
。(填字母)
a.反应Ⅰ的速率增加,反应Ⅱ的速率不变
b.反应Ⅰ的速率不变,反应Ⅱ的速率增加
c.反应ⅠⅡ的速率均不变
d.反应ⅠⅡ的速率均增加,且反应Ⅰ的速率增加得快
e.反应ⅠⅡ的速率均增加,且反应Ⅱ的速率增加得快
f.反应Ⅰ的速率减小,反应Ⅱ的速率增加
18.⑴abcd
⑵a
c
⑶①3Fe+4H2O
300℃
Fe3O4+2H2
②c
③e
六、(本题包括 1 小题,共 12 分)
19.(12 分)苯噁布洛芬是一种消炎镇痛的药物。它的工业合成路线如下:
HNO3
CH3COOH
HO
CHCN
CH3
H2
Pd/C催化剂
CHCN
CH3
C9H10N2O
C
HO
A
1)盐酸
2)调节pH
O2N
B
1)C2H5OH,H+
2)调节pH
HO
C9H11NO3
D
H2N
E
CHCOOC2H5
CH3
N
O
布‡f 布洛芬
G
CHCOOH
CH3
Cl
COCl
吡啶
C18H16NO3Cl
F
1)NaOH
2)H+
Cl
请回答下列问题:
⑴A 长期暴露在空气中会变质,其原因是
⑵由 A 到 B 的反应通常在低温进行。温度升高时,多硝基取代副产物会增多。下列二硝
。
基取代物中,最可能生成的是
。(填字母)
�
OH
NO2
O2N
a.
CH CN
CH3
O2N
b.
O2N
OH
CH CN
CH3
c.
O2N
OH
NO2
CH CN
CH3
d.
O2N
OH
NO2
CH CN
CH3
⑶在 E 的下列同分异构体中,含有手性碳原子的分子是
。(填字母)
HO
a.
H2N
c. HO
H2N
CH2CHCOOCH3
CH3
HO
b.
H2N
CH3
CHCHCOOH
CH3
d. HO
H2N
CH2COOCH(CH3)2
CH3
CCH2COOH
CH3
⑷F 的结构简式
⑸D 的同分异构体 H 是一种α-氨基酸,H 可被酸性 KMnO4 溶液氧化成对苯二甲酸,则 H
。高聚物 L 由 H 通过肽键连接而成,L 的结构简式
。
的结构简式是
是
。
19.⑴酚类化合物易被空气中的 O2 氧化
⑵a
⑶ac
⑷
Cl
N
O
CHCOOC2H5
CH3
HOCH2
⑸
CHCOOH
NH2
O
C
NH
CH
n
或
H
NH
CH
O
C
OH
CH2OH
CH2OH
七、(本题包括 1 小题,共 10 分)
20.(10 分)将一定量的 SO 和含 0.7mol 氧气的空气(忽略 CO2)放入一定体积的密闭容器
中,550℃时,在催化剂作用下发生反应:2SO2+O2
2SO3(正反应放热)。反应达到
平衡后,将容器中的混合气体通过过量 NaOH 溶液,气体体积减少了 21.28L;再将剩余
气体通过焦性没食子酸的碱性溶液吸收 O2,气体的体积又减少了 5.6L(以上气体体积均
为标准状况下的体积)。(计算结果保留一位小数)
请回答下列问题:
(1)判断该反应达到平衡状态的标志是
。(填字母)
a.SO2 和 SO3 浓度相等
c.容器中气体的压强不变
e.容器中混合气体的密度保持不变
b.SO2 百分含量保持不变
d.SO3 的生成速率与 SO2 的消耗速率相等
(2)欲提高 SO2 的转化率,下列措施可行的是
。(填字母)
a.向装置中再充入 N2
b.向装置中再充入 O2
�
c.改变反应的催化剂
d.升高温度
(3)求该反应达到平衡时 SO2 的转化率(用百分数表示)。
(4)若将平衡混合气体的 5%通入过量的 BaCl2 溶液,生成沉淀多少克?
20.(10 分)
(1)bc
(2)b
(3)消耗的 O2 物质的量:
45.0
mol
7.0
mol
45.0
6.5
L
/4.22
L
mol
2
9.0
mol
mol
28.21
L
95.0
/4.22
L
mol
95.0
mol
mol
生成的 SO3 物质的量:
SO2 和 SO3 的物质的量和:
反应前的 SO2 物质的量:
28.21
/4.22
L
9.0
95.0
L
mol
mol
mol
SO2 的转化率:
%7.94%100
( 4 ) 在 给 定 的 条 件 下 , 溶 液 呈 强 酸 性 , BaSO3 不 会 沉 淀 。 因 此 BaSO4 的 质 量 是 :
9.0
mol
05.0
233
g
/
mol
5.10
g
八、(本题包括 1 小题,共 12 分)
下列两题分别对应于“物质结构与性质”和“实验化学”两个选修课程模块的内容,请.
你选择其中一题作答
.........,如果两题全做,则按 A 题评分。
21.(12 分)
A. 已知 A、B、C、D、E 都是周期表中前四周期的元素,它们的核电荷数 A<B<C<D<E。
其中 A、B、C 是同一周期的非金属元素。化合物 DC 的晶体为离子晶体,D 的二价阳离子
与 C 的阴离子具有相同的电子层结构。AC2 为非极性分子。B、C 的氢化物的沸点比它们
同族相邻周期元素氢化物的沸点高。E 的原子序数为 24,ECl3 能与 B、C 的氢化物形成
六配位的配合物,且两种配体的物质的量之比为 2∶1,三个氯离子位于外界。请根据以
上情况,回答下列问题:(答题时,A、B、C、D、E 用所对应的元素符号表示)
(1)A、B、C 的第一电离能由小到大的顺序为
(2)B 的氢化物的分子空间构型是
(3)写出化合物 AC2 的电子式
杂化。
;一种由 B、C 组成的化合物与 AC2 互为等
。其中心原子采取
。
电子体,其化学式为
。
(4)E 的核外电子排布式是
。
(5)B 的最高价氧化物对应的水化物的稀溶液与 D 的单质反应时,B 被还原到最低价,
,ECl3 形成的配合物的化学式为
该反应的化学方程式是
。
B.醇与氢卤酸反应是制备卤代烃的重要方法。实验室制备溴乙烷和 1-溴丁烷的反应如下:
NaBr+H2SO4
R-OH+HBr
HBr+NaHSO4
R-Br+H2O
①
②
可能存在的副反应有:醇在浓硫酸的存在下脱水生成烯和醚,Br—被浓硫酸氧化为 Br2 等。
有关数据列表如下;
密度/g·cm-3
沸点/℃
请回答下列问题:
乙醇
0.7893
78.5
溴乙烷
1.4604
38.4
正丁醇
0.8098
117.2
1-溴丁烷
1.2758
101.6
�














 2023年江西萍乡中考道德与法治真题及答案.doc
2023年江西萍乡中考道德与法治真题及答案.doc 2012年重庆南川中考生物真题及答案.doc
2012年重庆南川中考生物真题及答案.doc 2013年江西师范大学地理学综合及文艺理论基础考研真题.doc
2013年江西师范大学地理学综合及文艺理论基础考研真题.doc 2020年四川甘孜小升初语文真题及答案I卷.doc
2020年四川甘孜小升初语文真题及答案I卷.doc 2020年注册岩土工程师专业基础考试真题及答案.doc
2020年注册岩土工程师专业基础考试真题及答案.doc 2023-2024学年福建省厦门市九年级上学期数学月考试题及答案.doc
2023-2024学年福建省厦门市九年级上学期数学月考试题及答案.doc 2021-2022学年辽宁省沈阳市大东区九年级上学期语文期末试题及答案.doc
2021-2022学年辽宁省沈阳市大东区九年级上学期语文期末试题及答案.doc 2022-2023学年北京东城区初三第一学期物理期末试卷及答案.doc
2022-2023学年北京东城区初三第一学期物理期末试卷及答案.doc 2018上半年江西教师资格初中地理学科知识与教学能力真题及答案.doc
2018上半年江西教师资格初中地理学科知识与教学能力真题及答案.doc 2012年河北国家公务员申论考试真题及答案-省级.doc
2012年河北国家公务员申论考试真题及答案-省级.doc 2020-2021学年江苏省扬州市江都区邵樊片九年级上学期数学第一次质量检测试题及答案.doc
2020-2021学年江苏省扬州市江都区邵樊片九年级上学期数学第一次质量检测试题及答案.doc 2022下半年黑龙江教师资格证中学综合素质真题及答案.doc
2022下半年黑龙江教师资格证中学综合素质真题及答案.doc