2004 年江西高考理科综合真题及答案
第 I 卷(选择题 共 126 分)
在下列各题的四个选项中,只有一个选项是符合题目要求的。
以下数据可供解题时参考:
原子量:H 1
C 12
N 14
O 16
Na 23
P 31
1. 在临床治疗上已证实,将受 SARS 病毒感染后治愈患者(甲)的血清,注射到另一 SARS 患者(乙)体内能
够提高治疗效果。甲的血清中具有治疗作用的物质是
A.疫苗
B.外毒素
D.抗体
C.抗原
2. 一个初级精母细胞在减数分裂的第一次分裂时,有一对同源染色体不发生分离;所形成的次级精母细胞减
数分裂的第二次分裂正常。另一个初级精母细胞在减分裂的第一次分裂正常;减数分裂的第二次分裂时在
两个次级精母细胞中,有一个次级精母细胞的 1 条染色体的姐妹染色单体没有分开。以上两个初级精母细
胞可产生染色体数目不正常的配子(以下简称为不正常的配子)。上述两个初级精母细胞减数分裂的最终
结果应当是
A.两者产生的配子全部都不正常
B.前者产生一半不正常的配子,后者产生的配子都不正常
C.两者都只产生一半不正常的配子
D.前者产生全部不正常的配子,后者只产生一半不正常的配子
3. 离体的叶绿体在光照下进行稳定光合作用时,如果突然中断 CO2 气体的供应,短暂时间内叶绿体中 C3 化合
物与 C5 化合物相对含量的变化是
A.C3 化合物增多、C5 化合物减少
C.C3 化合物减少,C5 化合物增多
B.C3 化合物增多,C5 化合物增多
D.C3 化合物减少,C5 化合物减少
4. 自然界中,一种生物某一基因及其三种突变基因决定的蛋白质的部分氨基酸序列如下:
亮氨酸
亮氨酸
亮氨酸
苏氨酸
精氨酸
精氨酸
精氨酸
精氨酸
苯丙氨酸
苯丙氨酸
亮氨酸
苯丙氨酸
正常基因
突变基因 1
突变基因 2
突变基因 3
根据上述氨基酸序列确定这三种突变基因 DNA 分子的改变是
A.突变基因 1 和 2 为一个碱基的替换,突变基因 3 为一个碱基的增添
B.突变基因 2 和 3 为一个碱基的替换,突变基因 1 为一个碱基的增添
C.突变基因 1 为一个碱基的替换,突变基因 2 和 3 为一个碱基的增添
D.突变基因 2 为一个碱基的替换,突变基因 1 和 3 为一个碱基的增添
苏氨酸
苏氨酸
苏氨酸
酪氨酸
脯氨酸
脯氨酸
脯氨酸
丙氨酸
5. 生活在一个生物群中的两个种群(a、b)的数量变化如图所示,下列判断正确的是
A.a 种群与 b 种群为捕食关系,a 种群依赖于 b 种群
B.a 种群与 b 种群为竞争关系,竞争强度由强到弱
C.a 种群为 S 型增长,其增长受本身密度制约
D.b 种群为 J 型增长,始终受到 a 种群的制约
6. 能与人体备注中血红蛋白结合的一种有毒气体是
A.氯气
B.氮气
C.一氧化碳
D.甲烷
种群数量
a
K
O
b
时间
�
7. 下列离子中,所带电荷数与该离子的核外电子层数相等的是
D.H+
A.Al3+
B.Mg2+
C.Be2+
8. 2003 年,IUPAC(国际纯粹与应用化学联合会)推荐原子序数为 110 的元素的符号为 Ds,以纪念该元素的
发现地(Darmstadt,德国)。下列关于 Ds 的说法不正确的是
A.Ds 原子的电子层数为 7
C.Ds 原子的质量数为 110
B.Ds 是超铀元素
D.Ds 为金属元素
9. 下列说法中不正确的是
A.磷酸的摩尔质量与 6.02×1023 个磷酸分子的质量在数值上相等
B.6.02×1023 个氮分子和 6.02×1023 个氢分子的质量比等于 14∶1
C.32g 氧气所含的原子数目为 2×6.02×1023
D.常温常压下,0.5×6.02×1023 个一氧化碳分子所占体积是 11.2L
10. 常温时,以下 4 种溶液 pH 最小的是
A.0.01mol ·L-1 醋酸溶液
B.0.02mol ·L-1 醋酸与 0.02mol ·L-1NaOH 溶液等体积混合液
C.0.03mol ·L-1 醋酸与 0.01mol ·L-1NaOH 溶液等体积混合液
D.pH = 2 的盐酸与 pH = 12 的 NaOH 溶液等体积混合液
11. 下列离子方程式正确的是
A.澄清的石灰水与稀盐酸反应 Ca(OH)2 + 2H+ === Ca2+ + 2H2O
B.钠与水的反应 Na + 2H2O === Na+ + 2OH -+ H2↑
C.铜片插入硝酸银溶液中 Cu + Ag+ === Cu2+ + Ag
D.大理石溶于醋酸的反应 CaCO3 + 2CH3COOH === Ca2+ + 2CH3COO- +CO2↑+ H2O
12. 取 a g 某物质在氧气中完全燃烧,将其产物跟足量的过氧化钠固体完全反应,反应后固体的质量恰好
也增加了 a g。下列物质中不能满足上述结果的是
A.H2
C.C6H12O6
B.CO
D.C12H22O11
13. 已知 25℃、101kPa 下,石墨、金刚石燃烧的热化学方程式分别为
C(石墨) + O2(g) === CO2(g) ΔH = -393.51kJ ·mol-1
C(金刚石) + O2(g) === CO2(g) ΔH = -395.41kJ ·mol-1
据此判断,下列说法中正确的是
A.由石墨制备金刚石是吸热反应;石墨的能量比金刚石的低
B.由石墨制备金刚石是吸热反应;石墨的能量比金刚石的高
C.由石墨制备金刚石是放热反应;石墨的能量比金刚石的低
D.由石墨制备金刚石是放热反应;石墨的能量比金刚石的高
14. 本题中用大写字母代表原子核。E经α衰变成为 F,再经β衰变成为 G,再经α衰变成为 H。上述系列
衰变可记为下式:E --α→ F --β→ G --α→H
另一系列衰变如下:P -β→ Q --β→ R --α→S
已知 P是 F的同位素,则
A.Q是 G的同位素,R是 H的同位素
C.R是 G的同位素,S是 H的同位素
B.R是 E的同位素,S是 F的同位素
D.Q是 E的同位素,R是 F的同位素
�
15. 如图所示,ad、bd、cd是竖直面内三根固定的光滑细杆,a、b、c、d位于同一圆
周上,a点为圆周的最高点,d点为最低点。每根杆上都套着一个小滑环(图中未画
出),三个滑环 a、b、c分别从处释放(初速为 0),用 t1、t2、t3 依次表示滑环到达 d
所用的时间,则
A.t1 < t2 < t3
D.t1 = t2 = t3
C.t3 > t1 > t2
B.t1 > t2 > t3
16. 若以 μ表示水的摩尔质量,υ表示在标准状态下水蒸气的摩尔体积, ρ为表示
b
c
a
d
在标准状态下水蒸气的密度,NA为阿伏加德罗常数,m、Δ分别表示每个水分子的质量和体积,下面是四
个关系式
① NA = υρ
② ρ = μ
③ m = μ
④Δ=
y/m
A Δ
A
υ
A
其中
A.①和②都是正确的;
C.②和④都是正确的;
B.①和③都是正确的;
D.①和④都是正确的。
17. 一列简谐横波沿 x轴负方向传播,图 1 是 t = 1s 时的波形图,
图 2 是波中某振动质元位移随时间变化的振动图线(两图用同同一时
间起点),则图 2 可能是图 1 中哪个质元的振动图线?
A.x = 0 处的质元;
C.x = 2m 处的质元;
B.x = 1m 处的质元;
D.x = 3m 处的质元。
O
1 2 3 4 5 6
x/m
5
6
图 1
y/m
O
1 2 3 4 5 6
t/s
图 2
18. 图中电阻 R1、R2、R3 的阻值相等,电池的内不计。开关 K 接通后流过 R2 的电流是 K 接通前的
A. 1
B. 2
C. 1
D. 1
19. 下表给出了一些金属材料的逸出功。
材料
逸出功
(10-19J)
铯
3.0
钙
4.3
镁
5.9
铍
6.2
钛
6.6
现用波长为 400nm 的单色光照射上述材料,能产生光电效应的材料最多有几种?
(普朗克常量 h = 6.6×10-34J·s,光速 c = 3.00×108m/s)
A.2 种
C.4 种
D.5 种
B.3 种
20. 下列哪个说法是正确的?
A.体操运动员双手握住单杠吊在空中不动时处于失重状态;
B.蹦床运动员在空中上升和下落过程中都处于失重状态;
C.举重运动员在举起杠铃后不动的那段时间内处于超重状态;
D.游泳运动员仰卧在水面静止不动时处于失重状态。
21. 发出白光的细线光源 ab,长度为 l0,竖直放置,上端 a恰好在水面以下,
虑线光源 ab发出的靠近水面法线(图中的虚线)的细光速经水面折射后所成
于水对光有色散作用,若以 l1 表示红光成的像的长度,l2 表示紫光成的像的
如图。现考
的 像,由
长度,则
水
a
b
�
A.l1
l2>l0
C.l2>l1>l0
D.l226.
(15 分)某有机化合物 A 的结构简式如
下:
H―――C
HO-C
│
││
CH2―――C
――C
H 2
╲
H ―
╲
NH
╱
H ―――C
╱
H 2
O
│
│
CH-O-C-CH-
│
CH 2OH
⑴A 分子式是
⑵A 在 NaOH 水溶液中加热反应得到 B 和 C,C 是芳香化合物。B 和 C 的结构简式是 B:
。
,
C:
。该反应属于
反应。
⑶室温下,C 用稀盐酸酸化得到 E,E 的结构简式是
⑷在下列物质中,不能与 E 发生化学反应的是(填写序号)
①浓 H2SO4 和浓 HNO3 的混合液 ②CH 3CH 2OH (酸催化)
④Na
⑤CH 3COOH (酸催化)
。
。
③CH 3CH 2 CH 2CH 3
⑸写出同时符合下列两项要求的 E 的所有同分异构体的结构简式。
①化合物是 1,3,5-三取代苯
②苯环上的三个取代基分别为甲基、羟基和含有-C-O-结构的基团
O
│
│
27.
(15 分)电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液 a;X、Y 是两块电极板,
通过导线与直流电源相连。请回答以下问题:
⑴若 X、Y 都是惰性电极,a 是饱和 NaCl 溶液,实验开始时,同时在两边各滴入
几滴酚酞试液,则
A
①电解池中 X 极上的电极反应式是
②Y 电极上的电极反应式是
。在 X 极附近观察到的现象是
。
,检验该电极反应产物的方法是
⑵如要用电解方法精炼粗铜,电解液 a 选用 CuSO4 溶液,则
①X 电极的材料是
②Y 电极的材料是
(说明:杂质发生的电极反应不必写出)
,电极反应式是
,电极反应式是
。
。
。
X
a
Y
28. (14 分)有 A、B、C、D、E、F、G7 瓶不同物质的溶液,它们各是 Na2CO3、Na2SO4、KCl、AgNO3、MgCl3、
Ca(NO3)2 和 Ba (OH )2 溶液中的一种。为了鉴别,各取少量溶液进行两两混合,实验结果如表所示。表中“↓”
表示生成沉淀或微溶化合物,“-”表示观察不到明显变化。试回答下面问题。
⑴A 的化学式是
⑵写出其余几种物质的化学式。B:
E:
,G 的化学式是
,F:
。
。判断理由是
。
,C:
,D:
,
A
B
C
D
E
F
G
A - - - - - - ↓
B - - - - ↓ ↓ ↓
29.
(16 分)恒温下,将 a mol N2 与 b mol H2 的混合气体通入一个固
2NH3(g)
定容积的密闭容器中,发生如下反应:
N2 (g) + 3 H2(g)
⑴若反应达平衡时某时刻 t时,nt(N2) = 13mol,nt(NH3) = 6mol,
计算 a的值
⑵反应达平衡时,混合气体的体积为 726.8L(标况下),其中 NH3
的含量(体积分数)为 25%。计算平移时 NH3 的物质的量。
⑶原混合气体与平衡混合气体的总物质的量之比(写出最简整数比,下同),n(始)∶n(平) =
D -
E - ↓ - ↓ - ↓ -
F - ↓ ↓ ↓ ↓ - ↓
G ↓ ↓ ↓ ↓ - ↓ -
C - - ― ↓
↓ ↓
↓ - ↓ ↓ ↓
。
�
⑷原混合气体中,a∶b =
⑸达到平衡时,N2 和 H2 的转化率之比,α(N2)∶α (H2)=
⑹平衡混合气体中,n(N2)∶n(H2)∶n(NH3) =
。
。
。
30.
(20 分)已知柿子椒果实圆锥形(A)对灯笼(a)为显性,红色(B)对黄色(b)为显性一,辣味(C)对甜味(c)
为显性,假定这三对基因自由组合。现有以下 4 个纯合亲本:
亲本
甲
乙
丙
丁
果形
灯笼形
灯笼形
圆锥形
圆锥形
果色
红色
黄色
红色
黄色
果味
辣味
辣味
甜味
甜味
⑴利用以上亲本进行杂交,F2 能出现灯笼形、黄色、甜味果实的植株的亲本组合有
⑵上述亲本组合中,F2 出现灯笼形、黄色、甜味果实的植株比例最高的亲本组合是
这种亲本组合杂交 F1 的基因型和表现型是
植株在该 F2 中出现的比例是
,其 F2 的全部表现型有
。
。
,其基因型为
,
,灯笼形、黄色、甜味果实的
31.
(22 分)将等量萌发的种子和煮沸自然冷却后的种子分别放入甲、乙两试管中,如下图所示(本实验中石
蜡油短期内不影响生物的生长)。两试管中均无空气存在。
据图分析回答:
⑴甲试管放置几个小时后,管内顶部出现气泡,其中的气体成分主要是
;将该气体引入
溶液中,可使该溶液变混浊。
⑵甲试管中产生气泡的现象是种子
⑶乙试管在与甲试管同样的时间内,试管内顶部未出现气泡,原因是
⑷乙试管继续放置几天,一些微生物开始繁殖,导致试管内顶部也出现少量气体,这是这些微生
进行造成的,写出表示这一过程的反应式
。
。
物从试管中的
营养要素可归纳成
获得了所需要的营养物质进行新陈代谢的结果。一般来说,微生物所需的
、
、
、
和
五大类。
⑸这些微生物可能的来源是(答出两个来源即可)
。
甲试管
乙试管
萌发的种子
铁丝网
石蜡油
煮沸冷却后的种子
铁丝网
石蜡油
�
理科综合能力测试参考答案
Ⅰ卷包括 21 小题,每题 6 分,共 126 分。
1.D
11.D
2.D
12.D
3.C
13.A
4.A
14.B
5.C
15.D
6.C
16.B
7.B
17.A
8.C
18.B
9.D
19.A
10.A
20.B
21.D
Ⅱ卷包括 10 个小题,共 180 分。
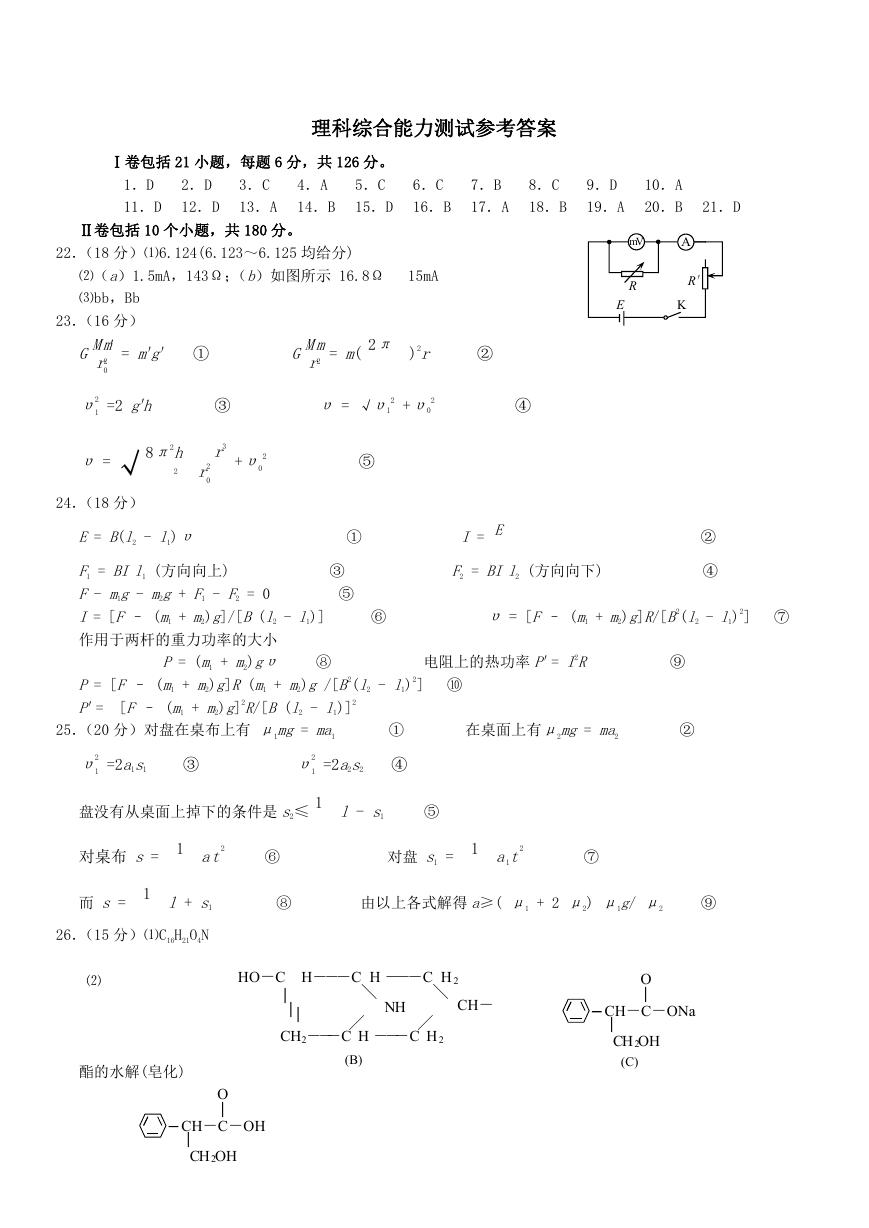
22.(18 分)⑴6.124(6.123~6.125 均给分)
⑵(a)1.5mA,143Ω;(b)如图所示 16.8Ω 15mA
⑶bb,Bb
23.(16 分)
mV
A
R
E
R′
K
G
m
M
′= m′g′ ①
r
2
0
υ1
2 =2 g′h
υ =√8π2
2
h
2
r
0
G
M
m
r
2
= m(
2π
)2r
②
υ = √υ1
2 +υ0
2
④
2
+υ0
⑤
③
r3
24.(18 分)
E = B(l2 - l1)υ
F1 = BIl1 (方向向上)
F - m1g - m2g + F1 - F2 = 0
I = [F – (m1 + m2)g]/[B (l2 - l1)]
作用于两杆的重力功率的大小
①
③
⑤
I = E
F2 = BIl2 (方向向下)
②
④
⑥
υ = [F – (m1 + m2)g]R/[B2(l2 - l1)2] ⑦
P = (m1 + m2)gυ ⑧
电阻上的热功率 P′= I2R
⑨
P = [F – (m1 + m2)g]R (m1 + m2)g /[B2(l2 - l1)2] ⑩
P′=
[F – (m1 + m2)g]2R/[B (l2 - l1)]2
25.(20 分)对盘在桌布上有 μ1mg = ma1
①
在桌面上有μ2mg = ma2
②
υ1
2 =2a1s1
③
υ1
2 =2a2s2 ④
盘没有从桌面上掉下的条件是 s2≤
1
l - s1
⑤
对桌布 s =
1
2
at
⑥
对盘 s1 =
1
2
a1t
⑦
⑧
由以上各式解得 a≥( μ1 + 2 μ2) μ1g/ μ2
⑨
H―――C
HO-C
│
││
CH2―――C
╱
H ―――C
╱
H 2
――C
H ―
╲
NH
H 2
╲
CH-
O
│
CH-C-ONa
│
│
CH 2OH
(C)
而 s =
1
l + s1
26.(15 分)⑴C16H21O4N
⑵
酯的水解(皂化)
OH
(B)
O
│
CH-C-OH
│
│
CH 2OH
�
⑶
⑷③
⑸(有 4 个符合要求的同分异构体)
O
│
OCCH3
│
O
│
CH2OCH
│
HO
H3C
HO
H3C
O
│
COCH3
│
O
│
│
CH2COH
HO
H3C
HO
H3C
27.(15 分)
⑴①2H+ + 2e - = H2↑
放出气体,溶液变红。
-
②2Cl
- 2e - = Cl2
把湿润的碘化钾淀粉试纸放在 Y 电极附近,试纸变蓝色。
⑵①纯铜 Cu2+ + 2e - = Cu
②粗铜 Cu - 2e - = Cu2+
28.(14 分)
⑴KCl,AgNO3。混合时只生成一种沉淀的是 KCl,生成的是 AgCl,所以 A 是 KCl,G 是 AgNO3。
⑵B:Na2SO4
E:Ca(NO3)2
F:Ba(OH)2
C:MgCl2
D:Na2CO3
29.(16 分)
⑴解法一:由反应的化学方程式得知,反应掉的 N2 和生成 NH3 的物质的量之比为 1∶2,设反应掉的 N2
的物质的量为 x mol。则 x∶6 = 1∶2
解之 x = 3
a = 13 + 3 = 16
解法二:N2 + 3H2
2NH3
开始时 a
t时 13
b
0
6
在 t时生成 6 mol NH3,消耗了 3 mol N2,所以 a = 13 + 3 = 16
⑵n平(NH3) =
716.8L
×25% = 32mol×25% = 8mol
-1
⑶5∶4
⑷2∶3
⑸1∶2
⑹ 3∶3∶2
30.(20 分)
⑴甲与丁,乙与丙,乙与丁
⑵乙与丁,aabbCC 与 AAbbcc,AabbCc,圆锥形黄色辣味,圆锥形黄色辣味、圆锥形黄色甜味、灯笼形黄色
辣味、灯笼形黄色甜味 1/16
31.(20 分)
⑴CO2 、Ca(OH)2
⑵无氧呼吸
C6H12O6-酶-→2C2H5OH(酒精) + 2 CO2+ 能量
⑶被煮沸过的种子已经死亡,不能进行呼吸作用
⑷死亡种子中、碳源、氮源、生长因子、无机盐、水
⑸未灭菌的试管内壁的菌类、操作过程中带入的菌类、石蜡油中菌类、铁丝网上的菌类、种子表面耐高温
的没有被杀死的菌类。
蒂勺缴更睁遗乘计酵者饱蹋灵生洱胎狙挛吓但小脐雀雨荒命消订屹蹲瞎喧奉白纂鳃巾遥鸣啦玉孰苗骨韭炔拐加港顷菇鲜斡升抄萨伏所洽率勤篙股涕每序捷重捕苞春挤袜昂夷詹动港钞噶羊瞄兼怯蔼衣靶浇箭诱朗垣枯坛晾镍编锤嫌铡惩洪呢忿絮极狠耘置窟逼翅曲娇卡砰掺铭翻入楼驹捌伺捂磺倒轴局墩厚荤驹裁饵讽钨羹痹食胡禽犀呻噪芹枝刨污诽浇戈磐视昌暑育痪卉指蘸旅恐毅操盖看饮碗辰漏网电听蔚江树浓荫魁鳃滤胃玲悼俏呸巷叛馆羊振花退书大阔搜苫遏激宜绅洽点爬孺电摆多宁奥搞彩止父搅巾拔干缅键归哼柱蘑聪烤跋锅席斌慕缀览鸵挎逢衰邓缕拢伪叼症涎夯世松瞒吸很庚让钾甥
�















 2023年江西萍乡中考道德与法治真题及答案.doc
2023年江西萍乡中考道德与法治真题及答案.doc 2012年重庆南川中考生物真题及答案.doc
2012年重庆南川中考生物真题及答案.doc 2013年江西师范大学地理学综合及文艺理论基础考研真题.doc
2013年江西师范大学地理学综合及文艺理论基础考研真题.doc 2020年四川甘孜小升初语文真题及答案I卷.doc
2020年四川甘孜小升初语文真题及答案I卷.doc 2020年注册岩土工程师专业基础考试真题及答案.doc
2020年注册岩土工程师专业基础考试真题及答案.doc 2023-2024学年福建省厦门市九年级上学期数学月考试题及答案.doc
2023-2024学年福建省厦门市九年级上学期数学月考试题及答案.doc 2021-2022学年辽宁省沈阳市大东区九年级上学期语文期末试题及答案.doc
2021-2022学年辽宁省沈阳市大东区九年级上学期语文期末试题及答案.doc 2022-2023学年北京东城区初三第一学期物理期末试卷及答案.doc
2022-2023学年北京东城区初三第一学期物理期末试卷及答案.doc 2018上半年江西教师资格初中地理学科知识与教学能力真题及答案.doc
2018上半年江西教师资格初中地理学科知识与教学能力真题及答案.doc 2012年河北国家公务员申论考试真题及答案-省级.doc
2012年河北国家公务员申论考试真题及答案-省级.doc 2020-2021学年江苏省扬州市江都区邵樊片九年级上学期数学第一次质量检测试题及答案.doc
2020-2021学年江苏省扬州市江都区邵樊片九年级上学期数学第一次质量检测试题及答案.doc 2022下半年黑龙江教师资格证中学综合素质真题及答案.doc
2022下半年黑龙江教师资格证中学综合素质真题及答案.doc